La Société Française d’Ecologie et d’Evolution (SFE2) vous propose un deuxième Regard d’Emmanuelle Porcher, Professeure d’Ecologie au Muséum national d’Histoire naturelle, sur les insectes et la pollinisation en cette période de changements globaux. Après un Regard (R109) sur la dynamique actuelle des insectes, notamment pollinisateurs, ce Regard R110 porte sur l’efficacité de la pollinisation.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
La pollinisation est-elle en crise?
Emmanuelle Porcher,
Professeure au Muséum national d’Histoire naturelle (MNHN),
lauréate du Prix SFE2 de la Recherche en 2021.
Regard R110, édité par Anne Teyssèdre
—-
Mots-clés : Pollinisation, pollinisateurs, plantes à fleurs, interactions écologiques, rendement des cultures
- Introduction
- Quelques rappels sur la pollinisation par les insectes
- Comment l’abondance et la diversité des pollinisateurs influencent-elles l’efficacité de la pollinisation ?
- Comment mesurer l’efficacité de la pollinisation ?
- Pollinisation des espèces cultivées
- Pollinisation des espèces sauvages
- En guise de conclusion
- Glossaire
- Remerciements
- Bibliographie
- Regards connexes
- Forum de discussion sur ce Regard
—–
Introduction
La pollinisation est un des services écosystémiques les plus mis en avant, aussi bien par la communauté scientifique que par les pouvoirs publics. Ainsi, à l’échelle internationale, la toute première évaluation de l’Intergovermental Science-Policy Plateform on Biodiversity and Ecosystem Services (IPBES), en 2016, a porté sur les pollinisateurs et la pollinisation. En France, citons le « Plan pollinisateurs » des Ministères de la Transition écologique et de l’Agriculture, le Groupement De Recherche francophone PollinEco très actif, tant pour la recherche que pour la prise de positions publiques, ou encore le nouveau « Programme et Equipement Prioritaire de Recherche » SOLU-BIOD, autour des solutions fondées sur la nature, mettant en avant la pollinisation… Si cet engouement pour la pollinisation par les insectes doit sûrement beaucoup au caractère sympathique de la plupart des petites bêtes qui visitent les jolies fleurs, il est aussi favorisé par la médiatisation de publications récentes au ton alarmant, qui avertissent sur l’« Armageddon », l’« apocalypse », la « situation désespérée » ou encore la « calamité » pour les insectes en général (Leather, 2018; Cardoso and Leather, 2019; McDermott, 2021), les pollinisateurs en particulier (Rhodes, 2018; Powney et al., 2019; Dicks et al., 2021).
Ces travaux, qui ont fait l’objet de controverses (voir le Regard R109 associé), posent la question des conséquences de ces possibles variations d’abondance et de diversité des insectes pollinisateurs pour la fonction écologique de pollinisation, pour les espèces de plantes cultivées comme pour les plantes sauvages. L’objet de ce regard est donc de faire un point sur l’état actuel des connaissances autour de la pollinisation et sur l’existence ou non d’une crise de cette pollinisation, et sur les développements nécessaires en recherche pour pouvoir instruire ces questions et proposer aux pouvoirs publics des mesures de conservation ambitieuses, étayées par les données de terrain.
Quelques rappels sur la pollinisation par les insectes
La pollinisation est une étape déterminante de la reproduction sexuée des plantes à fleurs ; il s’agit d’un processus de transfert de grains de pollen depuis la structure reproductrice mâle des fleurs (étamines), vers la surface réceptrice de la structure reproductrice femelle (carpelle, cf. Fig. 1), permettant à terme la fécondation et la production de graines et de fruits, sous réserve de viabilité du grain de pollen et de compatibilité entre les deux plantes parentes. Les plantes étant caractérisées entre autres par leur immobilité, ce transfert de pollen nécessite un vecteur mobile. Ce dernier peut être purement physique (i.e. abiotique), tel que le vent ou l’eau, comme c’est le cas pour beaucoup de graminées dont les céréales cultivées (maïs ou riz par exemple), qui sont pollinisées via le vent. Mais chez la plupart des plantes à fleurs, sauvages comme cultivées, le transport du pollen est assuré au moins en partie par des animaux, appelés pollinisateurs.
Les animaux pollinisateurs jouent un rôle écologique et économique fondamental dans les espaces agricoles et ailleurs. Dans tous les écosystèmes, y compris agricoles, ils permettent la reproduction de nombreuses espèces de plantes sauvages, donc le maintien de leurs populations et par conséquent des chaînes alimentaires qui reposent sur ces producteurs primaires : 80 à 90% des espèces de plantes à fleurs dépendent au moins en partie des pollinisateurs pour leur reproduction (Ollerton et al., 2011). Dans les espaces agricoles, les pollinisateurs sont indispensables pour la production d’une majorité d’espèces cultivées. Bien que les grandes cultures céréalières, pollinisées par le vent ou pratiquant l’autopollinisation*, ne dépendent pas d’animaux pollinisateurs pour leur production de graines, à l’échelle mondiale le rendement de 3/4 des espèces cultivées (représentant 35% de la production alimentaire mondiale) est amélioré par la présence de pollinisateurs (Klein et al., 2007). En Europe, cette dépendance des plantes aux pollinisateurs concerne 84% des espèces cultivées.
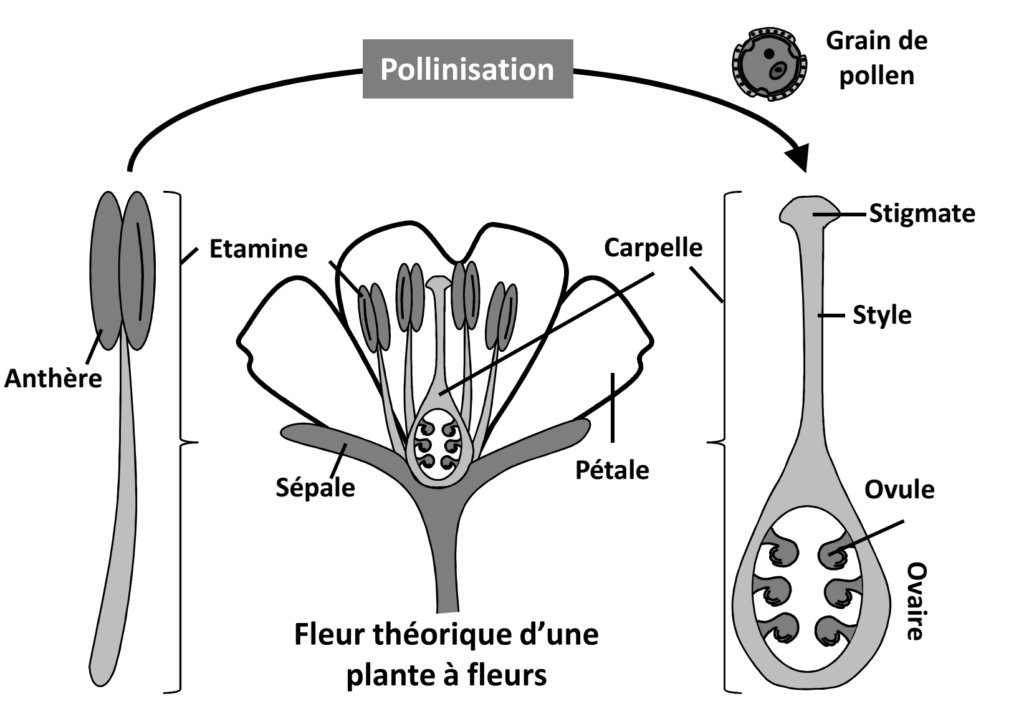
Figure 1 : Représentation schématique de l’étape de pollinisation. Le grain de pollen est produit dans les étamines des fleurs, structures reproductrices mâles. La pollinisation est le processus de transport du grain de pollen, sans capacité de déplacement autonome, vers la structure reproductrice femelle (carpelle), de la même fleur ou, plus souvent, d’une autre fleur sur une autre plante. La zone de réception du pollen est le stigmate. Suite à son dépôt sur le stigmate, le grain de pollen « germe » à l’intérieur du style, pour amener les cellules reproductrices mâles à proximité de la cellule reproductrice femelle, permettant la fécondation et la production de graines.
Dans les régions tempérées de l’« Ancien Monde », les pollinisateurs sont surtout des insectes, appartenant principalement à quatre ordres : hyménoptères (abeilles, bourdons…), diptères (mouches), lépidoptères (papillons) et coléoptères (scarabées…) (Rader et al., 2015). D’autres groupes (oiseaux et mammifères principalement) peuvent contribuer à la pollinisation ailleurs dans le monde, mais nous nous concentrerons ici sur les insectes. En région tempérée, une grande part de la pollinisation est souvent imputée aux abeilles sauvages et aux bourdons, mais des publications récentes suggèrent que d’autres groupes appartenant aux ordres mentionnés plus haut contribuent tout autant à la pollinisation, particulièrement pour les cultures (par exemple Rader et al. 2015). Enfin, les pollinisateurs domestiqués ou gérés (l’abeille domestique Apis mellifera et quelques espèces de bourdons en France) occupent une place particulière, car leur importance dans la pollinisation peut dépendre en grande partie des pratiques apicoles qui contrôlent la localisation et la densité des ruches. Par ailleurs certains auteurs suggèrent qu’ils peuvent être moins efficaces que les pollinisateurs sauvages (par exemple Garibaldi et al., 2013; Mallinger and Gratton, 2015).

Bourdon terrestre (Bombus terrestris) et fleur d’hibiscus. Tout comme l’Abeille domestique, le Bourdon terrestre est un insecte pollinisateur généraliste, très commun en Europe… mais sensible aux insecticides entre autres changements environnementaux !
(Cliché Alvesgaspar, CC BY-SA 3.0 ;)
Comment l’abondance et la diversité des pollinisateurs influencent-elles l’efficacité de la pollinisation ?
L’efficacité de la pollinisation par les animaux dépend en premier lieu de la composition et de la structure des communautés de pollinisateurs sauvages (par exemple Klein et al., 2003). Dans les populations naturelles de plantes, la production de graines ou de fruits est très souvent limitée par la quantité de pollen reçue par les fleurs (Ashman et al., 2004; Knight et al., 2005). L’efficacité de la pollinisation, mesurée par exemple par la production de graines, dépend en premier lieu de l’abondance des pollinisateurs, qui influence le nombre de visites reçues par les fleurs (Garibaldi et al., 2016; par exemple Morris et al., 2010). Cependant d’autres caractéristiques de la communauté de pollinisateurs peuvent affecter l’efficacité de la pollinisation. Ces caractéristiques ne sont pas les mêmes d’une espèce de plante à l’autre, en fonction notamment de :
- la dépendance des plantes aux pollinisateurs : elle peut être mesurée par la réduction de la production de graines ou de fruits en l’absence de pollinisateurs (Klein et al., 2007). Par exemple, certaines plantes, comme le colza, sont pollinisées aussi en grande partie par le vent et sont donc moyennement dépendantes aux pollinisateurs ;
- la spécialisation aux pollinisateurs : elle varie dans le sens inverse du nombre d’espèces de pollinisateurs susceptibles de visiter la plante et de transférer efficacement du pollen, avec un maximum pour l’association entre une plante et un unique pollinisateur. Pour certaines espèces de plantes très spécialistes, telles que la vanille ou la passiflore (fruit de la passion), la pollinisation dépend de l’abondance d’une seule ou de quelques espèces de pollinisateurs (Klein et al., 2007). Cependant, les relations plantes/pollinisateurs sont caractérisées par un très fort degré de généralisme (Bascompte et al., 2003; Waser et al., 1996); en d’autres termes, beaucoup d’espèces de plantes sont généralistes et susceptibles d’être pollinisées par plusieurs espèces de pollinisateurs.
Pour les plantes généralistes dépendantes des pollinisateurs, l’efficacité de la pollinisation (Albrecht et al., 2012; Fontaine et al., 2006; Fründ et al., 2013; Hoehn et al., 2008) et sa stabilité temporelle (Winfree et Kremen, 2009) peuvent également être améliorées par la diversité des pollinisateurs. En effet, différentes espèces de pollinisateurs peuvent se montrer complémentaires pour l’efficacité de la pollinisation ou pour assurer le maintien des visites dans l’espace, dans le temps, et face à des variations environnementales diverses.
Ce motif général, d’une pollinisation plus efficace quand les pollinisateurs sont plus abondants et plus divers, masque cependant une grande diversité de relation entre efficacité de la pollinisation et composition des communautés* de pollinisateurs. Des études locales montrent que si une diminution de l’abondance ou de la diversité des pollinisateurs est parfois associée à une diminution de l’efficacité de la pollinisation et une diminution des rendements pour les espèces cultivées, ce n’est pas toujours le cas, par exemple parce que quelques individus de quelques espèces de pollinisateurs peuvent suffire pour assurer la pollinisation de certaines espèces de plantes (Albrecht et al., 2020; Lowe et al., 2021).
A des échelles spatiales plus vastes, plusieurs études suggèrent a minima des changements dans la composition des communautés de pollinisateurs, et possiblement mais pas systématiquement, une diminution de leur abondance totale (voir le Regard R109 associé). Quelles sont les conséquences de ces variations à large échelle, pour la pollinisation ?
Comment mesurer l’efficacité de la pollinisation ?
En principe, il est assez simple d’évaluer la contribution des pollinisateurs à la reproduction des plantes à fleurs. Il « suffit » de manipuler le dépôt de pollen : ensachage des fleurs pour en interdire l’accès aux pollinisateurs, supplémentation en pollen pour détecter une limitation en pollen, etc. (Figure 2). En comparant les différents traitements, avec ou sans accès des pollinisateurs aux fleurs par exemple, on peut évaluer la contribution des pollinisateurs à la production de graines ou de fruits, le caractère suffisant de cette contribution, etc.
Cependant, derrière cette simplicité se cachent d’une part quelques complexités dans l’analyse des résultats. Par exemple, parce que l’ensachage lui-même peut avoir un effet sur la production de graines indépendamment du contrôle de l’accès des pollinisateurs ; ou parce que la manipulation de la pollinisation altère la répartition des ressources entre différentes fleurs d’une même plante… D’autre part, et surtout, ces manipulations expérimentales demandent un investissement en temps tel qu’il n’est pas envisageable de les déployer sur de très grandes surfaces et/ou des durées très longues (voir Hass et al., 2018; Reilly et al., 2020 pour quelques exceptions avec des projets d’envergure internationale ou nationale). D’autres options existent cependant pour estimer, directement ou indirectement, les variations de la pollinisation sur de grandes surfaces ou à long terme.

Figure 2 : Quelques illustrations des différentes techniques de manipulation de la pollinisation. a et b : pollinisation manuelle, d’une espèce d’orchidée (a) et d’une fleur de courge (b) ; c : ensachage pour exclure les pollinisateurs et soit forcer l’autopollinisation, soit permettre des croisements contrôlés par pollinisation manuelle, ici sur une espèce non pollinisée par les animaux, le mil ; d : castration (arrachage des étamines) pour empêcher l’autopollinisation chez la tomate. Crédits photographiques : a : USFWSmidwest (CC BY 2.0) ; b : Internet Archive Book Images (CC BY 2.0) ; c : Rik Schuiling / TropCrop – TCS (CC BY-SA 3.0) ; d : Monica Ozores-Hampton. Source : Ozores-Hampton (2014).
Pollinisation des espèces cultivées
Du fait de leur importance agronomique et socioéconomique, les espèces de plantes cultivées sont particulièrement suivies par des réseaux de professionnels de l’agriculture. En France, le Ministère de l’Agriculture met notamment en accès libre une base de données très riche, qui contient en particulier des données de rendement moyen des principales espèces cultivées, chaque année depuis 1990, à l’échelle du Département (https://agreste.agriculture.gouv.fr ). Ces données permettent de comparer les rendements des cultures en fonction de leur niveau de dépendance aux pollinisateurs, pour produire un indicateur de « pollinisation réalisée » à l’échelle nationale (Martin et al. 2019).
Cet indicateur correspond au rendement des cultures, standardisé pour permettre la comparaison entre des cultures très différentes, et rapporté au niveau de dépendance aux pollinisateurs, dans une zone donnée (ici, un Département français). Le principe général, qui consiste à comparer rendement des cultures dépendantes et non-dépendantes aux pollinisateurs est le suivant. Dans une zone donnée (ici un département), le rendement moyen des cultures non dépendantes des pollinisateurs (blé et maïs par exemple) donne une indication sur la qualité générale de ce département pour la production agricole (type de sol, climat, pratiques agricoles par exemple). Si le rendement des cultures dépendantes des pollinisateurs dans cette même zone est inférieur à cette valeur de référence donnée par le rendement des cultures non dépendantes, cela suggère un déficit de pollinisation. Si au contraire le rendement des cultures dépendantes des pollinisateurs est supérieur à la valeur de référence, cela suggère que la pollinisation y est moins limitante qu’ailleurs.
Le calcul de cet indicateur à l’échelle nationale montre un gradient nord-sud assez marqué, avec un déficit de pollinisation dans le nord de la France, et moins de problème de pollinisation dans le sud (Figure 3), ce qui est cohérent avec ce que l’on sait d’une part de l’intensité de l’agriculture sur le territoire, plus intensive dans le nord, et de l’écologie des pollinisateurs, plus abondants et plus divers dans le sud.
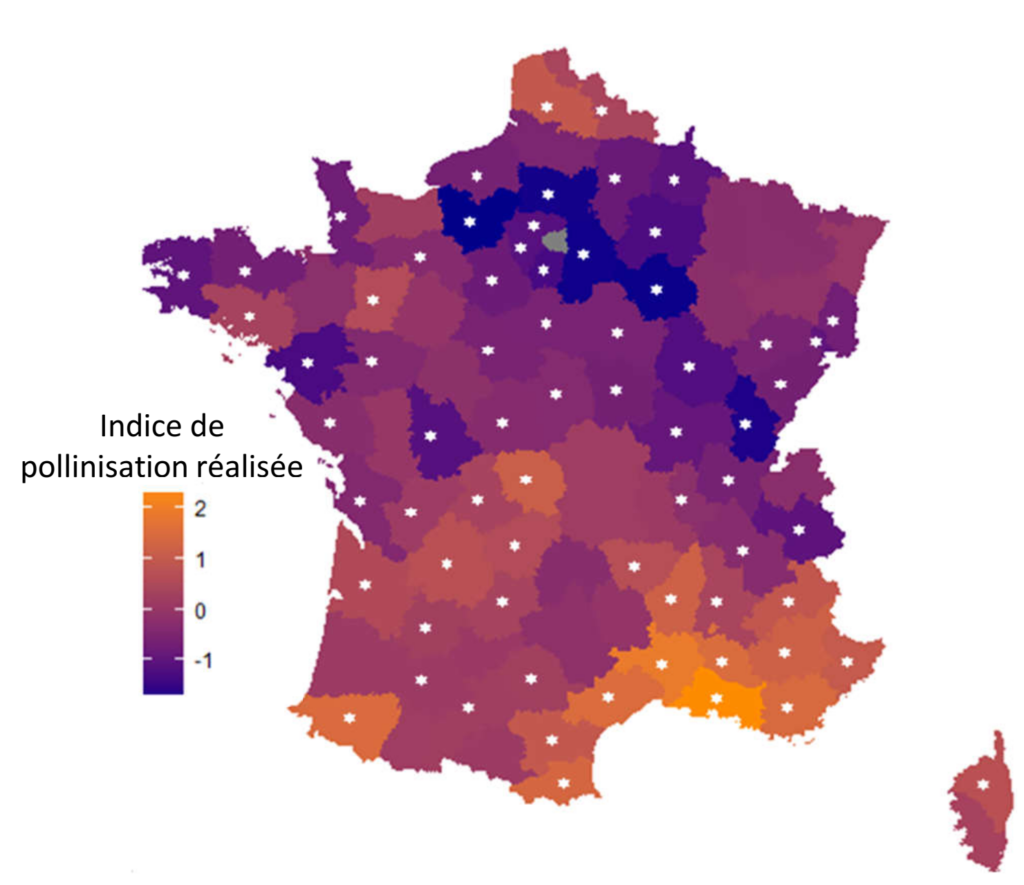
Figure 3 : Carte de l’indice de pollinisation réalisée en France (Source: Martin et al., 2019). Le gradient du bleu vers l’orange classe les départements selon l’efficacité locale croissante de la pollinisation des cultures (dépendantes de la pollinisation) par les insectes.
On peut aussi utiliser ces données pour comparer l’efficacité de la pollinisation non pas entre les départements mais selon les années, depuis 1990. Le calcul donne le graphique suivant (Figure 4), avec à première vue une diminution assez nette de l’indice de pollinisation au cours du temps. Malheureusement, un examen plus poussé des données révèle assez rapidement que le protocole de récolte des données a changé en 2000, ce qui implique que les cultures et les départements concernés par ces données ne sont pas les mêmes avant et après 2000. Si on examine séparément chaque période, on constate alors qu’il n’y a pas de variation systématique de la valeur de l’indicateur au cours du temps. Comme déjà souligné dans le Regard R109, l’hétérogénéité des données et la non-poursuite d’un suivi sur le long terme interdisent de répondre clairement à la question « La pollinisation est-elle en déclin ? ».
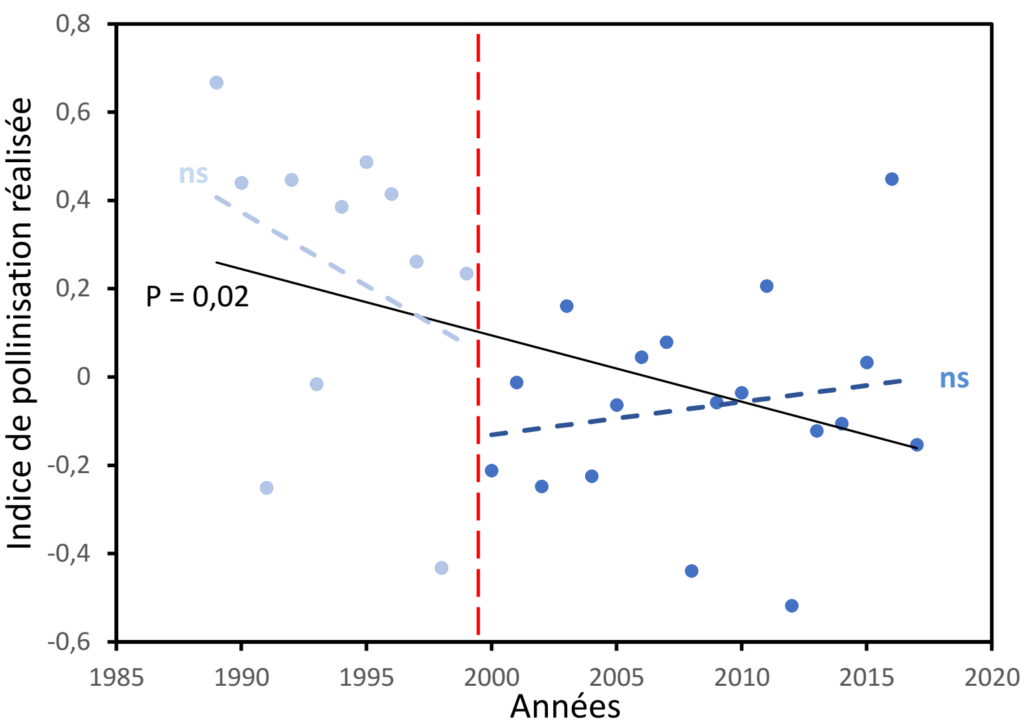
Figure 4 : Variations temporelles de l’indice de pollinisation réalisée, calculé à partir des données de rendement des plantes cultivées (données Agreste du ministère de l’agriculture). Telles quelles, ces variations suggèrent une diminution de la pollinisation entre 1990 et 2017 : il existe une diminution significative au cours du temps entre 1989 et 2017 (ligne noire continue). Malheureusement, un changement de méthodologie en 2000 (ligne rouge verticale) rend les deux périodes non comparables. Au sein de chaque période (1989-1999 et 2000-2017), aucune tendance temporelle significative n’est détectée (lignes pointillées bleu clair et bleu foncé, « ns »). Figure inspirée des travaux de Magdalena Brügger (2019).
Pollinisation des plantes sauvages
Pour les espèces de plantes sauvages, nous ne disposons malheureusement pas de données de production de graines à large échelle, mais il est possible d’étudier indirectement l’efficacité de la pollinisation en comparant les dynamiques écologiques d’espèces plus ou moins dépendantes des pollinisateurs, ou en étudiant leur évolution biologique.
Les travaux de Biesmeijer et al. (2006) ont apporté l’un des premiers indices d’une diminution de l’efficacité de la pollinisation pour les plantes sauvages, en examinant les disparitions locales conjointes d’espèces de plantes et de pollinisateurs (abeilles et syrphes, un groupe de mouches très impliqué dans la pollinisation) aux Pays-Bas et en Grande-Bretagne, en comparant deux périodes : avant et après 1980. L’étude montre une diminution du nombre d’espèces observées localement entre ces deux périodes chez les abeilles sauvages pour les deux pays, et uniquement en Grande-Bretagne chez les syrphes (Fig. 5). En parallèle, les espèces de plantes dépendantes des pollinisateurs, et particulièrement celles spécialisées sur la pollinisation par les abeilles sauvages au Pays-Bas, ont subi plus de disparitions locales que les autres plantes, entraînant une réduction de leur aire de distribution.
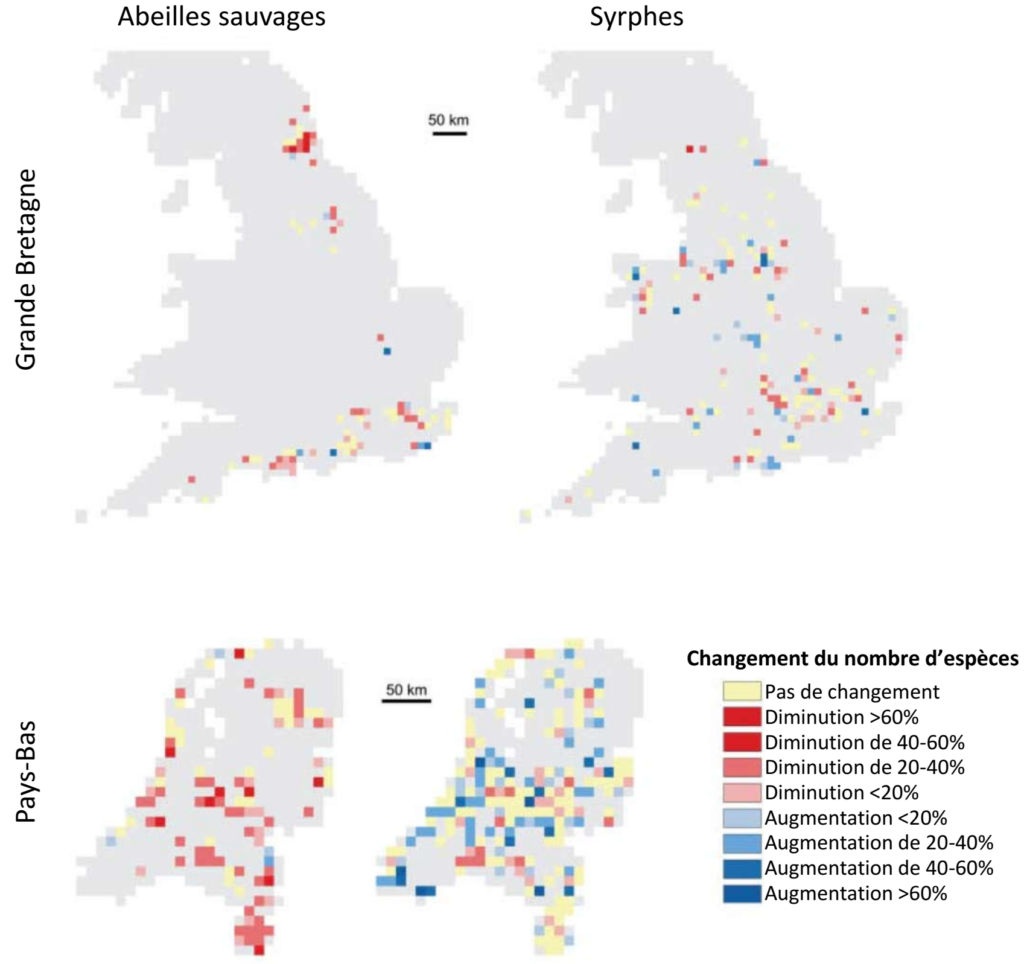
Figure 5 : Changements temporels du nombre d’espèces d’abeilles sauvages (gauche) ou de syrphes (droite) entre deux périodes : avant 1980 et après 1980, dans des carrés de 10kmx10km en Grande-Bretagne et Pays-Bas. Les changements n’ont été mesurés que dans les carrés contenant suffisamment de données d’observation des espèces. D’après Biesmeijer et al. (2006).
Ces travaux importants demandent un large recul temporel, car il faut du temps pour que les diminutions d’abondance d’une espèce se traduisent par des disparitions complètes de populations.
Des suivis temporels de l’abondance des espèces permettent d’étudier, presque en temps réel, les variations de taille de population et les causes probables de ces variations. C’est ce que permettent les suivis de sciences participatives Vigie-nature, qui couvrent une grande diversité de groupes du monde vivant, dont les plantes. Vigie-flore est un programme de suivi de la flore de France impliquant des botanistes expert.e.s bénévoles, coanimé par le Muséum national d’Histoire naturelle et le réseau de botanistes francophones Tela Botanica. Depuis 2009, plus de 400 participant.es ont suivi près de 3800 sites distribués dans toute la France métropolitaine, en appliquant un protocole standardisé pour la récolte des données, ce qui permet des comparaisons dans l’espace et dans le temps.
Ce suivi permet de caractériser les changements de composition des communautés de plantes au cours du temps, montrant par exemple une augmentation des préférences thermiques de ces communautés en réponse aux changements climatiques (Martin et al. 2019), mais aussi de mesurer les changements d’abondance pour plusieurs centaines d’espèces communes. Ces changements temporels d’abondance sont variables d’une espèce à l’autre, avec certaines espèces en augmentation et d’autres en diminution, mais certains motifs peuvent être identifiés. En particulier, il apparaît qu’en moyenne, les espèces de plantes les plus dépendantes des pollinisateurs diminuent davantage que celles peu dépendantes (Fig. 6). Ces résultats corroborent donc, pour la France et sur un pas de temps court, les observations de Biesmeijer et al. (2006) réalisées sur plusieurs décennies aux Pays-Bas et en Grande-Bretagne, et ont été récemment confirmés par le même phénomène rapide aux Pays-Bas (Ehlers et al., 2021) : les changements des communautés de pollinisateurs ont eu, et semblent toujours avoir, un impact négatif sur la reproduction des plantes à fleurs les plus dépendantes des pollinisateurs.
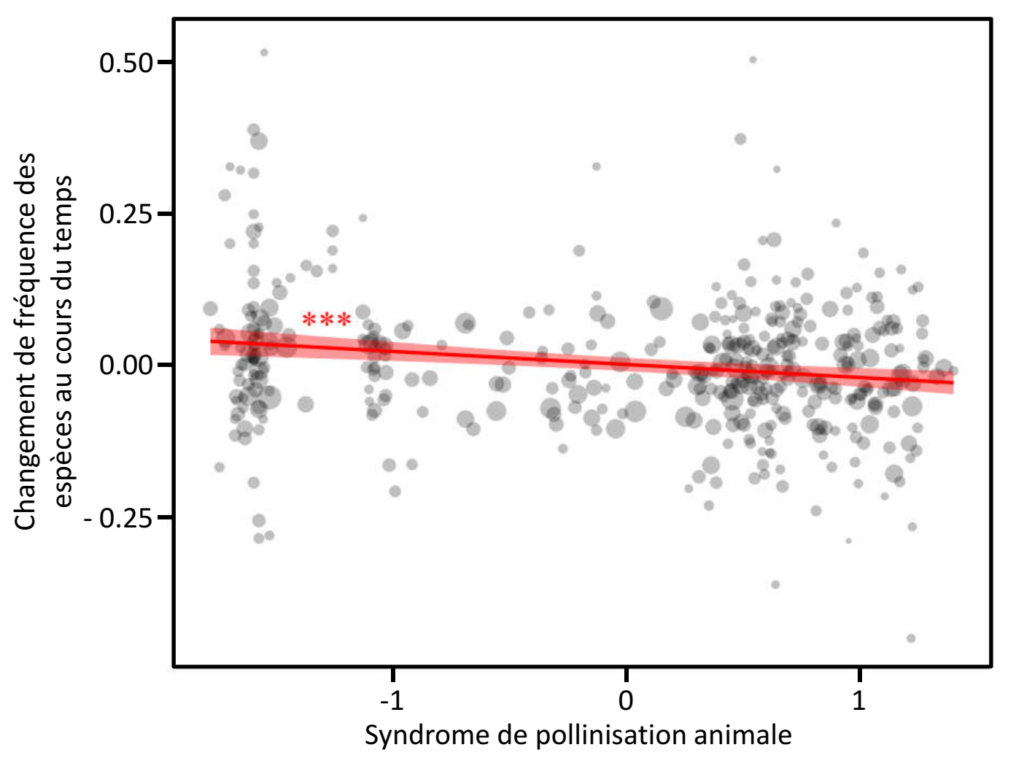
Figure 6 : Relation entre les changements de fréquence au cours du temps de 408 des espèces de plantes à fleurs les plus communes en France et leur « syndrome de pollinisation animale », un indicateur résumant les principales caractéristiques des fleurs en termes de leur relation aux pollinisateurs (couleur, forme, production de nectar, dépendance aux pollinisateurs…). Ce syndrome ordonne les espèces selon un gradient qui va des espèces peu dépendantes des pollinisateurs, avec des fleurs vertes ou marrons, ne produisant pas de nectar (valeurs négatives) aux espèces très dépendantes des pollinisateurs pour leur reproduction avec des fleurs colorées (bleues, roses, jaunes…) et produisant du nectar. Chaque cercle gris correspond à une espèce, et son diamètre augmente avec la précision de l’estimation des changements de fréquence pour cette espèce. La bande rouge représente l’intervalle de confiance à 95% de la relation entre changements de fréquence et syndrome de pollinisation. Graphique issu du travail d’Etienne Henry (2020).
Les changements des communautés de pollinisateurs peuvent donc avoir des effets non seulement sur les variations relatives d’abondance des espèces de plantes et sur la composition des communautés, mais également sur l’évolution biologique des espèces. Cheptou et al. (2022) ont montré par exemple, grâce à des expériences de « résurrection » mettant en culture des graines stockées pendant près de 20 ans, qu’une population de pensée des champs est devenue moins dépendante aux pollinisateurs entre 1991 et 2012. Cette évolution génétique de la population a conduit à des fleurs plus petites, moins hautes, et moins colorées en l’espace de 20 ans, ce qui les rend moins attractives pour les pollinisateurs. En contrepartie cependant, ces fleurs ont augmenté leur capacité à s’autopolliniser, ce qui leur permet de maintenir leur reproduction en dépit des changements dans les communautés de pollinisateurs.
En guise de conclusion : conséquences pour la conservation
Il reste difficile aujourd’hui de mettre en évidence des variations temporelles dans l’abondance ou la diversité des pollinisateurs (Regard R109), ou dans l’efficacité de la pollinisation, du fait de l’hétérogénéité des données disponibles et du manque de suivis sur le long terme. Cependant, les quelques suivis standardisés existants, notamment Vigie-flore, suggèrent qu’un cercle vicieux est amorcé, dans lequel la disparition des pollinisateurs contribue à la disparition des plantes à fleurs qui en dépendent, et vice-versa. Même si le détail fin des mécanismes responsables de ces déclins est encore mal connu, nous avons cependant déjà tous les éléments pour identifier les principales causes de déclin, et mettre en place des mesures de conservation, notamment grâce à l’étude des variations spatiales des communautés de pollinisateurs et de la pollinisation.
Les recommandations pour la conservation des pollinisateurs et de la pollinisation sont disponibles dans le rapport de l’IPBES ou par exemple dans l’article de Gill et al. (2016), et je ne les détaillerai pas ici. Elles supposent le maintien de grandes populations, avec une diversité génétique élevée permettant l’adaptation des populations face aux changements en cours de leur environnement, tels que les changements climatiques ou l’expansion géographique de parasites ou prédateurs nouveaux. Elles incluent aussi le maintien et la restauration des éléments -stables- du paysage qui favorisent l’alimentation, la reproduction et les déplacements de ces pollinisateurs (prairies, forêts, haies, bandes fleuries, jachères…) et l’arrêt de l’utilisation des produits phytosanitaires, en particulier les insecticides, un élément qui n’apparaît pas clairement dans le Plan Pollinisateurs en cours. Ceci suppose des changements majeurs dans l’aménagement du territoire, que ce soit en milieu urbain ou agricole.
Pour affiner ces recommandations génériques, mieux caractériser et mieux comprendre les changements des pollinisateurs et de la pollinisation, il faudra continuer les suivis déjà initiés (en maintenant les mêmes protocoles aussi longtemps que possible, pour assurer la comparabilité des données) et mettre en place de nouveaux suivis standardisés, mais aussi s’assurer d’une mise à disposition large des données ainsi récoltées, pour bénéficier d’une intelligence collective dans l’analyse de ces phénomènes complexes.
Glossaire
Autopollinisation : pollinisation d’une fleur par elle-même
Communauté écologique ou biotique : Ensemble de populations d’espèces différentes, partageant certaines caractéristiques écologiques (souvent : espèces de même niveau trophique), occupant un même site ou une même région géographique.
Ecosystème : ensemble des êtres vivants, de leur environnement physicochimique et de leurs interactions (notamment échanges de matière et d’énergie) dans un même site.
Remerciements
Ce texte est le résultat de réflexions collectives avec notamment François Duchenne, Colin Fontaine et Gabrielle Martin, et a été fortement alimenté par les travaux de master d’Etienne Henry et Magdalena Brügger. Je remercie également tou.tes les participant.es aux programmes Vigie-nature, particulièrement Vigie-flore, sans qui une bonne partie de ces travaux de recherche ne seraient pas possibles. Merci enfin à Anne Teyssèdre, éditrice de ce Regard, pour sa relecture attentive et ses suggestions.
Bibliographie
Albrecht M., Kleijn D., Williams N.M. et al., 2020. The effectiveness of flower strips and hedgerows on pest control, pollination services and crop yield: a quantitative synthesis. Ecol. Lett. 23, 1488–1498. https://doi.org/10.1111/ele.13576
Albrecht M., Schmid B., Hautier Y. & Müller C.B., 2012. Diverse pollinator communities enhance plant reproductive success. Proc. R. Soc. B Biol. Sci. 279, 4845–4852.
Ashman T.L., Knight T.M., Steets J.A. et al., 2004. Pollen limitation of plant reproduction: ecological and evolutionary causes and consequences. Ecology 85, 2408–2421. https://doi.org/10.1890/03-8024
Bascompte J., Jordano P., Melian C.J. & Olesen J.M., 2003. The nested assembly of plant-animal mutualistic networks. Proc. Natl. Acad. Sci. U. S. A. 100, 9383–9387. https://doi.org/10.1073/pnas.1633576100
Biesmeijer J.C., Roberts S.P.M., Reemer M. et al., 2006. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science 313, 351–354. https://doi.org/10.1126/science.1127863
Brügger M., 2019. Etude de la tendance temporelle du service de pollinisation des cultures en France (Rapport de Master 1). Université Paris-Saclay.
Cardoso P. & Leather S.R., 2019. Predicting a global insect apocalypse. Insect Conserv. Divers. 12, 263–267. https://doi.org/10.1111/icad.12367
Cheptou P.-O., Imbert E. & Thomann M., 2022. Rapid evolution of selfing syndrome traits in Viola arvensis revealed by resurrection ecology. Am. J. Bot. https://doi.org/10.1002/ajb2.16028
Dicks L.V., Breeze T.D., Ngo H.T. et al., 2021. A global-scale expert assessment of drivers and risks associated with pollinator decline. Nat. Ecol. Evol. 5, 1453-+. https://doi.org/10.1038/s41559-021-01534-9
Ehlers B.K., Bataillon T. & Damgaard C.F., 2021. Ongoing decline in insect-pollinated plants across Danish grasslands. Biol. Lett. 17, 20210493. https://doi.org/10.1098/rsbl.2021.0493
Fontaine C., Dajoz I., Meriguet J. & Loreau M., 2006. Functional diversity of plant-pollinator interaction webs enhances the persistence of plant communities. Plos Biol. 4, 129–135. https://doi.org/10.1371/journal.pbio.0040001
Fründ J., Dormann C.F., Holzschuh A. & Tscharntke T., 2013. Bee diversity effects on pollination depend on functional complementarity and niche shifts. Ecology 94, 2042–2054.
Garibaldi L.A., Carvalheiro L.G., Vaissiere B.E. et al., 2016. Mutually beneficial pollinator diversity and crop yield outcomes in small and large farms. SCIENCE 351, 388–391. https://doi.org/10.1126/science.aac7287
Garibaldi L.A., Steffan-Dewenter I., Winfree R. et al., 2013. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science 339, 1608–1611. https://doi.org/10.1126/science.1230200
Gill R.J., Baldock K.C.R., Brown M.J.F. et al., 2016. Protecting an Ecosystem Service: Approaches to Understanding and Mitigating Threats to Wild Insect Pollinators, in: Woodward, G., Bohan, D.A. (Eds.), Ecosystem Services: From Biodiversity to Society, Pt 2. pp. 135–206.
Hass A.L., Kormann U.G., Tscharntke T. et al., 2018. Landscape configurational heterogeneity by small-scale agriculture, not crop diversity, maintains pollinators and plant reproduction in western Europe. Proc. R. Soc. B-Biol. Sci. 285, 20172242. https://doi.org/10.1098/rspb.2017.2242
Henry E., 2020. Impacts du déclin des pollinisateurs sur la flore commune de France (Rapport de Licence 3). Ecole Normale Supérieure de Paris.
Hoehn P., Tscharntke T., Tylianakis J. & Steffan-Dewenter I., 2008. Functional group diversity of bee pollinators increases crop yield. Proc. R. Soc. B-Biol. Sci. 275, 2283–2291. https://doi.org/10.1098/rspb.2008.0405
Klein A.M., Steffan-Dewenter I. & Tscharntke T., 2003. Fruit set of highland coffee increases with the diversity of pollinating bees. Proc. R. Soc. B-Biol. Sci. 270, 955–961. https://doi.org/10.1098/rspb.2002.2306
Klein A.M., Vaissière B.E., Cane J.H. et al., 2007. Importance of pollinators in changing landscapes for world crops. Proc. R. Soc. B-Biol. Sci. 274, 303–313. https://doi.org/10.1098/rspb.2006.3721
Knight T.M., Steets J.A., Vamosi J.C. et al., 2005. Pollen limitation of plant reproduction: pattern and process. Annu. Rev. Ecol. Evol. Syst. 36, 467–497.
Leather S.R., 2018. “Ecological Armageddon” – more evidence for the drastic decline in insect numbers. Ann. Appl. Biol. 172, 1–3. https://doi.org/10.1111/aab.12410
Lowe E.B., Groves R. & Gratton C., 2021. Impacts of field-edge flower plantings on pollinator conservation and ecosystem service delivery – A meta-analysis. Agric. Ecosyst. Environ. 310, 107290. https://doi.org/10.1016/j.agee.2020.107290
Mallinger R.E. & Gratton C., 2015. Species richness of wild bees, but not the use of managed honeybees, increases fruit set of a pollinator-dependent crop. J. Appl. Ecol. 52, 323–330. https://doi.org/10.1111/1365-2664.12377
Martin G., Fontaine C., Accatino F. & Porcher E., 2019. New indices for rapid assessment of pollination services based on crop yield data: France as a case study. Ecol. Indic. 101, 355–363. https://doi.org/10.1016/j.ecolind.2019.01.022
McDermott A., 2021. To understand the plight of insects, entomologists look to the past. Proc. Natl. Acad. Sci. U. S. A. 118, e2018499117. https://doi.org/10.1073/pnas.2018499117
Morris W.F., Vazquez D.P. & Chacoff N.P., 2010. Benefit and cost curves for typical pollination mutualisms. Ecology 91, 1276–1285. https://doi.org/10.1890/08-2278.1
Ollerton J., Winfree R. & Tarrant S., 2011. How many flowering plants are pollinated by animals? Oikos 120, 321–326. https://doi.org/10.1111/j.1600-0706.2010.18644.x
Ozores-Hampton M., 2014. Hand pollination of tomato for breeding and seed production. UFIFAS Ext. 5.
Powney G.D., Carvell C., Edwards M. et al., 2019. Widespread losses of pollinating insects in Britain. Nat. Commun. 10, 1018. https://doi.org/10.1038/s41467-019-08974-9
Rader R., Bartomeus I., Garibaldi L.A. et al., 2015. Non-bee insects are important contributors to global crop pollination. Proc. Natl. Acad. Sci. 201517092. https://doi.org/10.1073/pnas.1517092112
Reilly J.R., Artz D.R., Biddinger D. et al., 2020. Crop production in the USA is frequently limited by a lack of pollinators. Proc. R. Soc. B-Biol. Sci. 287, 20200922. https://doi.org/10.1098/rspb.2020.0922
Rhodes C.J., 2018. Pollinator decline – an ecological calamity in the making? Sci. Prog. 101, 121–160. https://doi.org/10.3184/003685018X15202512854527
Waser N.M., Chittka L., Price M.V. et al., 1996. Generalization in pollination systems, and why it matters. Ecology 77, 1043–1060. https://doi.org/10.2307/2265575
Winfree R. & Kremen C., 2009. Are ecosystem services stabilized by differences among species? A test using crop pollination. Proc. R. Soc. B-Biol. Sci. 276, 229–237. https://doi.org/10.1098/rspb.2008.0709
Regards connexes :
Couvet D. et A. Teyssèdre, 2011. Biodiversité et sciences participatives. Regards et débats sur la biodiversité, SFE2, Regard R11, février 2011.
Fontaine R. et al. Impact de l’urbanisation et des pratiques de jardinage sur les communautés de papillons. Regards et débats sur la biodiversité, SFE2, Regard R69, janvier 2017.
Gouyon P-H., 2020. Regard sur le livre de S. Foucard: « Et le monde devint silencieux ». Regards et débats sur la biodiversité, SFE2, Regard RO14, juillet 2020.
Porcher E., 2023. Y a-t-il un déclin des insectes, notamment pollinisateurs ? Regards et débats sur la biodiversité, SFE2, Regard R109, mai 2023.
Teyssèdre A., 2022. Impacts de l’agriculture sur la biodiversité et le fonctionnement des écosystèmes. Regards et débats sur la biodiversité, SFE2, Regard R103, mai 2022.
Et ces Regards consultables par thématique :
- Regards sur les changements globaux : https://www.sfecologie.org/tag/changements-globaux/
- Regards sur les méthodes et outils : https://sfecologie.org/tag/methodes-et-outils/
- Regards sur l’érosion de la biodiversité : https://sfecologie.org/tag/erosion-extinctions/
- Sur les facteurs d’impact (sur la biodiversité) : https://www.sfecologie.org/tag/facteurs-dimpact/
- Regards sur l’agriculture : https://www.sfecologie.org/tag/agriculture
- Regards sur les habitats : https://sfecologie.org/tag/habitats/
- Sur les services écosystémiques : https://sfecologie.org/tag/services-ecosystemiques/
—–
Regard R110, édité par Anne Teyssèdre.
——-

[Nous validons le commentaire ci-dessous, bien qu’il soit en espagnol(!) AT]
En la Península Ibérica hay 2 grandes zonas de polinización: eurosiberiana (Cordillera Cántabro-Pirenaica y anexos) y mediterránea (resto). En la primera, los grupos de polinizadores principales son abejorros, abejas solitarias y sírfidos mientras que en la segunda son las abejas solitarias y los bombílidos. Los datos de campo recogidos durant 40 años (inéditos) muestran que el cambio climático no tiene incidencia sobre la polinización de los ecosistemas terrestres silvestres sino sólo sobre la distribución (diversidad y abundancia) de los grupos de polinizadores principales (y complementarios).
Gracias por su comentario 😉
Effectivement, un changement de composition et même d’abondance des communautés de pollinisateurs ne se traduit pas toujours par une moindre pollinisation (cf. ci-dessus). Vivement que ces 40 années de données soient publiées, j’ai hâte de les voir !
Bonjour,
Les abeilles domestiques ont tendance à être mise sur un pied d’estale [piédestal] : installation de ruches dans les écoles, mairies (ville), entreprises, etc.. Toutefois, le développement des abeilles domestiques ne risque-t-il pas de nuire aux abeilles sauvages. Est-ce bien écologique ?
Effectivement la présence de gros ruchers, et donc d’un très grand nombre d’abeilles domestiques, dans un environnement, implique nécessairement un prélèvement supplémentaire de ressources alimentaires florales, et certaines études montre que ce prélèvement peut avoir des conséquences pour les pollinisateurs sauvages et également être à l’origine d’une compétition entre ruches d’abeilles domestiques. Cependant, ne perdons pas de vue que la présence de ruches n’est probablement pas la principale cause de changements dans les communautés d’insectes (voir le rapport IPBES sur les pollinisateurs et la pollinisation qui liste les principales causes : destruction des habitats, agriculture, pollutions…).
Si l’on souhaite restaurer un bon fonctionnement des réseaux d’interactions plantes/pollinisateurs, avant d’introduire des ruches, il peut être plus efficace de s’assurer de la présence de ressources pour les pollinisateurs sauvages (ressources florales abondantes, disponibles en continu tout au long de l’année, et sites pour la nidification) afin d’augmenter l’abondance et la diversité de ces derniers. Si l’on souhaite récolter du miel, les ruches d’abeilles domestiques sont incontournables, mais là encore il faut s’assurer que des ressources alimentaires sont disponibles en quantité, pour les abeilles domestiques comme pour les espèces sauvages.
Références :
– Henry M & Rodet G, 2020. The apiary influence range: A new paradigm for managing the cohabitation of honey bees and wild bee communities. Acta Oecologica, 105:103555. https://doi.org/10.1016/j.actao.2020.103555.
– Henry M. & Rodet G, 2018a. Controlling the impact of the managed honeybee on wild bees in protected areas. Sci Rep 8, 9308. https://doi-org.inee.bib.cnrs.fr/10.1038/s41598-018-27591-y
– Henry M. & Rodet G., 2018b. Étude des interactions écologiques entre l’abeille domestique et les abeilles sauvages dans un espace naturel protégé: le massif de la Côte Bleue, site du Conservatoire du Littoral. Rapport d’étude, convention Recherche & Développement CdL-‐INRA-‐ADAPI n2014CV18. https://hal.inrae.fr/hal-03594624
– https://www.ipbes.net/assessment-reports/pollinators