Cliché Yves Bas, MNHN
La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce mois-ci et le suivant deux Regards d’Emmanuelle Porcher, Professeure d’Ecologie au Muséum national d’HIstoire naturelle, sur les insectes et la pollinisation des plantes. Ce premier Regard (R109) scrute la dynamique actuelle des insectes, notamment pollinisateurs. [Le prochain portera sur l’efficacité de la pollinisation par les insectes et son éventuel déclin, en France et ailleurs.]
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
Y-a-t-il une crise des insectes,
notamment pollinisateurs ?
Emmanuelle Porcher,
Professeure au Muséum national d’Histoire naturelle (MNHN),
lauréate du Prix SFE2 de la Recherche en 2021.
Regard R109, édité par Anne Teyssèdre
—-
Mots-clés : Insectes, abondance, communautés écologiques, crise de la biodiversité, suivis de biodiversité, sciences participatives, méthodes d’analyse, données opportunistes.
- Introduction
- Que disent les recherches sur la dynamique actuelle des insectes ?
- Conclusions
- Glossaire
- Remerciements
- Bibliographie
- Regards connexes
- Forum de discussion sur ce Regard
—–
Introduction
La crise actuelle de la biodiversité est un fait, documenté de façon non ambiguë pour les mammifères (par exemple Ceballos et al., 2017, 2015) et plus généralement les vertébrés, même si quelques débats subsistent autour de certains indicateurs comme l’Indice Planète Vivante (Leung et al., 2020; Loreau et al., 2022; Mehrabi and Naidoo, 2022). Pour d’autres groupes cependant, le consensus n’est pas encore atteint. C’est le cas des arthropodes, et particulièrement des insectes. Pour ce ou ces groupes, un nombre d’études scientifiques croissant alerte sur le déclin, voire un « Armageddon », une « apocalypse », une « situation désespérée » ou encore une « calamité » pour les insectes en général (Cardoso and Leather, 2019; Leather, 2018; McDermott, 2021), et pour une sous-partie des insectes avec un intérêt économique et culturel fort : les pollinisateurs (Dicks et al., 2021; Powney et al., 2019; Rhodes, 2018).
Les mécanismes généraux sont assez bien identifiés, ils sont à peu de choses près les mêmes que pour le reste de la biodiversité : dégradation et destruction des habitats, utilisation des terres (dont usage de pesticides), changements climatiques, maladies, parasites et interactions avec les pollinisateurs gérés et plus généralement avec des espèces introduites… Leur importance relative et leurs variations dans l’espace et dans le temps sont cependant moins bien connues, même si quelques études récentes commencent à proposer des évaluations quantitatives (Outhwaite et al., 2022). Par ailleurs ces travaux, qui abordent souvent la question des changements temporels dans l’abondance des insectes ou des arthropodes à des échelles spatiales vastes (continents ou monde entier), pointent une diminution de biomasse et/ou de diversité des insectes, mais ont été confrontés à d’autres approches qui ne montrent pas un tel déclin. Cette opposition a fait récemment l’objet de controverses sur la pertinence des données et analyses statistiques utilisées pour mettre en évidence ces changements d’abondance des insectes.
L’objet de ce regard est de faire un point, nécessairement partiel, sur l’état actuel des connaissances autour de ces variations d’abondance des insectes, avec un intérêt particulier pour les insectes pollinisateurs, en lien avec le « Regard » suivant (R110) qui s’interroge sur la crise de la pollinisation.
Que disent les recherches sur la dynamique actuelle des insectes ?
Depuis une vingtaine d’années, les études s’accumulent qui suggèrent des changements importants dans les populations et les communautés* d’insectes, dont les pollinisateurs. Différentes approches sont mobilisées pour caractériser ces changements et comprendre les mécanismes à l’œuvre : i) des suivis standardisés, par exemple de la biomasse des insectes (Hallmann et al., 2017) ; ii) l’utilisation de données opportunistes* de type présence/absence, permettant soit ii-a) l’identification d’extinctions locales sur une longue période de temps, chez les insectes pollinisateurs et chez les plantes (Biesmeijer et al., 2006), soit ii-b) l’inférence de probabilités d’occurrence, en contrôlant plus ou moins efficacement les possibles biais liés à l’aspect opportuniste de la collecte de données grâce à de nouveaux outils d’analyse (Isaac et al., 2014; van Strien et al., 2013) ; ou encore iii) une combinaison de ces différentes approches (van Klink et al., 2020).
Ces travaux autour des insectes, voire des arthropodes en général, ont été récemment au cœur d’un débat (Desquilbet et al., 2020; Dornelas and Daskalova, 2020; McDermott, 2021) concernant l’ampleur, et même la direction, positive ou négative, des changements temporels d’abondance estimés (Fig. 1). En effet, certaines études s’appuyant sur des méthodes standardisées ont montré une forte diminution de l’abondance (Ball et al., 2022; Hallmann et al., 2017; Seibold et al., 2019), alors que des analyses de jeux de données compilant des séries temporelles hétérogènes ont mis en évidence un déclin des arthropodes terrestres, mais une augmentation des arthropodes aquatiques (Pilotto et al., 2020; van Klink et al., 2020), ou aucun déclin à l’échelle des Etats-Unis (Crossley et al., 2020). Enfin, une analyse de données dites « opportunistes* », c’est-à-dire récoltées sans protocole prédéfini, a révélé une dynamique non monotone* mais aucun déclin à l’échelle mondiale (Outhwaite et al., 2020).

Figure 1 : Quelques exemples de publications récentes autour des variations temporelles des populations et communautés d’insectes. Ces articles ont été publiés entre 2017 et 2021.
Les clés de la controverse : comment expliquer la divergence des estimations ?
La controverse est née autour de ces résultats contradictoires, en soulignant en particulier plusieurs limites des approches très synthétiques combinant des jeux de données hétérogènes sur des étendues géographiques vastes (par exemple Desquilbet et al., 2020; Duchenne et al., 2022). Sans reprendre l’intégralité des arguments qui ont été émis, les principaux points associés à cette hétérogénéité sont les suivants :
-
- Une répartition très inégale des observations entre les pays du Nord et les pays du Sud, associée à une grande variabilité spatiale des tendances temporelles, qui rend difficile une extrapolation de tendances à l’échelle mondiale ;
-
- Une hétérogénéité de sensibilité des espèces aux transformations de leur environnement, et donc de leurs réponses aux changements actuels, liée par exemple à des différences de traits écologiques et de largeur de niche écologique*, qui rend difficile une extrapolation multitaxons (voir le Regard R80a). Comme l’ont souligné McKinney et Lockwood (1999), on s’attend à ce que les espèces plus vulnérables se raréfient face à ces changements, tandis que d’autres plus tolérantes doivent au moins temporairement en bénéficier, et augmenter leurs effectifs. De fait, les suivis de biodiversité menés depuis des décennies chez les vertébrés et d’autres taxons confirment la raréfaction des espèces spécialistes, plus vulnérables aux changements, au profit d’espèces généralistes, dans les habitats perturbés (ex. Devictor and Robert 2009, et voir les Regards R16, R80a et R92 par ex.). Au-delà d’un certain seuil de perturbation des habitats, bien sûr, les espèces généralistes déclinent à leur tour (Teyssedre and Robert, 2014): c’est probablement ce qui se passe aujourd’hui pour les insectes dans les régions d’agriculture intensive.
-
- La prise en compte, dans ces analyses synthétiques, de données issues d’approches expérimentales, où l’environnement a pu être manipulé avec des conséquences pour les abondances des insectes et leur tendance temporelle ;
-
- Une estimation presque systématique de tendances temporelles linéaires, alors que les dynamiques de populations d’insectes sont fortement non-linéaires, en particulier non-monotones*, soit pour des raisons biologiques comme des dynamiques cycliques, soit du fait d’une réponse rapide à des facteurs environnementaux changeants. Ces variations non-monotones impliquent que la tendance linéaire estimée dépend de la période de temps pour laquelle on a des données de suivi ( 2), pouvant passer d’une estimation d’un déclin à une estimation de croissance (Fig. 2 d et h par exemple). Or, la plupart des séries temporelles connues actuellement ont un début récent, après les années 1990, à un moment où la plupart des causes de variation de la biodiversité avaient probablement déjà eu un effet fort (Mihoub et al., 2017). Il est donc difficile d’utiliser ces séries temporelles récentes pour inférer des variations passées ;
-
- Du fait entre autres de leur début récent, ces séries temporelles ont une faible durée, souvent moins de 10 ans, qui va de pair avec une forte variabilité aléatoire dans les tendances temporelles estimées, qui peut se transformer en biais dans l’estimation des tendances moyennes quand les dynamiques de populations sont non-linéaires : il est possible d’estimer une augmentation là où il y a en fait un déclin, et vice-versa.
Ces hétérogénéités spatiales, temporelles et taxonomiques des jeux de données utilisés pour les synthèses semblent en bonne partie responsables des résultats contradictoires publiés récemment : en incluant dans l’analyse l’hétérogénéité des dates de début des suivis, des habitats et lieux géographiques, ainsi que l’hétérogénéité entre groupes taxonomiques, nous avons pu montrer que les tendances temporelles estimées dans quatre grandes synthèses récentes et apparemment contradictoires (Crossley et al., 2020; Dornelas et al., 2018; Outhwaite et al., 2020; van Klink et al., 2020) ne sont en fait pas significativement différentes les unes des autres (Duchenne et al., 2022).
Dans cette dynamique hétérogène, particulièrement entre espèces perdantes et –temporairement– gagnantes, qui conduit paradoxalement à une homogénéisation des communautés dans des habitats dégradés, un point important doit être gardé en tête pour l’interprétation des synthèses multi-taxons : le fait qu’en moyenne les populations d’insectes soient en déclin n’implique pas nécessairement que leur abondance totale ou que l’abondance moyenne des espèces diminuent, et inversement ! (cf. encadré, et voir les Regards R80a et R103).
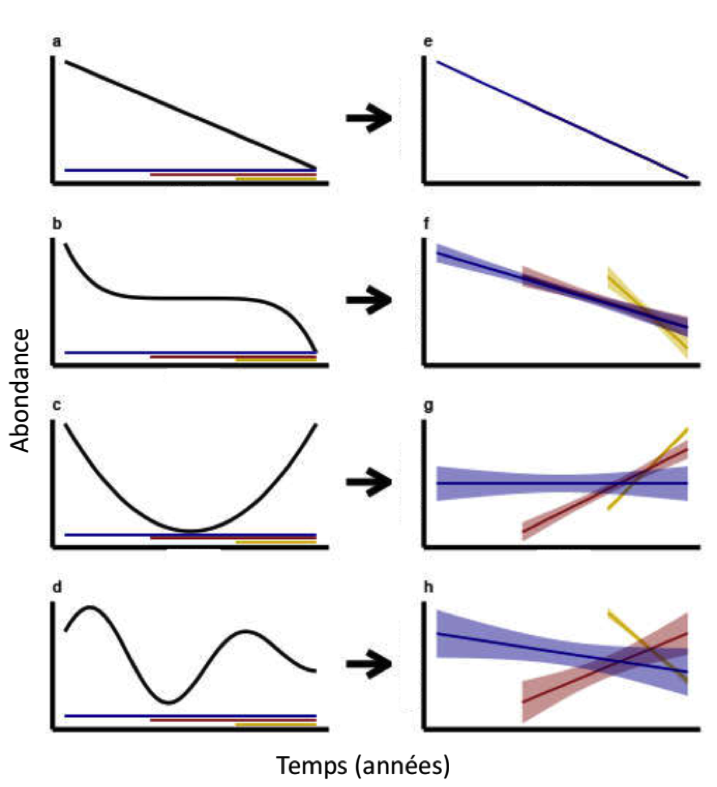
Figure 2 : Illustration de l’effet de la date de début des suivis de populations sur l’estimation de tendances temporelles linéaires quand les dynamiques de populations sont linéaires (a), non linéaires monotones* (b) ou non-monotones (c et d). La première colonne montre les variations réelles de l’abondance de populations, et la deuxième colonne l’estimation de tendances temporelles linéaires à partir de ces données, sur différents intervalles de temps plus ou moins longs (bleu, rouge, jaune) indiqués sur la colonne de droite. Pour une même population, les estimations peuvent passer de positives à négatives en fonction de la date de début du suivi. Source : Duchenne et al. (2022).
Encadré : une diminution moyenne de l’abondance des espèces n’implique pas celle de leur abondance totale
Le calcul des variations d’abondance multi-espèces pose la question du poids attribué à chaque espèce. Très souvent, les indicateurs choisis font en sorte de donner le même poids aux espèces quelles que soient leurs abondances absolues, en travaillant non pas sur l’abondance brute des espèces, en nombre d’individus, mais sur les variations de cette abondance (le taux de croissance). Des indicateurs comme l’Indice Planète Vivante ou l’indicateur Oiseaux du STOC (Suivi Temporel des Oiseaux Communs) sont fondés sur une moyenne (géométrique) des taux de croissance des populations incluses dans l’indicateur. Il résulte de ce choix que ces indicateurs ne peuvent pas être interprétés comme des variations de l’abondance totale des espèces.
Prenons un exemple concret avec une communauté de trois espèces, dont deux ont une abondance qui diminue fortement (taux de croissance annuel = 0.9, c’est-à-dire que la taille de population décroît de 10% chaque année) et une espèce a une abondance en légère augmentation (taux de croissance annuel = 1.01, l’abondance augmente de 1% chaque année). Le taux de croissance moyen est de 0.935, donc en moyenne les espèces déclinent. Peut-on conclure que l’abondance totale dans la communauté décline ? Pas forcément, tout dépend de l’abondance relative de chaque espèce. Si par exemple les deux espèces en déclin sont relativement rares, avec des populations de 10 et 100 individus, mais l’espèce qui augmente est très abondante (10000 individus), l’abondance totale est de 10110 individus. En un an ces trois espèces auront des tailles de population de 9, 90 et 10100, donc une abondance totale de 10199 individus, soit une croissance à un taux proche de 1.01 ! Ce sont les espèces les plus abondantes qui tirent les variations de l’abondance totale ou de l’abondance moyenne.
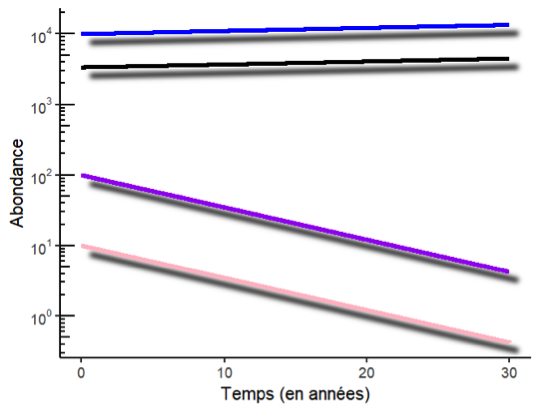
Fig.3 : Variations d’abondance au cours du temps de deux espèces relativement rares (10, rose et 100, violet, individus initialement) et d’une espèce plus abondante (10000 individus, bleu). Les courbes sont représentées sur une échelle log, ce qui permet de visualiser directement le taux de croissance comme la pente de la courbe : en valeur absolue, celui-ci est nettement plus important pour les espèces en diminution que pour l’espèce en augmentation, d’où un taux de croissance moyen inférieur à 1. Cependant, la dynamique de l’abondance moyenne (noir) est tirée surtout par l’espèce la plus abondante, et donc celle-ci augmente.
Conclusions
En résumé, si les déclins locaux ou récents sont bien établis (par exemple Billaud et al., 2021; Hallmann et al., 2017 pour les espaces agricoles), particulièrement pour le groupe des pollinisateurs (IPBES, 2016), des déclins plus répandus dans l’espace et plus anciens sont probables, mais difficiles, voire impossibles à démontrer de façon non-équivoque en l’état actuel des données d’observation et de suivi des insectes. Ce constat souligne au moins trois besoins importants pour mieux caractériser et comprendre les variations des populations et communautés de pollinisateurs.
D’une part, pour l’avenir, nous avons besoin de séries temporelles plus longues (Loreau et al., 2022; Mehrabi and Naidoo, 2022) : comme il n’est pas possible de remonter dans le temps, les suivis standardisés actuels doivent être pérennisés et d’autres suivis mis en place, particulièrement dans les régions du monde mal connues. Si les sciences participatives, par exemple en France les programmes des Suivis Temporels des Rhopalocères de France (STERF), l’Opération Papillons, le Protocole Papillons Gestionnaires (PROPAGE), l’observatoire des bourdons, le Suivi Photographiques des Insectes pollinisateurs (SPIPOLL), le Suivi des Orthoptères Nocturnes (SON), le Suivi Temporel des Libellules (STELI), ou l’Observatoire Agricole de la Biodiversité (OAB), peuvent contribuer à de tels suivis de long terme, le renouvellement habituellement important des participant.es ne facilite pas l’estimation des tendances temporelles à partir des données collectées (mais voir Couvet et al., 2008). Une implication forte et de long terme des établissements publics de recherche et d’expertise dans les suivis de biodiversité est un complément indispensable, mais actuellement très insuffisant pour le groupe des insectes. Pour les pollinisateurs, le Plan Pollinisateurs des Ministères de la Transition écologique et de l’Agriculture allume une lueur d’espoir, mais la pérennité des financements n’est pas acquise.
D’autre part, il est possible en quelque sorte de « remonter le temps » en mettant à profit les données opportunistes* (par exemple Outhwaite et al., 2020), qui s’accumulent depuis plusieurs décennies, voire plusieurs siècles dans quelques rares cas. Cependant, par définition ces données ont été récoltées sans plan ni protocole d’échantillonnage communs, et sont donc assorties de nombreux biais (géographique, taxonomique, environnemental, temporel), biais qu’il convient d’identifier et de prendre en compte pour inférer des tendances temporelles à partir de ces données opportunistes*. De plus en plus d’outils sont disponibles pour ce type d’analyses (voir Boyd et al., 2022), mais leur efficacité dans la correction des biais reste à confirmer.
Un autre obstacle à l’exploitation de ces données opportunistes*, qui s’applique également aux données de suivi, est la limitation de leur accès pour la communauté de la recherche. A l’heure actuelle en effet, seul un faible pourcentage des données de biodiversité collectées est disponible (Mandeville et al., 2021). C’est pourquoi des initiatives de mise à disposition, telles que le Pôle National des Données de Biodiversité (PNDB), ou la numérisation des collections naturalistes, sont indispensables. Leur succès dépend cependant du bon vouloir des propriétaires des données, parfois réticent.es à partager une ressource pour laquelle iels ont investi un temps important.
Enfin, les données actuelles montrent une grande hétérogénéité spatio-temporelle dans les tendances observées, dont les mécanismes sous-jacents sont encore mal identifiés dans le cas général, alors que cette identification est indispensable pour la conservation des insectes. Désagréger les nombreuses tendances temporelles existantes pour des analyses plus locales pourra aider à une meilleure compréhension des causes des variations, mais là encore la disponibilité des données entre en jeu.
Hallmann et al. (2017) ont par exemple observé un déclin majeur de la biomasse des insectes dans des espaces protégés au cœur de zones agricoles en Allemagne, mais n’ont pas pu relier ces variations d’abondance à des pratiques agricoles, faute de données disponibles. A l’inverse, une analyse des données de l’Observatoire Agricole de la Biodiversité, dans lequel les agriculteurs récoltent des données à la fois sur la biodiversité de leur parcelles et sur leurs pratiques, permet de mettre en relation les variations temporelles d’abeilles sauvages et de papillons avec l’intensité des pratiques, particulièrement l’utilisation de fertilisation minérale et de pesticides de synthèse (Billaud et al., 2021). Une meilleure ouverture des données dans tous les domaines est donc indispensable pour améliorer tant la description des changements de biodiversité que l’identification des causes, et donc pouvoir espérer une conservation plus efficace.
Glossaire
Communauté écologique ou biotique : Ensemble de populations d’espèces différentes, partageant certaines caractéristiques écologiques (souvent : espèces de même niveau trophique), occupant un même site ou une même région géographique.
Données opportunistes : données collectées sans suivre un protocole prédéfini. Cela implique notamment qu’on ne connaît pas l’effort d’observation, ce qui ne permet pas une comparaison simple entre observations. En effet, une donnée (par exemple 10 individus d’une espèce) n’a pas la même signification si l’observateur a passé 1 minute ou 1 heure à observer. Les données opportunistes sont définies par opposition aux données « structurées » récoltées selon un protocole qui permet de connaître l’effort d’observation associé.
Ecosystème : ensemble des êtres vivants, de leur environnement physicochimique et de leurs interactions (notamment échanges de matière et d’énergie) dans un même site.
Non-monotone : se dit d’une fonction mathématique qui change au moins une fois de sens de variation sur un intervalle donné, par exemple croissante puis décroissante. Par opposition, une dynamique de population monotone est donc soit toujours croissante, soit toujours décroissante.
Remerciements
Cet article est principalement inspiré d’un travail d’équipe mené par François Duchenne (2022). Il a aussi énormément bénéficié de discussions avec Robin Boyd, Colin Fontaine, Gabrielle Martin et Oliver Pescott, que je tiens à remercier ici. Merci aussi à Anne Teyssèdre pour ses relectures et sa contribution à ce Regard. Enfin, je remercie tou.te.s les participant.es aux programmes Vigie-nature, sans qui les changements de biodiversité en cours en France seraient très mal connus.
Bibliographie
Ball L., Still R., Riggs A., et al., 2022. The Bugs Matter Citizen Science Survey: counting insect ‘splats’ on vehicle number plates reveals a 58.5% reduction in the abundance of actively flying insects in the UK between 2004 and 2021. https://doi.org/10.13140/RG.2.2.29866.49606
Biesmeijer J.C., Roberts S.P.M., Reemer M. et al., 2006. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science 313, 351–354. https://doi.org/10.1126/science.1127863
Billaud O., Vermeersch R.-L. & Porcher E., 2021. Citizen science involving farmers as a means to document temporal trends in farmland biodiversity and relate them to agricultural practices. J. Appl. Ecol. 58, 261–273. https://doi.org/10.1111/1365-2664.13746
Boyd R.J., Powney G.D., Burns F. et al., 2022. ROBITT: A tool for assessing the risk-of-bias in studies of temporal trends in ecology. Methods Ecol. Evol. 13, 1497–1507. https://doi.org/10.1111/2041-210X.13857
Cardoso P. & Leather S.R., 2019. Predicting a global insect apocalypse. Insect Conserv. Divers. 12, 263–267. https://doi.org/10.1111/icad.12367
Ceballos G., Ehrlich P.R., Barnosky A.D. et al., 2015. Accelerated modern human-induced species losses: Entering the sixth mass extinction. Sci. Adv. 1, e1400253. https://doi.org/10.1126/sciadv.1400253
Ceballos G., Ehrlich P.R. & Dirzo R., 2017. Biological annihilation via the ongoing sixth mass extinction signaled by vertebrate population losses and declines. Proc. Natl. Acad. Sci. U. S. A. 114, E6089–E6096. https://doi.org/10.1073/pnas.1704949114
Crossley M.S., Meier A.R., Baldwin E.M. et al., 2020. No net insect abundance and diversity declines across US Long Term Ecological Research sites. Nat. Ecol. Evol. 4, 1368-+. https://doi.org/10.1038/s41559-020-1269-4
Desquilbet M., Gaume L., Grippa M. et al., 2020. Comment on “Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances.” Science 370. https://doi.org/10.1126/science.abd8947
Devictor V. & Robert A., 2009. Measuring community responses to large-scale disturbance in conservation biogeography. Divers. Distrib. 15, 122–130. https://doi.org/10.1111/j.1472-4642.2008.00510.x
Dicks L.V., Breeze T.D., Ngo H.T. et al., 2021. A global-scale expert assessment of drivers and risks associated with pollinator decline. Nat. Ecol. Evol. 5, 1453-+. https://doi.org/10.1038/s41559-021-01534-9
Dornelas M., Antao L.H., Moyes F. et al., 2018. BioTIME: A database of biodiversity time series for the Anthropocene. Glob. Ecol. Biogeogr. 27, 760–786. https://doi.org/10.1111/geb.12729
Dornelas M. & Daskalova G.N., 2020. Nuanced changes in insect abundance. Science 368, 368–369. https://doi.org/10.1126/science.abb6861
Duchenne F., Porcher E., Mihoub J.-B. et al., 2022. Controversy over the decline of arthropods: a matter of temporal baseline? Peer Community J. 2, e33. https://doi.org/10.24072/pcjournal.131
Hallmann C.A., Sorg, M., Jongejans E. et al., 2017. More than 75 percent decline over 27 years in total flying insect biomass in protected areas. Plos One 12, e0185809. https://doi.org/10.1371/journal.pone.0185809
IPBES, 2016. The assessment report of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services on pollinators, pollination and food production. Secretariat of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services, Bonn, Germany.
Isaac N.J.B., van Strien A.J., August T.A. et al., 2014. Statistics for citizen science: extracting signals of change from noisy ecological data. Methods Ecol. Evol. 5, 1052–1060. https://doi.org/10.1111/2041-210X.12254
Leather S.R., 2018. “Ecological Armageddon” – more evidence for the drastic decline in insect numbers. Ann. Appl. Biol. 172, 1–3. https://doi.org/10.1111/aab.12410
Leung B., Hargreaves A.L., Greenberg D.A. et al., 2020. Clustered versus catastrophic global vertebrate declines. Nature 588. https://doi.org/10.1038/s41586-020-2920-6
Loreau M., Cardinale B.J., Isbell F. et al., 2022. Do not downplay biodiversity loss. Nature 601, E27–E28. https://doi.org/10.1038/s41586-021-04179-7
Mandeville C.P., Koch W., Nilsen E.B. & Finstad A.G., 2021. Open Data Practices among Users of Primary Biodiversity Data. BioScience 71, 1128–1147. https://doi.org/10.1093/biosci/biab072
McDermott A., 2021. To understand the plight of insects, entomologists look to the past. Proc. Natl. Acad. Sci. U. S. A. 118, e2018499117. https://doi.org/10.1073/pnas.2018499117
McKinney M.L. & Lockwood J.L., 1999. Biotic homogenization: a few winners replacing many losers in the next mass extinction. Trends Ecol. Evol. 14, 450–453.
Mehrabi Z. & Naidoo R., 2022. Shifting baselines and biodiversity success stories. Nature 601, E17–E18. https://doi.org/10.1038/s41586-021-03750-6
Mihoub J.-B., Henle K., Titeux N. et al., 2017. Setting temporal baselines for biodiversity: the limits of available monitoring data for capturing the full impact of anthropogenic pressures. Sci. Rep. 7, 41591. https://doi.org/10.1038/srep41591
Outhwaite C.L., Gregory R.D., Chandler R.E. et al., 2020. Complex long-term biodiversity change among invertebrates, bryophytes and lichens. Nat. Ecol. Evol. 4, 384-+. https://doi.org/10.1038/s41559-020-1111-z
Outhwaite C.L., McCann P., Newbold T., 2022. Agriculture and climate change are reshaping insect biodiversity worldwide. Nature 605, 97–102. https://doi.org/10.1038/s41586-022-04644-x
Pilotto F., Kuehn I., Adrian R., et al., 2020. Meta-analysis of multidecadal biodiversity trends in Europe. Nat. Commun. 11, 3486. https://doi.org/10.1038/s41467-020-17171-y
Powney G.D., Carvell C., Edwards M., Morris R.K.A. et al., 2019. Widespread losses of pollinating insects in Britain. Nat. Commun. 10, 1018. https://doi.org/10.1038/s41467-019-08974-9
Rhodes C.J., 2018. Pollinator decline – an ecological calamity in the making? Sci. Prog. 101, 121–160. https://doi.org/10.3184/003685018X15202512854527
Seibold S., Gossner M.M., Simons N.K. et al., 2019. Arthropod decline in grasslands and forests is associated with landscape-level drivers. Nature 574, 671-+. https://doi.org/10.1038/s41586-019-1684-3
Teyssèdre A. & Robert A., 2014. Contrasting effects of habitat reduction, conversion and alteration on neutral and non neutral biological communities. Oikos 123, 857–865. https://doi.org/10.1111/j.1600-0706.2013.00928.x
van Klink R., Bowler D.E., Gongalsky K.B. et al., 2020. Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science 368, 417-+. https://doi.org/10.1126/science.aax9931
van Strien A.J., Termaat T., Kalkman V. et al., 2013. Occupancy modelling as a new approach to assess supranational trends using opportunistic data: a pilot study for the damselfly Calopteryx splendens. Biodivers. Conserv. 22, 673–686. https://doi.org/10.1007/s10531-013-0436-1
Regards connexes :
Couvet D. et A. Teyssèdre, 2011. Biodiversité et sciences participatives. Regards et débats sur la biodiversité, SFE2, Regard R11, février 2011.
Desprès L, 2019.Le paradoxe des zones humides d’Europe. Regards et débats sur la biodiversité, SFE2, Regard R92, sept. 2020.
Fontaine R. et al. Impact de l’urbanisation et des pratiques de jardinage sur les communautés de papillons. Regards et débats sur la biodiversité, SFE2, Regard R69, janvier 2017.
Gouyon P-H., 2020. Regard sur le livre de S. Foucard: « Et le monde devint silencieux ». Regards et débats sur la biodiversité, SFE2, Regard RO14, juillet 2020.
Teyssèdre A., 2018 : Réponses des espèces et communautés écologiques aux changements globaux. Regards et débats sur la biodiversité, SFE2, Regard R80a, juin 2018.
Teyssèdre A., 2022 : Impacts de l’agriculture sur la biodiversité et le fonctionnement des écosystèmes. Regards et débats sur la biodiversité, SFE2, Regard R103, mai 2022.
Et ces Regards consultables par thématique :
- Regards sur les changements globaux : https://www.sfecologie.org/tag/changements-globaux/
- Regards sur les méthodes et outils : https://sfecologie.org/tag/methodes-et-outils/
- Regards sur l’érosion de la biodiversité : https://sfecologie.org/tag/erosion-extinctions/
- Sur les facteurs d’impact (sur la biodiversité) : https://www.sfecologie.org/tag/facteurs-dimpact/
- Regards sur l’agriculture : https://www.sfecologie.org/tag/agriculture
- Regards sur les habitats : https://sfecologie.org/tag/habitats/
—–
Regard R109, édité par Anne Teyssèdre.
——-


Commentaires récents