La Société Française d’Ecologie (SFE) vous propose les regards de Benjamin Roche et Anne Teyssèdre sur la relation entre biodiversité et maladies infectieuses.
MERCI DE PARTICIPER en postant vos commentaires et questions après cet article. Les auteurs vous répondront et une synthèse des contributions sera ensuite ajoutée à la suite de chaque article.
———
La biodiversité nous protège-t-elle
contre les maladies infectieuses ?
Benjamin Roche(1) et Anne Teyssèdre(2)
(1) : Unité de Modélisation Mathématique et Informatique des Systèmes Complexes, Paris
(2) : Ecologue et médiatrice scientifique en écologie, évolution et sciences de la conservation (http://anne.teyssedre.free.fr)
( Fichier PDF )
Regard R18, édité par Nicolas Mouquet
Mots clés : épidémiologie, écologie, biodiversité, communautés, santé, maladies infectieuses, zoonoses, hôtes-pathogènes, interactions, vecteurs, évolution, dynamique, relation Homme-Nature, changements globaux, enjeux.
———
L’émergence des maladies infectieuses
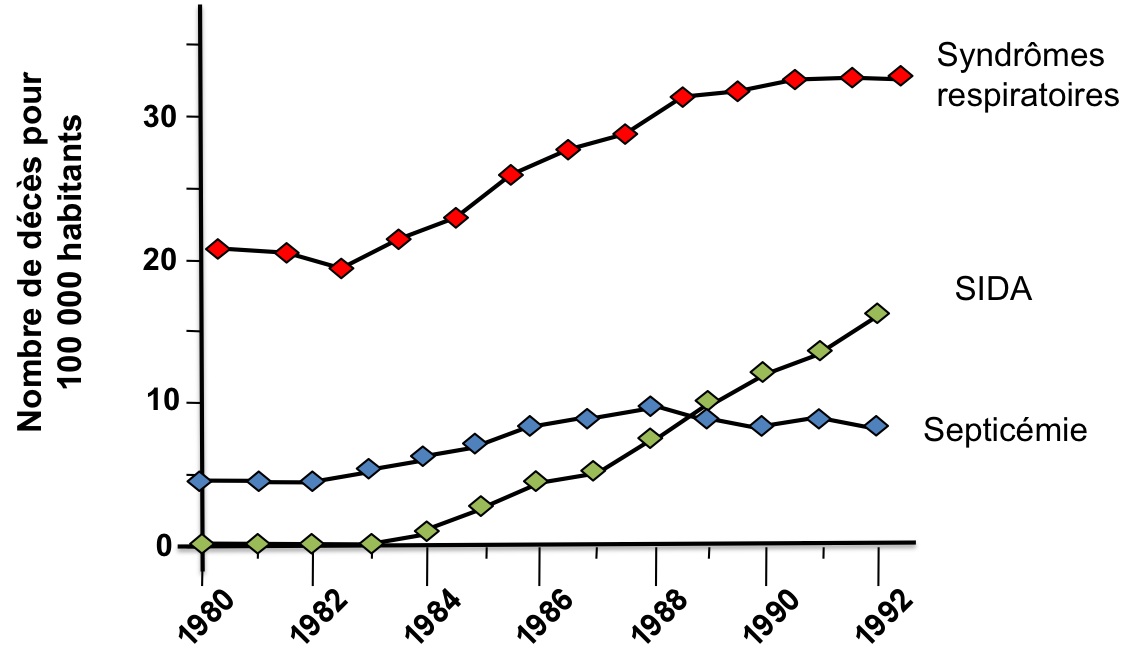
Figure 1 : Evolution de la mortalité due aux maladies infects aux Etats-Unis depuis 1980.
D’après Pinner et al., 1996.
Depuis l’identification du SIDA dans les années 1980, l’humanité est entrée dans ce que l’on appelle aujourd’hui une nouvelle ère « d’émergence des maladies infectieuses » (Jones et al., 2008). Ces maladies sont causées par l’infection des individus par des agents pathogènes, tels que les virus ou les bactéries par exemple. Si la prévalence et l’impact de ces maladies transmissibles sur nos sociétés avaient fortement diminué dans la période de l’après-guerre, grâce notamment à l’introduction massive de la vaccination et des antibiotiques, cette tendance est actuellement en train de s’inverser. On observe en effet une augmentation de la mortalité due aux maladies infectieuses depuis le début des années 1980 dans la plupart des pays développés, comme par exemple aux Etats-Unis (figure 1).
Expansion de l’agriculture et maladies infectieuses
L’invention de l’agriculture il y a quelque 11.000 ans, puis son expansion au fil des millénaires, ont vraisemblablement permis l’émergence et l’évolution de bon nombre de graves pathologies infectieuses humaines sévissant en Eurasie aux temps historiques, telles que la variole, la rougeole, la diphtérie, la grippe et la tuberculose (Dobson et Carper, 1996 ; Wolfe et al., 2007). Deux mécanismes majeurs ont été identifiés.
L’un d’eux est la domestication de diverses espèces de mammifères et d’oiseaux, des vertébrés à sang chaud relativement proches de l’Homme au plan systématique (surtout pour les premiers), et donc au plan biologique. Comme tous les animaux, ces espèces étaient avant même leur domestication parasitées par un cortège d’agents infectieux – virus, bactéries, protistes..-, avec lesquels elles « coévoluaient » au fil des générations, à l’écart des humains. En augmentant soudain la fréquence des contacts entre ces espèces et la nôtre, la domestication a considérablement favorisé la transmission et l’adaptation d’agents infectieux d’origine animale aux humains.
Cette hypothèse est étayée par le fait que les agents infectieux de maladies humaines mortelles en Europe aux temps historiques, telles que la variole, la tuberculose, la diphtérie, la syphilis, la varicelle ou encore la lèpre, sont très semblables – donc apparentés – à ceux de mammifères domestiques, bœufs, chèvres, moutons et porcs principalement.

Cliché © Anne Teyssèdre
C’est le cas par exemple de la rougeole, une maladie infectieuse affectant aujourd’hui principalement les enfants en bas âge. Ce virus appartient en effet au même genre phylogénétique que celui de la peste bovine, les Morbillivirus, duquel il aurait divergé il y a environ 10.000 ans.
L’expansion de l’agriculture a probablement favorisé le maintien de ces maladies infectieuses d’origine animale dans les populations humaines par un autre mécanisme : en permettant l’augmentation de la densité et de l’effectif total de ces populations, qui ont atteint quelques centaines de millions d’individus en quelques millénaires. La densité plus élevée des populations agricoles a favorisé la transmission des agents infectieux en augmentant la fréquence des contacts entre individus. L’augmentation considérable de l’effectif total des populations agricoles, connectées entre elles dans une vaste « métapopulation », a quant à elle vraisemblablement permis le maintien et le bourgeonnement épisodique de ces maladies, dans des populations locales fragilisées par la guerre, la faim ou les rigueurs du climat (Wolfe et al. 2007).
Quelques milliers d’années après l’avènement de l’agriculture, un autre épisode d’émergence de maladies infectieuses est survenu avec l’urbanisation. La construction de villes de plus en plus importantes a notamment permis la prolifération de plusieurs espèces de rongeurs commensales de l’Homme depuis l’agriculture, rats noirs et souris domestiques, permettant la propagation et l’adaptation à l’homme de leurs pathogènes. C’est le cas classique de la peste bubonique, transmise entre plusieurs espèces de rongeurs par des puces et qui peuvent par la suite propager cette bactérie dans les populations humaines. Il a été supposé que plusieurs épidémies de grande ampleur ont frappé Rome au début de notre ère, mais l’épidémie la plus célèbre, dite de la « peste noire », a sévi au cours du XIVème siècle en Europe et a décimé près d’un tiers de la population de ce sous-continent.
La charge importante des grandes populations européennes en agents infectieux d’origine animale, potentiellement très virulents pour les humains non immunisés, a vraisemblablement équipé les conquistadors d’une arme insidieuse et efficace face aux populations amérindiennes relativement peu nombreuses et denses qui tentaient de leur résister. De même que celle des polynésiens, l’hécatombe des amérindiens au XVIe siècle semble davantage due aux maladies infectieuses importées par leurs agresseurs qu’aux combats (Crosby, 1986 ; Dobson et Carper, 1996 ; Diamond, 1997).
Chaque espèce animale a une capacité différente à transmettre les maladies
Si l’agriculture et l’urbanisation ont favorisé l’adaptation de pathogènes à l’Homme, de nombreuses autres maladies infectieuses dites « zoonotiques » circulent principalement entre plusieurs espèces animales généralement sauvages, auxquelles l’être humain vient accessoirement s’ajouter. La contamination d’humains par ces zoonoses étant le plus souvent un « accident » de transmission, sans suite épidémiologique, notre espèce constitue une impasse ou un « cul de sac » épidémiologique pour ces pathologies. En d’autres termes, notre espèce est peu « compétente » pour héberger et transmettre les pathogènes en question. (On parle aussi d’hôte « tangentiel ».)
Ces termes sont employés pour signifier que les humains mis en contact avec le pathogène (virus, bactérie, protiste..) y sont généralement peu sensibles et ne développent que rarement une infection. De ce fait, leur concentration sanguine du pathogène est généralement très faible, et ils sont donc rarement capables de transmettre à leur tour ces maladies animales.
C’est le cas par exemple de la fièvre du Nil Occidental, due au virus éponyme, une maladie majoritairement transmise entre de nombreuses espèces d’oiseaux « compétentes » pour ce virus (espèces réservoirs) et de moustiques (vecteurs de la maladie). Tout comme les autres mammifères, les humains sont de piètres hôtes pour ce virus. Dans la région d’Afrique de l’Est où sévit cette maladie, la plupart des humains y sont résistants et ont une très faible concentration du virus dans le sang (virémie). Moins d’1% des personnes porteuses du virus développent la maladie, associée à une virémie élevée nécessaire à la transmission du virus aux vecteurs potentiels. En d’autres termes, la probabilité de d’infection (pathologique) d’un humain par un moustique porteur du virus, et réciproquement celle d’un moustique par un humain, sont très faibles.
En 2007, Nathan Wolfe et ses collaborateurs ont observé que les graves maladies infectieuses humaines originaires des régions tempérées sont majoritairement issues d’animaux domestiques (voir les exemples ci-dessus), tandis que les maladies d’origine tropicale (ex : dengue, malaria, fièvre jaune, SIDA…) proviennent de ou sont partagées par des espèces sauvages. Les auteurs expliquent ce pattern i) par la prévalence de l’agriculture et de la domestication aux latitudes tempérées, et ii) par la diversité accrue des mammifères, dont celle de nos proches cousins primates (singes et apparentés), aux basses latitudes (Wolfe et al. 2007).
Petit glossaire des relations hôtes-pathogènes :
- Pathogène, ou parasite : Organisme qui vit et se reproduit aux dépens d’une ou plusieurs autres espèces, ses « hôtes », en affectant les fonctions physiologiques et donc la santé des individus parasités. Les parasites peuvent être des microorganismes (virus, bactéries, protistes, champignons), des végétaux (gui..) ou des animaux (douve du foie, ténia, puce..).
- Espèce hôte : espèce susceptible d’héberger et faire fructifier à ses dépens un certain pathogène.
- Compétence d’un hôte : Capacité d’un hôte à infecter un autre hôte n’ayant jamais été en contact direct avec le pathogène.
- Hôte tangentiel, ou espèce « cul de sac » pour un pathogène : espèce susceptible d’héberger transitoirement un certain pathogène, mais pas (ou peu) de le transmettre à un autre organisme.
- Espèce vecteur d’une maladie : Espèce hôte, généralement un insecte, susceptible de se nourrir du sang d’un animal infecté (hôte primaire) et de transmettre par piqûre l’agent infectieux à un autre animal, ou à un humain.
- Espèce réservoir : Espèce hôte, généralement vertébré dans le cas des maladies zoonotiques, pouvant héberger un certain pathogène et infecter par la suite un vecteur.
- Maladie infectieuse : maladie due à la prolifération chez l’espèce hôte d’un microogranisme pathogène, dit agent infectieux.
- Maladie zoonotique, ou zoonose : Maladie infectieuse ou parasitaire affectant principalement des animaux mais également transmissible à l’Homme. Ex : grippe aviaire, rage, brucellose..
La biodiversité freine la transmission des maladies
Si les humains sont généralement peu compétents pour transmettre les maladies animales, la réciproque est également vraie. En effet, certaines espèces animales peuvent à leur tour être des « culs de sac » pour des maladies mieux adaptées à l’espèce humaine. Si, dans une communauté de mammifères ou d’oiseaux, l’abondance des espèces « culs de sac » (peu compétentes pour transmettre les maladies humaines) augmente avec le nombre total d’individus, tandis que celui des hôtes « compétents » diminue, alors la diversité des espèces hôtes (en moyenne peu compétentes) peut réduire voire bloquer la transmission de ces maladies par effet de dilution.
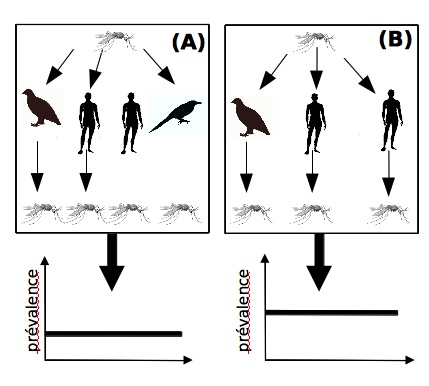
Figure 2 : Mécanisme de l’effet de dilution. (A) Lorsqu’un moustique peut se nourrir sur une espèce incapable de transmettre la maladie, un certain nombre de ses piqûres sont « perdues » pour la transmission de l’infection. (B) Si cette espèce dite non compétente est absente, les piqûres précédemment perdues seront détournées sur des espèces capables de transmettre la maladie, augmentant en conséquence la proportion de moustiques infectés et donc le nombre de cas humains. (Source: Roche et Guéguan, 2011.)
L’exemple des maladies humaines à transmission vectorielle illustre très bien cet effet. Ces pathologies ont la particularité d’être transmises par des piqûres d’animaux vecteurs, généralement des insectes comme les moustiques ou d’autres arthropodes comme les tiques et araignées, à d’autres espèces de vertébrés « compétents » pour ces pathologies, généralement des mammifères ou des oiseaux. Au cours de ces piqûres, les vecteurs se nourrissent du sang prélevé et peuvent par ce biais infecter l’individu piqué ou au contraire s’infecter eux-mêmes si l’individu attaqué est malade. Ce mode de transmission est très largement répandu dans la nature. Citons le paludisme (ou malaria) transmis par les moustiques Anopheles, la maladie de Lyme transmise par les tiques Ixodes et infectant de nombreux autres mammifères, ou encore la dengue transmise par les moustiques du genre Aedes.
Imaginons une maladie qui peut se transmettre par une espèce de moustique pouvant se nourrir sur l’homme ainsi que sur deux autres espèces animales dont l’une est « compétente » pour la transmission de l’agent infection et l’autre un « cul de sac épidémiologique». Dans un tel cas, une partie des piqûres du moustique seront effectuées sur cette espèce qui ne peut pas transmettre la maladie. Un certain nombre de piqûres sera donc « perdu » pour la maladie et les vecteurs seront, en moyenne, faiblement infectés. En conséquence, le nombre de cas humains demeurera bas (figure 2A).
Imaginons maintenant que cette espèce « cul de sac » disparaisse. Si le moustique se nourrit toujours le même nombre de fois au cours de sa vie, les piqûres précédemment perdues pour la maladie infectieuse seront détournées sur des espèces « compétentes », capables de transmettre l’infection. Ceci aura pour conséquence d’augmenter la proportion de vecteurs infectés et donc potentiellement le nombre de cas humains (figure 2B). En d’autres termes, la perte d’une espèce « cul de sac » peut entraîner une augmentation du nombre de cas humains.
Des exemples récents et anciens, à plusieurs échelles géographiques…
Cet effet a été montré de nombreuses fois ces dernières années. La démonstration la plus flagrante concerne la maladie de Lyme qui est en pleine recrudescence en Amérique du Nord. Transmise par une espèce de tique à plusieurs espèces de petits mammifères et à l’Homme, cette maladie est responsable de 20000 cas (humains) aux Etats-Unis chaque année. Il a ainsi été démontré que les Etats américains possédant la plus forte diversité en petits mammifères sont ceux où la prévalence de la maladie de Lyme est la plus faible (figure 3).
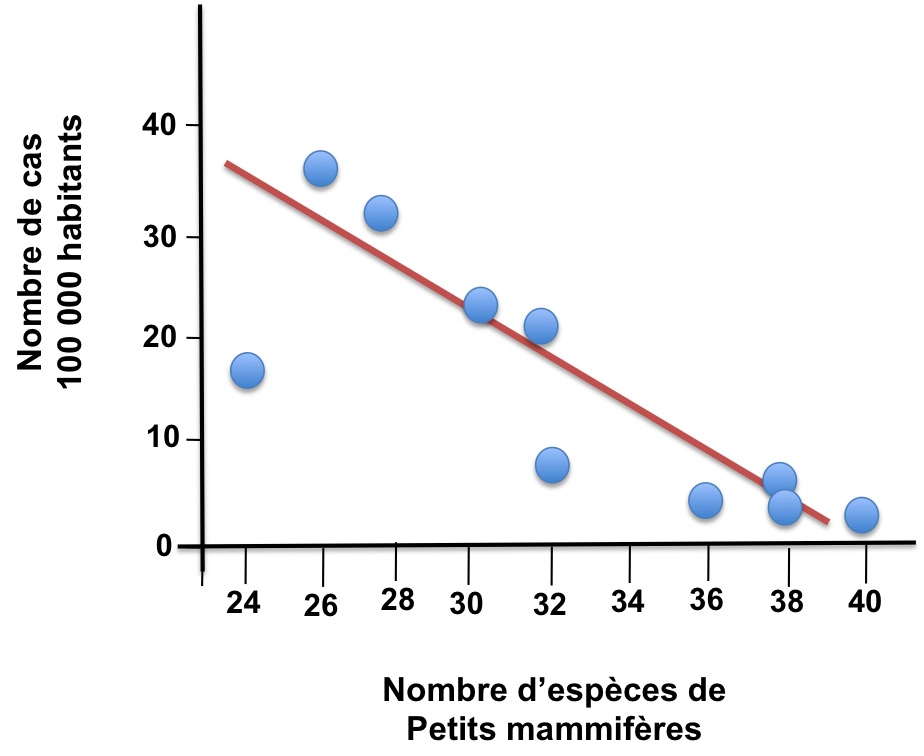
Figure 3 : Evidence pour un effet de dilution dans le cas de la maladie de Lyme, aux Etats-Unis. Chaque point représente un Etat différent. D’après Ostfeld et Keesing, 2000.
Un effet similaire a été démontré dans le cas de la fièvre du Nil Occidental évoquée plus haut. Transmis par plusieurs espèces de moustiques à de nombreuses espèces d’oiseaux et plus rarement aux humains, en Afrique de l’Est, jusqu’à la fin du siècle dernier, le virus de cette maladie a été introduit en 1999 dans l’état de New York avant de diffuser dans toute l’Amérique du Nord. Cette pathologie cause aujourd’hui pratiquement 600 décès par an aux Etats-Unis. Une étude récente a montré qu’à l’intérieur de l’état de la Louisiane, les « comtés » de cet état possédant la plus forte diversité en oiseaux étaient également ceux où les cas humains de fièvre du Nil Occidental étaient les moins fréquents. Ces deux exemples, à des échelles spatiales très différentes, montrent la généralité de cet effet de dilution.
La découverte de cet effet a également été analysé a posteriori sur des maladies éliminées dans plusieurs régions du monde. Cela a été le cas pour le paludisme, éliminé de la plupart des pays développés. Transmise également par plusieurs espèces de moustiques, les anophèles, cette maladie infectieuse due au protiste Plasmodium falciparum fait toujours près de un million de morts chaque année, principalement en Afrique sub-saharienne. Il a été suggéré que l’éradication du paludisme dans le Sud de l’Europe a été rendue possible par la conjonction d’une désinsectisation de masse et de l’introduction de bétail qui a créé, involontairement, un effet de dilution – les bovidés étant des hôtes « culs de sac », résistants aux Plasmodium sp. Les entomologistes ont qualifié de « zooprophylaxie » cette diminution de la transmission.
Des critiques émanant de toutes parts
Comme souvent lorsque l’on s’intéresse à l’impact des activités humaines sur la santé des écosystèmes, et a fortiori lorsque l’on suggère que ces activités humaines ont un effet néfaste sur notre santé, de nombreuses critiques ont été émises sur l’hypothèse du rôle protecteur de la biodiversité contre les maladies infectieuses zoonotiques. La plus sérieuse contraste la complexité de la biodiversité et la simplicité – naïveté diront certains – exprimée dans l’effet de dilution.
En effet, lorsqu’une espèce est introduite dans un écosystème au sein duquel une maladie infectieuse est transmise, les conséquences de cette addition sont difficilement prévisibles. Cette espèce peut en effet perturber les autres espèces présentes, par exemple en prélevant des ressources qui deviendront moins abondantes pour les autres espèces et ainsi de suite. Il paraît donc possible que l’introduction d’une espèce animale « cul de sac » augmente le nombre d’individus hôtes « compétents » et, donc la transmission globale du pathogène.
Il convenait donc d’établir une « épidémiologie des communautés », dans le sens où les interactions entre les espèces animales, extrêmement nombreuses et complexes, seraient prises en considération. Ce champ, tout nouveau aujourd’hui, tend à montrer que même lorsque la complexité des interactions entre les espèces animales sont prises en compte, la biodiversité tend, en moyenne, à diminuer la transmission des maladies infectieuses (Roche et Guégan, 2011).
Néanmoins, il ne faut pas sous-estimer les situations où la biodiversité peut amplifier la transmission d’agents pathogènes. Ainsi, introduire artificiellement des espèces « cul de sac » non compétentes dans un écosystème avec pour objectif de diminuer la transmission d’une maladie pourrait se révéler très dangereux. Les quelques cas où cette possibilité pourrait être envisagée seraient la réintroduction d’espèces dans des écosystèmes d’où elles avaient précédemment disparues, sous condition que ces écosystèmes n’aient pas été trop altérés. Clairement, la meilleure stratégie est donc de préserver cette biodiversité dans le but de maintenir la maladie infectieuse à un faible niveau de transmission.
D’importantes conséquences en santé publique !
Comme nous avons pu le voir, l’épidémiologie des maladies infectieuses ne concerne pas que le monde médical. Le rapprochement entre un nombre restreint d’espèces animales et les populations humaines, comme illustré dans le cas de l’agriculture, peut faciliter la transmission et l’adaptation de pathogènes de vertébrés à l’Homme. Un appauvrissement de la biodiversité peut également favoriser une augmentation de la transmission de ces maladies animales à l’Homme, comme illustré ici dans le cas des maladies vectorielles.
L’exemple de la grippe aviaire permet de bien résumer tous les effets d’un appauvrissement de la biodiversité. Il est en effet suspecté que l’intensification des élevages de volailles, notamment en Asie du Sud-Est, a permis l’apparition de la grippe aviaire dite « H5N1 ». Cette nouvelle souche, très virulente et contagieuse pour les oiseaux de basse-cour élevés en grandes densités, a nécessité l’abattage de nombreux élevages. Les éleveurs de volailles, en contact rapproché avec ces oiseaux malades, ont également payé un lourd tribut à cette épidémie. Aujourd’hui, près de 300 cas humains ont été déclarés, dont environ la moitié se sont révélés mortels.
Heureusement, notre espèce est peu compétente pour cette forme H5N1 du virus. En d’autres termes, les cas humains constatés sont des « culs de sacs » épidémiologiques, et il n’y a pas de transmission directe du virus entre humains. Néanmoins, des phénomènes d’adaptation rapide à l’Homme d’autres souches animales du virus de la grippe ont eu lieu au cours du XXème siècle, provoquant au moins trois grandes épidémies mondiales – dont la fameuse « grippe espagnole » qui a fait plusieurs millions de morts en Europe au lendemain de la première guerre mondiale.
Aedes Albopictus © CDC James Gathany
Aujourd’hui, l’érosion de la diversité biologique continue de s’accélérer par un nombre considérable de processus humains (cf. regards 1 et 4 par ex.), que ce soit la pollution, la déforestation ou encore l’élevage intensif pour n’en citer que quelques uns. D’autres grands changements globaux, tels que la mondialisation des échanges, l’anthropisation des habitats ou le réchauffement climatique modifient la distribution géographique de vecteurs potentiels et/ou d’espèces hôtes compétentes, favorisant l’expansion de maladies zoonotiques dans de nouvelles provinces biogéographiques.
Citons la rencontre récente du moustique « tigre » Aedes albopictus – originaire d’Asie du Sud-Est – et du virus Chikungunya sur l’Ile de la Réunion, catastrophique pour les réunionnais en 2005 et 2006, puis l’expansion actuelle de ce moustique vecteur du chikungunya et de la dengue en Europe (Delatte et al. 2008).
L’engouement pour les nouveaux « animauxde compagnie » (NAC) tels que furets, cabiais, saïmiris.., quant à lui, en augmentant la fréquence des contacts directs entre mammifères sauvages et humains, augmente les risques de transmission et adaptation de maladies animales à notre espèce.
Comprendre comment ces changements globaux altèrent la biodiversité, en relation avec les humains, est un objectif non seulement des sciences de la conservation mais aussi de santé publique. C’est ce défi que l’écologie et l’évolution des maladies infectieuses doit aujourd’hui relever.
—–
Bibliographie :
Crosby A.W., 1986. Ecological imperialism : the Biological Expansion of Europe 900-1900. Cambridge University Press, Cambridge, UK.
Delatte H. et al., 2008. Aedes albopictus, vector of Chikungunya and Dengue in La Réunion: Biology and control. Parasite 15(1) : 3-13.
Dobson A.P. & E.R. Carper, 1996. Infection deseases and human population history. Bioscience 46 : 115-126.
Jones K.E. et al., 2008. Global trends in emerging infectious deseases. Nature 451 : 990-994.
Keesing F et al., 2010. Impacts of biodiversity on the emergence and transmission of infectious diseases. Nature 468 : 647-651.
Lloyd-Smith J.O. et al., 2009. Epidemic Dynamics at the Human-Animal Interface. Science 326 :1362-1367
Ostfeld & Keesing, 2000. Biodiversity and disease risk : The case of lyme disease. Cons. Biol. 14 : 722-728.
Pinner et al., 1996. Trends in infectious diseases mortality in the United States. JAMA 275(3) : 189-193.
Roche B. & J.F. Guégan, 2011. Ecosystem dynamics, biological diversity and infectious diseases. C. R. Biologies 334 : 385–392.
Taylor L. H., S.M. Latham & M.E. Woolhouse (2001) Risk factors for human disease emergence. Philosophical Transactions of the Royal Society B 356 : 983-989.
Wolfe N.D., C. Panosian Dunavan & J. Diamond, 2007. Origins of major human infectious deseases. Nature 447 : 279-283.
Pour en savoir plus en français :
B. Roche et J.F. Guégan, 2008. Epidémiologie des communautés : Comprendre la complexité locale des systèmes épidémiologiques. Introduction à l’épidémiologie intégrative (eds . J.F. Guégan et Marc Choisy), De Boeck éditions.
Berche P., 2007. Une histoire des microbes, John Libbey Eurotext.
———
Article édité par Nicolas Mouquet



Les élevages et les cultures industriels sont réalisés avec des concentrations très importantes d’individus de la même espèce (plusieurs milliers) dans des conditions totalement artificielles (méthode « hors sol ») Les cultures de légumes présentent parfois la même espèce, sous tunnels plastiques, sur plusieurs hectares. Ces élevages et cultures concentrationnaires sont assortis de protocoles techniques rigoureux visant à éviter toute maladies en traitant souvent par anticipation. Les sujets qui subissent ces protocoles sont fragilisés, débilités. Des veaux de 3 mois amenés à l’abattoir doivent parfois être portés, incapables de se tenir sur leurs pattes. Un veau de cet âge élevé normalement est vif et plein de force. On peut comprendre que si un agent pathogène passe au travers du protocole sanitaire de l’élevage, il puisse se répandre rapidement et obliger à l’abattage de milliers d’animaux. Dans de nombreux cas, l’agriculture est devenue un non-sens, un « cul de sac » technique. Une telle simplification des milieux d’élevage et de culture excluant toute diversité spécifique ne peut que générer des catastrophes, destructrices tant pour la santé que pour l’économie. Il est urgent de revenir à des systèmes plus diversifiés, aussi bien pour la santé et la qualité nutritionnelle des animaux et végétaux produits, pour les conditions de travail des éleveurs et cultivateurs, que pour éviter des épidémies si graves qu’elles en deviennent des pandémies. Nous sommes dans une époque de gâchis suicidaire. La demande en produits biologique explose ; or beaucoup de producteurs ne suivent pas car ils sont financièrement arrimés à des modes de production néfastes et n’ont pas la liberté d’en sortir. L’évolution risque donc d’être lente, pour reconnaître le bienfondé de la diversité du vivant dans les systèmes de production alimentaire.
Bonjour,
Merci pour ce regard passionnant !
J’ai une question de compréhension. La phrase :
« Si, dans une communauté de mammifères ou d’oiseaux, l’abondance des espèces « culs de sac » (peu compétentes pour transmettre les maladies humaines) augmente avec le nombre total d’individus, tandis que celui des hôtes « compétents » diminue »
est-elle une hypothèse ou un résultat ? Dans les deux cas, comment cela pourrait-il se justifier ou s’expliquer ?
Réponse à Hélène :
Cette relation négative suggérée entre le nombre d’espèces dans une communauté animale et la fraction d’individus compétents pour transmettre un pathogène, notamment aux humains, est une hypothèse corroborée par quelques résultats sur certaines maladies, notamment sur la maladie de Lyme transmise au sein des petits mammifères sur la côté Est nord-américaine : plus les communautés de petits rongeurs comportent d’espèces, plus la fraction d’individus infectieux diminue.
Des explications différentes peuvent être avancées, suivant l’échelle spatiale à laquelle on se place.
Benjamin R. : A l’échelle locale, cette relation pourrait être expliquée par le fait que le pathogène peut être sélectionné pour être adapté à l’espèce la plus compétente afin de maximiser sa transmission, et donc sa valeur sélective (fitness).
Ainsi, une large majorité des autres espèces présentes dans la
communauté sont peu ou pas compétentes à transmettre le pathogène.
Néanmoins, cela reste une hypothèse car il y a d’autres situations où ce n’est pas le cas, comme par exemple pour la même maladie de Lyme en Californie.
Anne T. : Je connais mal la bibliographie à ce sujet, mais voici une proposition personnelle d’explication à l’échelle plus large des communautés d’espèces régionales (méta-communautés) :
Pour un même nombre total d’individus dans la communauté observée, la diversité des espèces pourrait freiner la transmission d’une maladie – et donc faire obstacle aux pandémies éventuellement transmissibles aux humains – en réduisant la fréquence des contacts proches entre individus.
Les contacts physiques sont en effet plus fréquents à l’intérieur des espèces, en particulier de vertébrés (interactions sociales tactiles multiples, accouplements, conflits territoriaux, ..) qu’entre espèces distinctes. [Des passereaux de différentes espèces peuvent cohabiter dans un même groupe d’arbres sans se toucher, par exemple.] En réduisant « la sphère de contagion » des individus infectés, la diversité des espèces réduirait le nombre total d’individus infectieux mais aussi la compétence moyenne de chaque individu à transmettre le pathogène dans la communauté.
De plus, en réduisant le nombre d’individus par espèce, la diversité d’une communauté devrait réduire la charge en maladies infectieuse de chaque espèce qui la compose, selon le processus dynamique postulé par Diamond (1996) pour expliquer le maintien de nombreuses maladies infectieuses graves dans les métapopulations européennes.
[NB : Ces hypothèses peuvent être précisées et testées par des modèles dynamiques de communautés, et par des mesures de terrain.]