La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce Regard (R108) de Nicolas Loeuille, Professeur d’Ecologie et Evolution à Sorbonne Université, sur le potentiel d’adaptation des espèces et leur résilience au sein des réseaux écologiques, confrontés aux changements environnementaux.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
——-
Diversité et changements globaux :
compter sur l’évolution, un pari risqué !
Nicolas Loeuille
Professeur à Sorbonne Université, Institut d’Ecologie
et Sciences de l’Environnement (IESS), UMR 7618, Paris
Lauréat du Prix SFE² de la Recherche en 2022
Regard R108, édité par Anne Teyssèdre
—-
Mots-clés : dynamiques éco-évolutives, réseaux écologiques, interactions, évolution rapide, sauvetage évolutif.
—–
- Résumé
- Glossaire
- Introduction
- Qu’est-ce que le sauvetage évolutif ?
- Les limites du concept
- Evolution et réseaux d’interactions, à l’interface de deux complexités
- Deux exemples à l’interface entre écologie et évolution
- Conclusion
- Remerciements
- Bibliographie
- Regards connexes
- Forum de discussion sur ce regard
——
Résumé
Les changements globaux actuels et la crise de la biodiversité questionnent la durabilité du fonctionnement de nos sociétés et mettent celles-ci face à des choix souvent difficiles. Dans le contexte d’une science écologie jeune et aux prédictions souvent fragiles, de multiples inconnues demeurent quant aux trajectoires futures de la diversité à différentes échelles. L’une d’elle porte sur le rôle possible de l’évolution. L’hypothèse d’une réponse évolutive rapide permettant l’adaptation des espèces à leurs nouvelles conditions de vie (hypothèse dite de sauvetage évolutif), pour intéressante qu’elle soit, est susceptible de mener les acteurs politiques et sociaux à un laisser-faire dommageable. Cette hypothèse est cependant basée sur des simplifications fortes des dynamiques évolutives et du contexte écologique associé. Dans le présent regard, je présente le concept de sauvetage évolutif et en discute les limites. J’envisage ensuite comment dépasser une perspective mono-spécifique et intégrer le rôle de l’évolution dans le contexte d’assemblages complexes d’espèces est susceptible de modifier notre compréhension de ce rôle pour le futur proche de la biodiversité. Si l’évolution rapide est dans certains cas, pour certaines espèces, source de résilience, elle peut aussi mener au déclin ou à l’extinction dans différents cas, y compris pour l’espèce qui évolue. Supposer systématiquement un rôle positif de l’évolution est donc à la fois indûment optimiste et potentiellement dangereux.
Glossaire
- Allèles : Ensemble des variations possibles pour un même gène
- Génotype : Composition génétique/allélique d’un individu
- Phénotype : caractère mesurable d’un individu (e.g., taille corporelle, nombre de fleurs), résultat d’une base génétique (génotype), de l’environnement et de leur interaction.
- Phénotype structurant (ou clé) : Phénotype ayant un rôle dominant dans la survenue et/ou l’intensité des interactions écologiques, menant de fait à des variations prédictibles de la structure et du fonctionnement des communautés écologiques.
- Potentiel adaptatif : Variabilité génétique, immédiate ou produite par de nouvelles mutations, servant de base au processus de sélection naturelle.
- Producteur primaire : organisme capable de produire de la matière organique à partir de matière minérale et d’énergie, le plus souvent par photosynthèse. Base énergétique des réseaux trophiques.
- Ratio stoechiométrique : Description de la composition chimique des individus, liant la quantité des différents éléments en proportion de la biomasse (mesurée en quantité de carbone). Le plus souvent C:N ou C:P, les éléments azote (N) et phosphore (P) étant supposés limitants dans de nombreux cas.
- Services écosystémiques : Ensemble des bénéfices écologiques, économiques, culturels ou sociaux pour les populations humaines liés au fonctionnement des écosystèmes. Exemples : service de pollinisation, de régulation des ravageurs, de purification de l’eau, etc.
- Taux de croissance (d’une population) : taux de variation instantané du nombre d’individus au sein de cette population, mesuré au choix comme la différence entre le taux de fécondité et le taux de survie moyen des individus à un temps considéré, ou comme le log du ratio entre les abondances pour deux générations adjacentes (log(Nt+1/Nt)).
- Valeur sélective (d’un génotype, ou d’un individu selon son génotype) : Nombre de descendants viables et fertiles attendus pour un individu, selon son génotype. (Cette variable dépend principalement des taux de reproduction et de survie associés au génotype).
Introduction: Quelles réponses évolutives au changements globaux?
L’évolution a longtemps été ignorée ou sous-estimée dans la gestion de la biodiversité, qu’il s’agisse des développements agricoles, de l’exploitation directe (chasse et pêche) ou des problématiques de conservation. Jusqu’à encore récemment, le paradigme dominant supposait des dynamiques écologiques rapides et une évolution lente. Cette manière de penser est confortable, car elle permet de reléguer toute une partie de la complexité des systèmes naturels (les dynamiques évolutives) hors du champ des applications et donc de simplifier leur conceptualisation et leur gestion.
Cependant, ces dernières décennies, un nombre important de cas d’évolutions rapides ont été rapportés, parfois sur quelques générations de l’espèce considérée. Les pressions exercées par les changements globaux jouant de façon directe sur la valeur sélective* des individus, il est peu surprenant que nombre de ces évolutions rapides soit liées à ces changements (voir le Regard R80a). Une description complète de ces travaux empiriques irait très largement au-delà de la longueur de texte ici autorisée. Ces évolutions sont particulièrement évidentes dans le cas d’espèces chassées (taille corporelle et ornements : Coltman et al. 2003), pêchées (taille et âge à maturité : Olsen et al. 2004) ou dont l’homme tente de contrôler les effectifs (parasites des humains ou de leurs cultures, voir Carlson et al. 2014).
D’autres évolutions rapides sont directement liées aux variations environnementales actuelles, en lien avec les changements climatiques (Nussey et al. 2005, Franks et al. 2007, Phillimore et al. 2010), l’acidification des océans (Pandolfi et al. 2011) et la fragmentation des habitats (Cheptou et al. 2008). De même, une évolution génétique rapide a été observée à la fois chez les espèces invasives (Phillips et al. 2006, Shine et al. 2011), confrontées à un nouvel habitat, et chez les espèces des communautés qui les reçoivent, dont l’habitat et les conditions de vie sont changées par l’invasion (Carroll et al. 2005, Phillips & Shine 2004).
La possibilité d’une évolution rapide est donc maintenant largement reconnue, et à l’origine du développement rapide des recherches autour des dynamiques éco-évolutives ces dernières années. L’idée d’une évolution lente demeure cependant ancrée dans l’imaginaire collectif – comme l’atteste mes discussions avec de nombreux étudiants-, et même dans nos recherches, où elle reste fréquemment un point de départ. Malgré toutes les observations, la prise en compte de l’évolution rapide demeure largement absente de la gestion des pêches (eg, de la définition des quotas et poliques de pêches, Palkovacs et al. 2018) ou de la gestion des systèmes agricoles (dits agrosystèmes) (Denison et al. 2003, Loeuille et al. 2013). De même, les modèles cherchant à prédire le devenir de la biodiversité étant donnés les changements climatiques reposent le plus souvent sur des hypothèses de « conservatisme de niche », supposant la fixité de celle-ci et ignorant son évolution potentielle (Lavergne et al. 2010). L’évolution rapide est donc face à un paradoxe : largement appréciée en général, mais peu envisagée dans la pratique.
Qu’est-ce que le sauvetage évolutif ?
Dans l’ensemble des travaux cités ci-dessus, les populations étudiées étaient confrontées à un changement rapide de leurs conditions de vie (modification de leur habitat, augmentation de la prédation..), exerçant une forte pression de sélection en faveur des individus les moins vulnérables à ces changements. Et dans de nombreux cas, la réponse évolutive de ces populations s’est avérée adaptative, dans le sens notamment où elle a freiné leur déclin et éventuellement permis leur maintien au fil des ans (i.e., augmenté le taux de croissance* de ces populations). C’est pourquoi cette réponse évolutive rapide est appelée ‘sauvetage évolutif’.
Si l’idée du sauvetage évolutif est basée sur des principes généraux de biologie évolutive, sa formalisation demeure assez récente. Dans leur modèle théorique, Gomulkiewicz & Holt (1995) étudie le devenir d’une population soumise à un stress environnemental (figure 1). La population est supposée initialement à l’équilibre, ce qui implique qu’en moyenne, fécondité et mortalité sont égales. Le stress faisant au choix chuter la fécondité ou augmenter la mortalité, le déclin de la population est inéluctable et celle-ci s’éteint en l’absence d’évolution. Imaginons maintenant qu’une certaine variabilité génétique existe dans la population, et que certains allèles permettent une meilleure valeur sélective* (ici simplement définie en tant que différence entre fécondité et mortalité) des individus confrontés aux nouvelles conditions de vie. Cet allèle augmentera dès lors en fréquence dans la population, permettant une augmentation du taux de croissance* de celle-ci.
Si cette évolution est suffisamment efficace, le rebond de la population peut ramener celle-ci à un niveau suffisant et favoriser sa survie dans les nouvelles conditions (Figure 1A). Par essence, le sauvetage évolutif peut donc être compris comme une course entre d’un côté les effets de la perturbation (rapidité du déclin) et des effets de l’évolution (rapidité du rebond), ici vue totalement sous un angle adaptatif. La population sera sauvée, sous la condition que sa densité ne passe pas trop de temps à faible niveau, le risque d’extinction étant accru dans les faibles populations (cf. Regard R9).
La formalisation mathématique, ainsi que de multiples travaux subséquents sur le sauvetage évolutif (e.g., résumé dans Carlson et al. 2014) permettent d’identifier un certain nombre de conditions favorisant le sauvetage évolutif :
– La population initiale doit être suffisamment nombreuse (Figure 1B). La course entre déclin et rebond est plus facile si la population peut encaisser la perturbation longtemps avant de passer sous le seuil de risque.
– La population initiale doit avoir suffisamment de variabilité génétique (Figure 1C). La probabilité d’avoir au sein de la population un allèle adéquat au changement considéré est alors plus importante, permettant de fait une adaptation plus rapide.
– La perturbation ne doit pas être trop intense. En effet, une forte intensité (en terme de surmortalité ou d’abaissement trop fort de la fécondité) amènerait la population rapidement sous le seuil de viabilité avant qu’une adaptation ne soit possible.
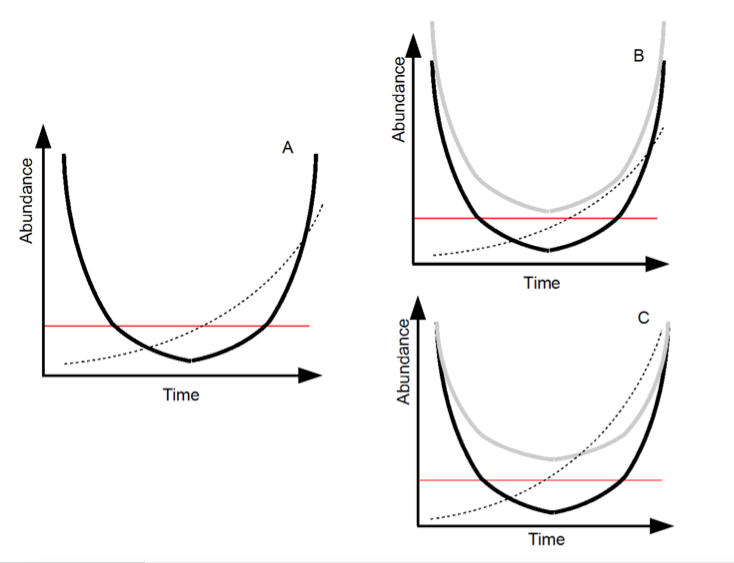
Figure 1: Présentation du sauvetage évolutif. A) Supposons qu’une population initialement à l’équilibre soit confrontée à une perturbation durable de ses conditions de vie. Dans un premier temps, le nombre des individus (dit abondance, courbe noire) décline. Dans ce nouveau contexte environnemental, imaginons qu’un certain allèle procure un avantage adaptatif (ou sélectif) aux individus qui le portent. La fréquence de cet allèle (trait pointillé) augmente donc, du fait de la sélection naturelle (adaptation). Cette adaptation mène à une restauration du taux de croissance de la population, qui peut alors réaugmenter (courbe noire ascendante). Le temps passé à basse population (sous le seuil rouge) donne alors une approximation du risque d’extinction. B) Une population initialement plus importante (courbe claire) a une meilleure probabilité de sauvetage évolutif (pas de passage sous le seuil). C) Une population avec une meilleure variabilité génétique (courbe claire) a une meilleure probabilité de sauvetage évolutif (pas de passage sous le seuil). (Schéma N. Loeuille.)
Cette liste n’est pas exhaustive (voir Carlson et al. 2014 pour un état des lieux plus complet) et les conditions d’application du sauvetage évolutif continuent d’être l’objet de multiples recherches, théoriques comme expérimentales. Il est cependant bon de s’arrêter déjà sur ces trois conditions, qui font raisonnablement consensus, et d’en tirer les conséquences.
Le sauvetage évolutif ne permettra pas de sauver la majorité des espèces menacées, ces dernières ayant souvent une densité faible et une variabilité génétique réduite (voir les Regards R9 et R80). Compter sur le sauvetage évolutif est donc hasardeux, même en prenant sa conceptualisation première, énoncée ci-dessus et illustrée par la figure 1. Par contre, considérant que certaines espèces, invasives, déprédatrices des cultures ou/et vecteurs de maladies (microrongeurs, insectes et microorganismes parasites…) sont à la fois abondantes et diverses génétiquement, il n’est pas surprenant qu’elles puissent évoluer rapidement en réponse aux traitements qu’on leur inflige (van der Wal 2012, Carlson et al. 2014, et Regard R80). De fait, le sauvetage évolutif peut expliquer pourquoi une même cause (e.g., les changements agricoles et l’utilisation massive de pesticides) peut mener à la fois l’évolution rapide de résistances chez certaines espèces d’insectes (Carlson et al. 2014) tout en menant à un effondrement massif de nombreuses autres espèces du même groupe (eg, Hallmann et al. 2017, Millard et al. 2021). Cette dichotomie a également été discutée dans un autre regard sur la biodiversité (Regard R92 de L. Després, 2020).
Les limites du concept
Le cadre initial du sauvetage évolutif comporte un certain nombre d’hypothèses qui le rende probablement optimiste quant aux issues possibles de l’évolution, même en restant ancré dans un cadre monospécifique. En effet, le modèle initial repose sur une définition largement simplifiée de la valeur sélective des individus (ou plus exactement de leur génotype*), qui est supposée indépendante de la densité de la population et de la fréquence des allèles. Si l’évolution change par exemple la densité d’une population, l’intensité de la compétition entre individus peut alors varier, ce qui change la valeur sélective. Egalement, la valeur sélective d’un individu peut être très importante quand son génotype est rare, mais s’éroder progressivement quand ce génotype devient dominant dans la population. Ignorant ces effets, le sauvetage évolutif repose donc sur une vision très simplifiée de la boucle de rétroaction existant entre écologie et évolution. Même si elles sont ignorées de nombreux modèles, densité et fréquence dépendances concernent une part importante des scénarios évolutifs qu’on puisse imaginer (Metz & Geritz 2016).
Dès lors que ces éléments sont compris dans la réflexion évolutive, il n’est pas attendu que l’évolution mène systématiquement à un meilleur taux de croissance ou à une densité de population accrue (Rohr & Loeuille 2022), préceptes sur lesquels repose directement le concept de sauvetage évolutif. En fait, l’évolution n’optimise en général aucune propriété des populations (Metz et al. 2008). Ceci peut paraître paradoxal. Il convient cependant de rappeler que la direction de l’évolution est basée sur des différences de valeur sélective*, à l’échelle du gène ou de l’individu, tandis que taux de croissance et densités sont des propriétés populationnelles. Passer de la première échelle (individuelle) à la suivante (populationnelle) ne va pas de soi.
En fait, de nombreux modèles montrent des populations décroissantes le long de trajectoires évolutives, les rendant vulnérables aux aléas (« détérioration évolutive », e.g., Matsuda & Abrams 1994). Pire, sous certains scénarios, l’évolution peut mener directement à l’extinction (« suicide évolutif », Parvinen 2005). Un excellent résumé de ses processus évolutifs menant à une plus grande vulnérabilité des populations peut être trouvé dans Dieckmann & Ferrière (2004). Ces travaux ont naturellement mené à la discussion de la possibilité d’extinctions évolutives dans la nature (Rankin & Sepulcre 2005). Leur prévalence est difficile à estimer, les extinctions dans les systèmes naturels étant le plus souvent le résultat de multiples facteurs en interaction, dont il est difficile d’isoler un seul. En tous les cas, l’ensemble de ces études soulignent que même dans un cadre populationnel (une seule espèce), l’idée que l’évolution va permettre d’éviter l’extinction repose sur de nombreuses hypothèses et doit être appréhendée avec précaution.
Evolution et réseaux d’interactions, à l’interface de deux complexités
La théorie proposée ci-dessus repose sur un cadre uniquement ciblé sur le devenir de la population, en l’absence d’interactions avec d’autres espèces (i.e. sur des modèles populationnels). Cependant, le concept de biodiversité est par essence plurispécifique, tout comme les assemblages complexes que sont les écosystèmes. Le concept de sauvetage évolutif n’offre ainsi qu’une vue parcellaire des effets de l’évolution pour le futur de la biodiversité.
Imaginons deux espèces qui auraient un potentiel adaptatif* suffisant pour qu’un sauvetage évolutif soit prédit pour chacune considérée séparément, en réponse à une perturbation durable de leur environnement. Sans interaction entre ces espèces, les deux peuvent se maintenir (figure 2A). Notons cependant qu’une des deux espèces (ici en sombre) peut passer un certain temps à faible population et échapper donc de peu à l’extinction. Pour la deuxième espèce (en clair), le sauvetage évolutif est plus efficace, par exemple parce qu’elle a une plus grande population initiale ou une meilleure variabilité génétique.
Si les deux espèces se trouvent maintenant en interaction dans une même communauté, les effets de l’évolution sur la diversité dépendent de l’interaction et du rôle des deux espèces. En compétition (figure 2B), le rebond de l’espèce claire va exercer une forte pression de compétition sur l’espèce sombre. Comme l’adaptation de cette dernière était déjà fragile et incertaine, son extinction est tout à fait probable.
Idem si l’espèce claire consomme l’espèce sombre (figure 2C). Dans ces deux cas, la réponse évolutive de l’espèce claire est susceptible de conduire l’espèce sombre à l’extinction (i.e., un « meurtre évolutif »).
Notons que dans d’autres cas, les interactions écologiques peuvent au contraire faciliter le sauvetage évolutif. Par exemple, si les deux espèces sont en interaction mutualiste (e.g, une fleur et son pollinisateur), le sauvetage évolutif de l’espèce claire amènera des bénéfices écologiques à l’espèce sombre, augmentant potentiellement sa population et facilitant son sauvetage évolutif (figure 2E). Un raisonnement analogue s’applique si l’espèce claire est la proie de l’espèce sombre (figure 2D).
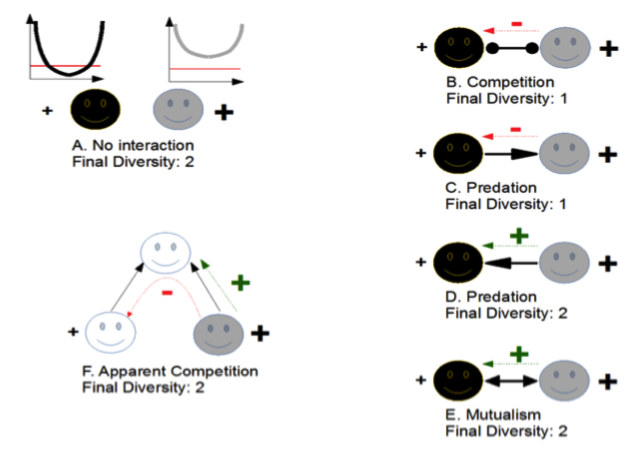
Figure 2: Sauvetage évolutif et interactions écologiques. On suppose deux espèces et que l’adaptation est suffisamment rapide pour permettre leur survie face à la perturbation, si on les considère séparément (sauvetage évolutif) (panneau A). Cependant, une des deux espèces (en clair) a une adaptation beaucoup plus rapide et efficace que l’autre espèce (en sombre). De fait, si une interaction écologique est supposé entre les deux espèces, la diversité finale peut être égale à celle prédite par le sauvetage évolutif (panneaux D et E), mais est en fait souvent inférieure du fait des effets écologiques (panneaux B, C, F). Adapté de N. Loeuille, 2019.
Dans un réseau multi-espèces (e.g., un réseau trophique), les effets indirects peuvent être plus complexes. Par exemple, si une proie évolue rapidement en réponse à un changement de son habitat (gris clair sur figure 2F), et tant qu’il ne s’agit pas d’une réponse à l’évolution de son prédateur, elle facilitera le maintien de ce dernier dans cet habitat. Mais la pression que celui-ci exercera sur ses autres proies sera alors accrue et les fragilisera face à la perturbation (compétition apparente, Holt 1977). Pour plus de détails et de discussion, voir Loeuille (2019).
La figure 2 souligne que l’hypothèse du sauvetage évolutif (e.g. deux espèces maintenues, figure 2A) donne une image indument optimiste des effets de l’évolution. Dans de nombreux cas (Figure 2C , 2D et 2F par exemple), les interactions écologiques causent l’extinction d’une –au moins- des populations en présence, malgré leur potentiel adaptatif* initial. Le message est ici simple : si certaines espèces semblent s’adapter aisément aux perturbations actuelles, cela ne veut pas dire nécessairement que le bilan est positif globalement. Cette adaptation peut engendrer des sur-compétitions ou la surexploitation d’autres espèces du réseau, et leur extinction.
Le bilan ici dressé repose simplement sur les effets écologiques indirects existant dans les communautés naturelles, amplement étudiés en écologie (eg, Wootton 1994, Yodzis 1998). La nouveauté est simplement de les considérer d’un point de vue évolutif : en réponse aux changements globaux actuels, il se peut que les effets écologiques directs et indirects futurs dans les écosystèmes passent prioritairement par les espèces ayant le meilleur potentiel adaptatif*, qui joueront alors le rôle de clés de voute dans ces écosystèmes modifiés.
Deux exemples à l’interface entre écologie et évolution
Ainsi, comme l’illustre la figure 2, l’effet de l’évolution sur le maintien de la diversité s’avère contexte dépendant. La propagation des effets indirects au sein d’un réseau écologique dépend à la fois du type de réseau (mutualiste ou antagoniste) et de sa complexité. Il semble difficile a priori de décréter quels seront les effets positifs ou négatifs. On touche ici une des frontières de l’écologie prédictive : l’interface entre deux complexités, évolution et communautés, qui rendent notre compréhension de la résilience des écosystèmes parcellaire.
Dans un contexte où prédiction et gestion de ces problèmes relève d’une demande politique et sociale forte, de nombreux exemples soulignent à quel point ces aspects peuvent venir limiter notre intuition et notre anticipation des effets attendus des perturbations exercées par les humains sur leur environnement. L’exemple des pêches est particulièrement illustratif.
Celles ci sont souvent gérées sur la base d’indices populationnels qui ne rendent pas compte des variations de la communauté écologique. L’exemple d’une pêche très surveillée et gérée en étroite collaboration avec les scientifiques, celle du lieu d’Alaska (Theragra chalcogramma) dans le Pacifique Nord, montre la fragilité de cette gestion. Les quotas proposés n’ont pu endiguer les déclins locaux, et les changements de la communauté écologique, non pris en compte, sont supposés être à l’origine de ces surprises (Morell 2009).
Les surprises liées aux phénomènes évolutifs sont tout aussi facilement observables. La gestion directe d’espèces considérées comme néfastes (ravageurs des cultures, parasites, vecteurs de pathogènes) mènent souvent à des évolutions rapides (résistances aux pesticides, résistances aux antibiotiques, etc.), mais dont le calendrier et les effets exacts ne peuvent être prédits, simplement expliqués a posteriori (eg Carlson et al. 2014, van der Wal et al. 2012). Ces évolutions restent un défi important pour la durabilité de la médecine comme de l’agriculture.
Il faut donc rester très humbles sur nos capacités de prédiction de ces dynamiques évolutives. Cependant, sous la condition qu’un système soit contraint selon des variations phénotypiques clairement identifiées, il est possible de développer des modèles avec phénotypes* clés, ou structurants*, permettant sinon des prédictions, au moins d’identifier des scénarios possibles.
Cette condition de phénotypes* clés ou structurants peut sembler rédhibitoire. Cependant, certains travaux semblent suggérer que de tels phénotypes existent. Ainsi, l’analyse des réseaux trophiques s’appuie depuis longtemps sur les variations de la taille des individus entre les espèces composants ces réseaux (Yodzis & Innes 1992, Brose et al. 2006a) dont l’influence transcende les échelles d’organisation, depuis l’interaction trophique elle-même (Berlow et al. 2004, Brose et al. 2006b) jusqu’à la structure et au fonctionnement du réseau (Petchey et al. 2008).

Les grands poissons mangent les petits : ce dessin de Brueghel l’Ancien (1556) montre clairement à quel point le lien entre certains phénotypes (ici taille corporelle) et les interactions écologiques (ici la prédation) a été perçu tôt de manière intuitive, avant d’être documenté scientifiquement. L’évolution de tels phénotypes clés, largement observée actuellement, est susceptible de bouleverser les assemblages écologiques.
De même, les variations dans les ratios stoechiométriques* des organismes (e.g., combien d’atomes azote N ou phosphore P en moyenne, par atome de carbone C), reflétant leurs besoins en nutriments, peuvent contraindre de multiples échelles, du comportement individuel (Balluffi-fry et al. 2020) à l’organisation des communautés (Sterner & Elser 2003). Enfin, dans la très grande diversité des formes végétales, a priori d’une infinie complexité, des récents travaux suggèrent que les associations entre traits sont fortement contraintes par différents compromis évolutifs. Une partie non négligeable de cette diversité pourrait être alors capturée par quelques axes phénotypiques* (Wright et al. 2004, Diaz et al. 2016).
Dans la suite de ce regard, je présenterai deux travaux qui s’appuient sur des phénotypes structurants*, pour comprendre comment leur évolution affecte la persistance des communautés.
1. Réchauffement climatique et évolution de la taille dans les réseaux trophiques
Depuis une quinzaine d’années, je développe des modèles d’évolution de la taille corporelle au sein de réseaux trophiques. Le modèle évolutif s’appuie sur l’idée que la taille corporelle contraint les interactions trophiques (Yodzis & Innes 1992, Berlow et al. 2004, Brose et al. 2006b), les interactions de compétition (eg, Bowers & Brown 1982) et la fécondité et mortalité des individus (Brown et al. 2004). En incorporant ces différentes composantes, la coévolution des tailles corporelles peut mener à des réseaux dont la structure ressemble à celles des réseaux observés dans la nature (Loeuille & Loreau 2005, Allhoff et al. 2015). Un exemple de structure trophique obtenu par un tel modèle est représenté figure 3A. Nous avons utilisé ce modèle pour essayer de comprendre comment le réchauffement climatique pourrait changer la structure du réseau et sa diversité (Yacine et al. 2021), avec (figure 3C) ou sans évolution (Figure 3B).
Dans ces simulations, l’hypothèse sous jacente est que le réchauffement climatique entraine un coût métabolique direct, qui doit être compensé par une acquisition d’énergie accrue pour chaque consommateur. Or au sein des réseaux trophiques, seule une faible partie de l’énergie consommée (typiquement 10-20%, Lindeman 1942) sert à produire de nouveaux individus prédateurs. De fait, l’énergie fixée en bas des réseaux (par la photosynthèse des producteurs primaires*) est progressivement dissipée le long des chaines trophiques – c’est pourquoi les niveaux supérieurs sont sévèrement limités en énergie (voir aussi le Regard 103).
Le coût métabolique engendré par le réchauffement frappe ainsi fortement les espèces des niveaux trophiques supérieurs. Le modèle présenté ici montre que, sans réponse évolutive des espèces du réseau, une grande partie de celui-ci est perdue (50 % dans le cas montré par la figure 3B). [NB : sur cette Figure 3B, l’évolution est stoppée au symbole noir, tandis que le symbole rouge montre le début du réchauffement.]
Avec évolution, en revanche, les espèces ajustent progressivement leur taille adulte à la disponibilité des ressources et aux nouvelles contraintes d’interaction. La taille adulte des espèces de haut niveau trophique, en particulier, diminue, ce qui peut permettre leur maintien au sein du réseau. Ce cas avec évolution, représenté figure 3C (le symbole rouge indique le début du réchauffement), peut porter à l’optimisme. A long terme, la diversité du réseau se maintient malgré le réchauffement. Le modèle suggère que ces dynamiques sont conformes aux attentes du sauvetage évolutif (à ma grande surprise, voir le texte ci-dessus). La diversité est d’autant mieux maintenue que la réponse évolutive est rapide ou que le réchauffement est limité en amplitude (Yacine et al. 2021).
Cet optimisme doit cependant être modéré. Considérez de près la dynamique montrée par la figure 3C. Si la diversité se maintient bien sur le long terme, la secousse subie par le réseau est violente, le réseau perdant plus de la moitié de sa diversité juste après le réchauffement (symbole rouge), avant de se remettre progressivement. Cet effondrement transitoire du réseau implique par ailleurs un chamboulement radical de son mode de fonctionnement, et donc une modification drastique des bénéfices tirés par les humains de son fonctionnement (services écosystémiques*).
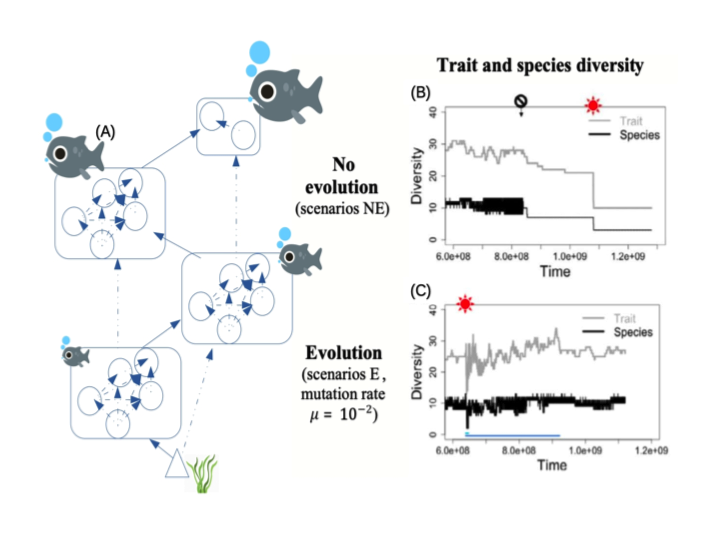
Figure 3: Effets d’une augmentation de la température sur l’évolution de la taille et le maintien de la diversité dans les réseaux trophiques. (A) Un exemple de réseau trophique diversifié émergeant de la coévolution des tailles des différentes « espèces ». Les ronds correspondent aux populations de proies et prédateurs dans le réseau, tandis que les compartiments rectangulaires figurent les différents niveaux trophiques. Les flèches continues figurent les interactions prédateurs-proies dominantes, les flèches discontinues les interactions prédateurs-proies faibles. La force des interactions dépend de la taille relative des proies et prédateurs; (B-C) Effet d’une augmentation de la température (symbole soleil rouge) sur la diversité du réseau (nombre de phénotypes* en gris, nombre d’espèces en noir), avec (C) et sans (B) évolution (le symbole interdit noir montrant l’arrêt de l’évolution). Adapté de Yacine et al., 2021.
Un autre élément, non clairement capturé par la figure 3, est que la structure du réseau après évolution demeure profondément affectée. Si la diversité est maintenue au final, les patterns de tailles corporelles sont profondément modifiés. Les tailles les plus grandes ont été contre-sélectionnées, les niveaux trophiques supérieurs demeurent largement érodés (voir également Weinbach et al. 2017). De façon intéressante, cette contre-sélection est cohérente avec les observations empiriques actuelles, qui suggèrent que le réchauffement climatique favorise les petites tailles, non seulement au sein des populations de même espèce (en lien potentiel avec des phénomènes évolutifs) mais également entre espèces, au sein d’une communauté (Daufresne et al. 2009, Sheridan & Bickford 2011). Du coup, les réseaux soumis à réchauffement, même avec évolution, voient leur structure et leur fonctionnement fortement modifiés. En fait, plutôt qu’une robustesse, le modèle suggère ici simplement que l’évolution à long terme peut permettre de restaurer la diversité, en cohérence d’ailleurs avec les dynamiques évolutives passées qui montrent qu’après chaque crise d’extinction majeure, une forte diversification a permis de revenir et même de dépasser les niveaux de diversité passés.
2. Evolution de l’attraction florale en réponse aux déclins de pollinisateurs
Sous la pression croissante des activités humaines, les systèmes plantes-pollinisateurs sont actuellement bien stressés. Des décennies d’agriculture intensive ont mené à la fois à un changement radical de l’habitat des espèces de pollinisateurs et à une accumulation déraisonnable de molécules toxiques (pesticides) dans leur environnement. Ces déclins sont aujourd’hui bien documentés et amplifiés par les changements climatiques actuels (Potts et al. 2010, Millard et al. 2021, voir aussi le Regard à paraître d’Emmanuelle Porcher). Parce que ces pollinisateurs assurent reproduction et flux de gènes pour l’immense majorité des plantes à fleurs, les effets de leur déclin pour l’évolution de ces dernières devraient être importants. Pourtant le lien entre cette évolution et le maintien des communautés plantes-pollinisateurs n’est pas forcément simple.
Pour l’étudier (Weinbach et al. 2022, voir figure 4), nous avons considéré comme trait phénotypique l’investissement de la plante dans l’interaction mutualiste, c’est à dire sa production de signaux d’attraction (ex : fleurs nombreuses et colorées, composés organiques volatiles) ou de récompenses (nectar) pour les pollinisateurs. Comme chacune de ces composantes demande ressource et énergie, un trait d’investissement accru est supposé réduire la croissance des plantes et leur fécondité hors pollinisation (e.g., auto-fécondation, reproduction clonale), donc le taux de croissance de la population de plantes hors pollinisation par les insectes (figure 4A). Dans ce modèle, sans réponse évolutive des plantes, une perturbation modérée augmentant le taux de mortalité des pollinisateurs mène simplement à un système dégradé, mais stable, où les densités des plantes comme des pollinisateurs sont réduites (figure 4B).
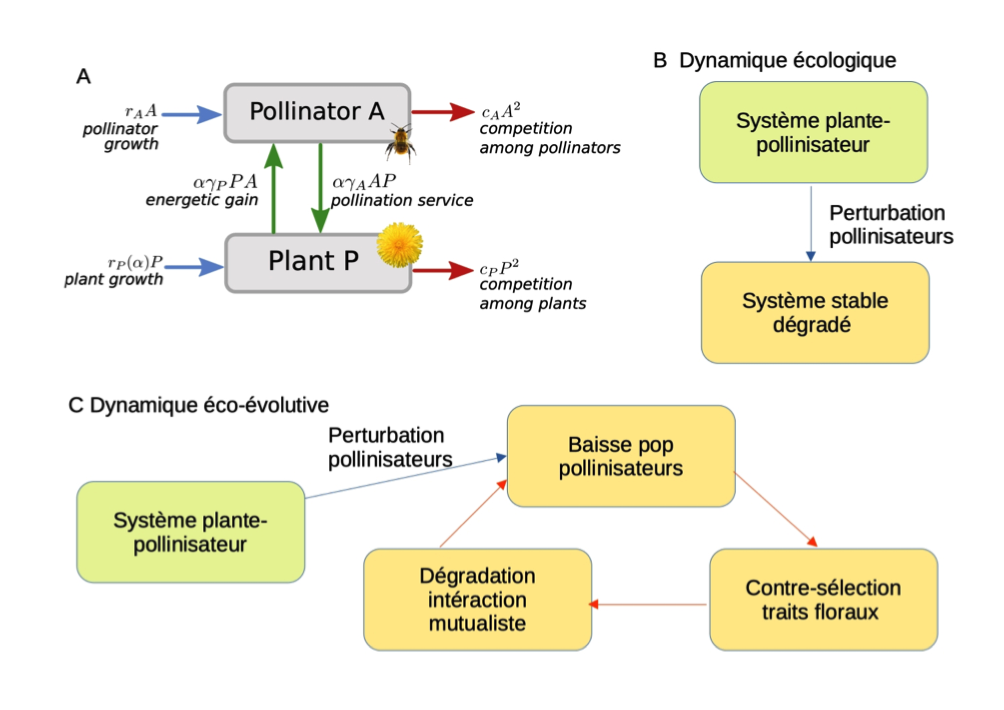
Figure 4: Dynamiques éco-évolutives et persistance des systèmes mutualistes. A) Présentation du système plante-pollinisateur. Le trait phénotypique étudié, α correspond à l’investissement des plantes dans l’interaction mutualiste (ex:production de fleurs, nectar, odeurs, etc). Ce trait augmente l’interaction mutualiste, mais est supposé coûteux (notez que le taux de croissance des plantes hors pollinisation rp dépend de α). B) Lors d’une perturbation agissant sur les pollinisateurs, la dynamique écologique mène vers un système persistent, mais dégradé. C) La prise en compte de l’évolution mène à une boucle de rétroaction qui amplifie la perturbation et peut mener à l’extinction des pollinisateurs. Adapté de Weinbach et al., 2022.
Cependant, l’évolution des plantes mène ici à une amplification de la perturbation (figure 4C). Du fait de la perturbation, la densité des pollinisateurs baisse. [Notons ici que le comportement ou ‘service’ de pollinisation ne correspond pas nécessairement à une espèce donnée, mais à l’ensemble des populations d’insectes assurant ce service. Même si une faible proportion d’espèces peuvent s’adapter à ces perturbations, les estimations du déclin actuel des abeilles et autres insectes dans les régions agricoles (e.g., Regard R103) suggèrent que cette possibilité ne compense pas les pertes des autres espèces.]
Le trait d’investissement de la plante perdant en efficacité, du fait de la raréfaction des pollinisateurs, il est donc contre-sélectionné. Face à des plantes moins attractives ou/et moins riches en nectar, les gains des pollinisateurs sont à leur tour réduits, et leur population décline d’autant. Ce qui mène à une boucle de rétroaction éco-évolutive dommageable pour l’ensemble du système. Si l’effet de la perturbation est suffisant, l’évolution peut mener à l’extinction des pollinisateurs et également empêcher une restauration efficace (i.e., revenir sur la perturbation ne suffit pas pour maintenir le système).
Si ce scénario semble contredire les attentes de la figure 2E , qui discute le sauvetage évolutif, la contradiction n’est qu’apparente : cette figure ignore les aspects « fréquence-dépendants » des dynamiques évolutives, qui sont ici pleinement considérés.
Plusieurs observations laissent penser que ce type de dynamique évolutive est possible. D’abord, une démonstration expérimentale de ce mécanisme existe (Gervasi & Schiestl 2017). Dans cette expérience, les auteurs ont soumis Brassica rapa à différentes espèces de pollinisateurs, plus ou moins efficaces pour la pollinisation de cette plante. Lorsque celle-ci interagit uniquement avec des pollinisateurs peu efficaces, une évolution vers moins d’investissement dans l’interaction est observée, en seulement quelques générations. D’autres travaux empiriques ont montré une tendance à l’évolution rapide des plantes vers d’autres modes de reproduction quand les pollinisateurs viennent à manquer (Baker 1967, Kalisz et al. 2004, Bobdyl-Roels & Kelly 2011). Le modèle présenté ici suggère que ces évolutions peuvent amplifier les déclins observés et menacer la persistance du système.
Conclusion
Ces deux exemples nous montrent que les effets de l’évolution sur le maintien des communautés écologiques dépendent largement de l’interaction considérée (trophique dans le premier cas, mutualiste dans le deuxième), et des phénotypes structurants le réseau (taille corporelle dans le premier cas, investissement dans les traits floraux dans le deuxième). Postuler un effet positif de l’évolution semble donc difficilement tenable. Puisque l’effet de l’évolution sur le maintien de l’intégrité des réseaux écologiques dépend du contexte, il semble urgent d’étudier les différents scénarios socio-écologiques possibles menant à ces conséquences évolutives contrastées, afin de mieux comprendre et anticiper les changements à venir de ces réseaux.
Remerciements
Je tiens à remercier ici les nombreux collègues avec qui j’ai pu travailler sur ces questions, et particulièrement à Michel Loreau qui m’a encouragé à étudier ces modèles éco-évolutifs au cours de ma thèse et au-delà. J’ai volontairement choisi comme modèles illustratifs des travaux réalisés par mes doctorant.e.s. Je souhaite par là remercier mes étudiant.e.s (master comme thésard.e.s) et postdoctorant.e.s pour leur dynamisme et pour le plaisir de travailler avec eux/elles. Mes sincères remerciements également à Anne Teyssèdre, éditrice de ce Regard sur la biodiversité, pour ses nombreuses suggestions avisées.
——
Bibliographie
Allhoff K. T., Ritterskamp D., Rall B. C., Drossel B. & Guill C., 2015. Evolutionary food web model based on body masses gives realistic networks with permanent species turnover. Scientific reports 5(1), 1-12.
Baker H. G., 1967. Support for Baker’s Law-as a rule. Evolution 21: 853–856.
Balluffi Fry J., Leroux S. J. et al., 2020. Quantity–quality trade‐offs revealed using a multiscale test of herbivore resource selection on elemental landscapes. Ecology and evolution 10(24), 13847-13859.
Berlow E. L., Neutel A. M. et al., 2004. Interaction strengths in food webs: issues and opportunities. Journal of animal ecology 73, 585-598.
Bodbyl Roels S. A. & Kelly J. K., 2011. Rapid evolution caused by pollinator loss in Mimulus guttatus. Evolution 65 (9), 2541-2552.
Bowers M. A. & Brown J. H., 1982. Body Size and Coexistence in Desert Rodents: Chance or Community Structure? Ecological Archives E063-002. Ecology 63 (2), 391-400.
Brose U., Williams R. J., & Martinez N. D., 2006a. Allometric scaling enhances stability in complex food webs. Ecology letters 9 (11), 1228-1236.
Brose U., Jonsson, T. et al., 2006b. Consumer–resource body‐size relationships in natural food webs. Ecology 87 (10), 2411-2417.
Brown J. H., Gillooly J. F. et al., 2004. Toward a metabolic theory of ecology. Ecology, 85(7), 1771-1789.
Carlson S. M., Cunningham C. J. & Westley P. A., 2014. Evolutionary rescue in a changing world. Trends in Ecology & Evolution 29 (9), 521-530.
Carroll S. P., Loye J. E. et al., 2005. And the beak shall inherit–evolution in response to invasion. Ecology letters 8(9), 944-951.
Cheptou P. O., Carrue O., Rouifed S. & Cantarel A., 2008. Rapid evolution of seed dispersal in an urban environment in the weed Crepis sancta. Proceedings of the National Academy of Sciences 105 (10), 3796-3799.
Coltman D. W., O’Donoghue P. et al. 2003. Undesirable evolutionary consequences of trophy hunting. Nature 426 (6967), 655-658.
Daufresne M., Lengfellner K. & Sommer U., 2009. Global warming benefits the small in aquatic ecosystems. Proceedings of the National Academy of Sciences 106 (31), 12788-12793.
Denison R. F., Kiers E. T., & West S. A., 2003. Darwinian agriculture: when can humans find solutions beyond the reach of natural selection?. The Quarterly Review of Biology 78( 2), 145-168.
Després L., 2020. Le paradoxe des zones humides d’Europe. Regards et débats sur la Biodiversité, SFE2, Regard R92, sept. 2020.
Díaz S., Kattge J. et al., 2016. The global spectrum of plant form and function. Nature 529 (7585), 167-171.
Dieckmann U. & Ferrière R., 2004. Adaptive dynamics and evolving biodiversity. Chapter 11 in Evolutionary Conservation Biology , Ferrière R., Dieckmann U. & Couvet D. Cambridge University Press.
Franks S. J., Sim S. & Weis A. E., 2007. Rapid evolution of flowering time by an annual plant in response to a climate fluctuation. Proceedings of the National Academy of Sciences, 104 (4), 1278-1282.
Gervasi D.D. & Schiestl F. P., 2017. Real-time divergent evolution in plants driven by pollinators. Nature Communications 8 (1), 1-8.
Gomulkiewicz R. & Holt R. D., 1995. When does evolution by natural selection prevent extinction? Evolution 49 (1), 201-207.
Hallmann C. A., Sorg M. et al., 2017. More than 75 percent decline over 27 years in total flying insect biomass in protected areas. PloS one 12( 10), e0185809.
Holt R. D., 1977. Predation, apparent competition, and the structure of prey communities. Theoretical population biology, 12(2), 197-229
Kalisz S., Vogler D. W. & Hanley K. M., 2004. Context-dependent autonomous self-fertilization yields reproductive assurance and mixed mating. Nature, 430(7002), 884-
Lavergne S., Mouquet N., Thuiller W. & Ronce O., 2010. Biodiversity and climate change: integrating evolutionary and ecological responses of species and communities. Annual review of ecology, evolution, and systematics 41, 321-350.
Lindeman R. L., 1942. The trophic-dynamic aspect of ecology. Ecology 23(4), 399-417.
Loeuille N., 2019. Eco-evolutionary dynamics in a disturbed world: implications for the maintenance of ecological networks. F1000Research 8.
Loeuille N., Barot, S., Georgelin E., Kylafis G. & Lavigne C., 2013. Eco-evolutionary dynamics of agricultural networks: implications for sustainable management. In Advances in ecological research (Vol. 49, pp. 339-435), Academic Press.
Loeuille N. & Loreau M., 2005. Evolutionary emergence of size-structured food webs. Proceedings of the National Academy of Sciences 102 (16), 5761-5766.
Matsuda H. & Abrams P. A., 1994. Runaway evolution to self‐extinction under asymmetrical competition. Evolution 48 (6), 1764-1772.
Metz J.A.J. & Geritz,S. A., 2016. Frequency dependence 3.0: an attempt at codifying the evolutionary ecology perspective. Journal of Mathematical Biology, 72(4), 1011-1037.
Metz J.A.J., Mylius S. D. & Diekmann O., 2008. When does evolution optimise? Evolutionary Ecology Research 10: 629–654.
Millard J., Outhwaite C.L. et al., 2021. Global effects of land-use intensity on local pollinator biodiversity. Nature communications 12 (1), 1-11.
Morell V., 2009. Can science keep Alaska’s Bering Sea pollock fishery healthy?.
Nussey D. H., Postma E., Gienapp P. & Visser M. E., 2005. Selection on heritable phenotypic plasticity in a wild bird population. Science 310 (5746), 304-306.
Olsen E. M., Heino M et al., 2004. Maturation trends indicative of rapid evolution preceded the collapse of northern cod. Nature 428 (6986), 932-935.
Palkovacs E. P., Moritsch M. M., Contolini G. M. & Pelletier F., 2018. Ecology of harvest‐driven trait changes and implications for ecosystem management. Frontiers in Ecology and the Environment 16 (1), 20-28.
Pandolfi J. M., Connolly S. R., Marshall D. J. & Cohen A. L., 2011. Projecting coral reef futures under global warming and ocean acidification. Science 333 (6041), 418-422.
Parvinen K., 2005. Evolutionary suicide. Acta biotheoretica 53 (3), 241-264.
Petchey O. L., Beckerman A. P., Riede J. O. & Warren P. H., 2008. Size, foraging, and food web structure. Proceedings of the National Academy of Sciences 105 (11), 4191-4196.
Phillimore A. B., Hadfield J. D., Jones O. R. & Smithers R. J., 2010. Differences in spawning date between populations of common frog reveal local adaptation. Proceedings of the National Academy of Sciences (18), 8292-8297.
Phillips B. L., Brown G. P., Webb J. K. & Shine R., 2006. Invasion and the evolution of speed in toads. Nature, 439 (7078), 803-803.
Phillips B. L, & Shine R., 2004. Adapting to an invasive species: toxic cane toads induce morphological change in Australian snakes. Proceedings of the National Academy of Sciences 101 (49), 17150-17155.
Potts S. G., Biesmeijer J. C., Kremen C., Neumann P., Schweiger O. & Kunin W. E., 2010. Global pollinator declines: trends, impacts and drivers. Trends in ecology & evolution 25 (6), 345-353.
- Rankin D. & López Sepulcre A., 2005. Can adaptation lead to extinction? Oikos, 111 (3), 616-619.
Rohr R. P. & Loeuille N., 2023. Effects of evolution on niche displacement and emergent population properties, a discussion on optimality. Oikos, in press.
Sheridan J. A. & Bickford D., 2011. Shrinking body size as an ecological response to climate change. Nature climate change, 1(8), 401-406.
Shine R., Brown G. P. & Phillips B. L., 2011. An evolutionary process that assembles phenotypes through space rather than through time. Proceedings of the National Academy of Sciences 108 (14), 5708-5711.
Sterner R.W. & Elser J.J., 2003. Ecological Stoichiometry. Princeton University Press.
Van der Wal E., Garant D., Festa-Bianchet M. & Pelletier F., 2012. Evolutionary rescue in vertebrates: evidence, applications and uncertainty. Philosophical Transactions of the Royal Society B: Biological Sciences 368 (1610), 20120090.
Weinbach A., Allhoff K. T., Thébault E., Massol F. & Loeuille N., 2017. Selective effects of temperature on body mass depend on trophic interactions and network position. BioRxiv, 233742.
Weinbach A., Loeuille N. & Rohr R. P., 2022. Eco-evolutionary dynamics further weakens mutualistic interaction and coexistence under population decline. Evolutionary Ecology 36 (3), 373-387.
Wootton J. T., 1994. The nature and consequences of indirect effects in ecological communities. Annual review of ecology and systematics 25 (1), 443-466.
Wright I. J., Reich P. B. et al., 2004. The worldwide leaf economics spectrum. Nature 428 (6985), 821-827.
Yacine Y., Allhoff K. T., Weinbach A. & Loeuille N., 2021. Collapse and rescue of evolutionary food webs under global warming. Journal of Animal Ecology 90 (3), 710-722.
Yodzis P., 1998. Local trophodynamics and the interaction of marine mammals and fisheries in the Benguela ecosystem. Journal of Animal Ecology 67 (4), 635-658.
Yodzis P. & Innes S., 1992. Body size and consumer-resource dynamics. The American Naturalist 139 (6), 1151-1175.
Regards connexes
Regards sur l’évolution : https://sfecologie.org/tag/evolution/
Regards sur ll’adaptation : https://sfecologie.org/tag/adaptation/
Regards sur les interactions entre espèces : https://sfecologie.org/tag/interactions/
Regards sur les changements globaux : https://sfecologie.org/tag/societes/
Regards sur les mécanismes : https://sfecologie.org/tag/mecanismes/
——
Regard édité et mis en ligne par Anne Teyssèdre.
——-


Bonjour,
Merci beaucoup pour cet article qui m’a notamment permis de mieux comprendre les diverses conséquences de l’évolution rapide d’une population suite à une perturbation, en intégrant cela à l’échelle d’un écosystème.
Je souhaiterais toutefois faire une critique mineure : la citation de Baker (1967) que vous utilisez comme référence de ‘travaux empiriques [qui] ont montré une tendance à l’évolution rapide des plantes quand les pollinisateurs viennent à manquer’ me semble un peu abusive. En effet, de ce que j’ai compris des travaux de Kalisz et al. 2004 et Bobdyl-Roels & Kelly 2011 que vous citez sur le même plan, c’est que dans ces deux derniers cas, il s’agit d’expériences d’évolution expérimentale sur deux espèces d’angiosperme dans une situation de diminution des services de pollinisation qui montrent une augmentation du taux d’autofécondation, en réponse à cette pression de sélection sur plusieurs générations.
Ce n’est pas le cas de Baker (1967) que je comprends comme un commentaire d’un article plus ancien (Baker 1955) qui présente surtout un débat quant à la validité des hypothèses émises pour expliquer une apparente grande proportion d’espèces de la flore insulaire d’Hawaï qui sont dioïques (et donc incompatibles) ; alors que ‘la loi de Baker’ suggère que l’auto-compatibilité donne une assurance de reproduction qui pourrait être sélectionnée lors de la dispersion à longue-distance (corrélée à une perte du service de pollinisation).
En bref, il ne me semble pas que Baker (1967) puisse être vraiment vu comme un travail empirique documentant l’évolution rapide des plantes en réponse à une diminution de la pollinisation, mais serait plutôt à voir comme une compilation d’observations qualitatives dans des situations où ce postulat pourrait s’appliquer …
Bonjour Célia,
Un grand merci pour ton commentaire.
Tout d’abord un éclaircissement, L’article de Bodbyl-Roels & Kelly relève bien de l’évolution expérimentale, tout comme l’article de Gervasi & Schielst, et je considère ces deux travaux comme les mieux liés aux propos du modèle présenté ici. L’article de Kalisz et al. est en fait une étude de populations naturelles, très proche des idées d’assurance de reproduction de Baker, telles que tu les énonces à la fin de ton commentaire.
Je suis désolé que tu trouves mon utilisation de l’article de Baker abusive. Il me semble pourtant que nous voyons les choses de la même façon. Comme tu le dis à la fin de ton commentaire, dans le cadre de la loi de Baker, une perte de pollinisateurs confère un avantage aux phénotypes présentant une assurance de reproduction sans ceux ci (auto-incompatibilité). Baker identifie donc une pression de sélection naturelle allant dans un sens qualitativement identique à celui qui est proposé ici. D’ailleurs, l’article de Baker est utilisé en lien direct avec ces phénomènes évolutifs dans plusieurs articles que j’ai pu lire (voir par exemple l’introduction de Bodbyl-Roels & Kelly).
Bien sincèrement,
Nicolas Loeuille