La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce Regard de Violaine Llaurens et Sylvain Billiard, respectivement Directrice de recherche au Collège de France et Professeur à l’Université de Lille, sur l’écologie et l’évolution du mutualisme.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
——-
Le mutualisme (illustré par le mimétisme),
deux visions contrastées
à la frontière entre écologie et évolution
par Violaine Llaurens1 et Sylvain Billiard2
1 Directrice de recherche au Centre Interdisciplinaire de Recherche en Biologie (UMR 7241, Collège de France/CNRS/INSERM), Collège de France, et à l’Institut de Systématique, Evolution et Biodiversité (UMR 7205 CNRS/MNHN/SU/EPHE/UA), Muséum National d’Histoire Naturelle, Paris.
Lauréate du Prix Recherche de la SFE2 en 2025.
2 Professeur à l’Université de Lille, UMR Evo-Eco-Paleo (UMR CNRS 8198)
Regard R130, édité par Anne Teyssèdre
——-
Mots clefs : mutualisme, mimétisme, prédation, communautés, populations, papillons, oiseaux, traits de vie, signaux visuels, défense chimique, évolution, densité-dépendance, spéciation, niveaux d’organisation
——-
- Introduction/résumé
- Le mimétisme müllerien : un exemple historique de mutualisme particulièrement visuel
- Bonne ou mauvaise rencontre ? Tout dépend du moment
- Débrouillards et tricheurs
- La vie en communauté
- Et l’évolution dans tout ça?
- Zoomer ou dézoomer : les échelles changeantes du mutualisme
- Conclusion
- Glossaire
- Bibliographie
- Remerciements
- Forum de discussion
——
Introduction/résumé
Les relations dites mutualistes entre les individus de différentes espèces sont largement répandues dans tous les écosystèmes (Bronstein 2015). Elles sont généralement définies comme des interactions écologiques entre individus de deux espèces différentes augmentant la capacité de survie et/ou de reproduction des dits individus. Pourtant, dans le domaine de l’écologie comme celui de l’évolution, elles sont bien moins étudiées que d’autres types d’interactions comme la compétition par exemple (Raerinne 2023). De nombreuses questions restent ouvertes sur l’évolution des interactions mutualistes et nous souhaitons y apporter un regard à différentes échelles, des individus aux espèces, pour montrer (1) comment la variation des traits au sein des espèces peut influencer la nature des interactions écologiques le long du continuum mutualiste-parasite et (2) comment les interactions qualifiées de mutualistes modifient la composition des communautés* biologiques et la diversification des traits et des espèces à l’échelle macro-évolutive. Nous décortiquons les coûts/bénéfices associés à des interactions mutualistes à différentes échelles, en prenant le mimétisme müllerien au sein de communauté d’espèces de proies comme illustration.
Le mimétisme müllerien : un exemple historique de mutualisme particulièrement visuel
Un papillon rouge et noir volète tranquillement autour d’une fleur, sans se préoccuper outre mesure de l’oiseau insectivore qui l’observe. Au-delà de la coloration bien visible de ses ailes, ce papillon possède en effet des composés chimiques au goût désagréable pour les oiseaux (Muhtasib & Evans 1987). Mais comment se fait-il que l’oiseau qui l’observe sache que ce papillon n’est pas un appétissant goûter ? Probablement car cet oiseau a déjà testé un autre papillon, d’apparence rouge et noir similaire, et fait l’expérience de son goût répugnant ! Ainsi, quand plusieurs individus ont à la fois une même apparence visuelle et une saveur répulsive, l’apprentissage par les oiseaux limite fortement leur probabilité d’être attaqués ! Ce phénomène, appelé mimétisme müllerien (Müller 1879), est une forme de mutualisme entre les proies d’apparence similaire, généré par le comportement des prédateurs (Figure 1A). Cette forme de sélection par les prédateurs a un impact majeur à la fois sur i) la composition des communautés naturelles, différentes espèces toxiques d’apparences similaires étant observées plus fréquemment en sympatrie* qu’attendu du fait de leur niveau d’apparentement phylogénétique (Doré et al. 2023) et ii) l’évolution convergente de motifs de colorations entre espèces phylogénétiquement très distantes (Puissant et al. 2023).
Le mimétisme müllerien, décrit dès le XIXème siècle comme un exemple de mutualisme, bénéficie de son caractère visuel : il suffit d’observer des espèces aux colorations bien voyantes, vivant en sympatrie et dont on soupçonne la toxicité pour conclure à des bénéfices réciproques. Néanmoins, dès les premières descriptions de ce phénomène, Müller souligne que les bénéfices réciproques de ce mimétisme ne se produisent qu’à partir du moment où un certain nombre d’individus, soumis aux mêmes prédateurs, vivent dans la même localité. Il faut en effet que la plupart des prédateurs (dotés de vision des couleurs, comme le sont les oiseaux) aient déjà fait l’expérience des proies toxiques arborant la même coloration pour que la protection envers ce type de proie se mette en place (Figure 1B). La sélection exercée par les prédateurs sur l’évolution des motifs de coloration dépend donc fortement de la densité locale des proies colorées (Joron & Mallet 1998; on parle alors de sélection « densité-dépendante »). On voit ainsi émerger de nombreuses questions sur l’échelle à laquelle peut être considéré le mutualisme, de l’individu à la communauté d’espèce.
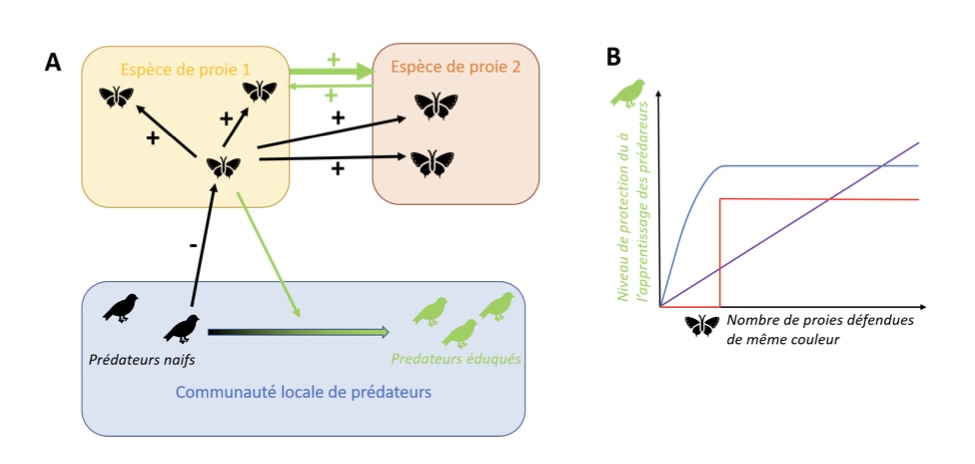
Figure 1 : Le mimétisme müllerien : une forme de mutualisme dépendant de l’apprentissage par les prédateurs.
A : Le mimétisme müllerien est une interaction mutualiste entre plusieurs espèces de proies possédant des défenses, qui dépend de la communauté de prédateurs. Lorsqu’un prédateur initialement naïf goûte une proie (ici par exemple appartenant à l’espèce 1), il peut apprendre à associer l’expérience visuelle de la proie avec l’expérience gustative désagréable qu’il vient d’avoir et devenir un prédateur éduqué (devenant vert sur le schéma). Le coût payé par cette première proie dû à la tentative d’attaque par le prédateur aura un impact positif sur l’ensemble des autres proies de même apparence, au sein de son espèce (ici, espèce 1) mais aussi d’autres espèces (ici, espèce 2). Cet apprentissage par les prédateurs génère ainsi une relation mutualiste entre les espèces 1 et 2, car chaque individu des deux espèces peut contribuer à l’éducation des prédateurs au fil des rencontres. Néanmoins, si l’espèce 1 est plus abondante localement que l’espèce 2, il y aura en moyenne un effet positif plus important de l’espèce 1 sur l’espèce 2 que l’inverse (d’où la différence d’épaisseur des flèches vertes reliant les espèces 1 et 2), en supposant que le niveau de défense de chaque individu est le même, quelle que soit son espèce.
B : Le niveau de protection contre la prédation dont bénéficie chacune des proies mimétiques dépend positivement de l’abondance locale des proies. Dans la formalisation initiale de Müller (1879), un nombre seuil de proies doit être attaqué avant que le bénéfice en survie n’existe, le bénéfice est constant quelle que soit la densité, comme montré par la courbe rouge. D’autres auteurs ont depuis proposé un avantage qui dépendrait linéairement de la fréquence des proies défendues au sein de la communauté (Turner & Speed 1996), schématisé par la courbe violette). Des expérimentations en populations naturelles (Chouteau et al. 2016) suggèrent plutôt une augmentation progressive de l’avantage en survie de proies en fonction de leur densité mais qui plafonnerait au-delà d’une certaine abondance locale, comme représenté par la courbe bleue.
Bonne ou mauvaise rencontre ? Tout dépend du moment
Même dans une localité où l’abondance de différentes espèces mimétiques est grande, les bénéfices que tirera un individu de la relation mutualiste avec un autre individu varient en fonction des interactions entre proies mimétiques et prédateurs. Par exemple, dans les milieux où il existe une forte saisonnalité et donc où l’abondance des prédateurs naïfs, tels que les jeunes oiseaux, varie fortement au cours de l’année, des expériences menées sur le terrain ont montré que l’avantage en survie, pour une proie toxique, de présenter une coloration mimétique, était faible dans la période d’émergence des oiseaux juvéniles et fort dans les périodes suivantes (Mappes, et al. 2014). Ainsi pour un même individu portant un motif coloré fréquent localement, l’avantage dû au mutualisme dépend de la date de sa rencontre avec le prédateur : un même individu peut donc, au cours de sa vie, faire de bonnes ou de mauvaises rencontres avec le même prédateur.
Cette observation a des conséquences directes sur la dynamique des populations des différentes espèces de proies potentiellement impliquées dans des relations mutualistes, puisque la probabilité de survie associée au mutualisme entre espèces de proies est variable temporellement pour un même individu au cours de sa vie. Cette variation des avantages individuels en termes de survie associés au mutualisme pose aussi la question de l’origine évolutive du mutualisme, étant donné qu’il y a un coût initialement fort à porter une couleur vive plus détectable par les prédateurs, qui n’apportera des bénéfices substantiels que lorsque le nombre d’individus arborant cette même couleur sera suffisamment grand.
Débrouillards et tricheurs
Dans les communautés d’espèces mimétiques, appelées aussi cercles mimétiques*, il existe de grandes variations des composés répulsifs pour les prédateurs au sein et entre espèces (Arias et al. 2016). Chez le Papillon Heliconius erato, on observe ainsi des individus dépourvus d’une concentration détectable en glucosides cyanogènes, des composés chimiques conférant un goût amer, tandis que d’autres individus montrent une quantité significative de ces composés pouvant déclencher un évitement par les oiseaux (Chouteau et al. 2019). Les individus dépourvus de défenses chimiques (i.e., non toxiques) mais arborant les mêmes motifs de couleur que les individus toxiques, bénéficient donc de la ressemblance visuelle avec des proies répulsives mais ne participent pas eux-mêmes à « l’éducation » (formation par apprentissage) des prédateurs. Pire encore, leur présence dans la communauté peut limiter le nombre de prédateurs expérimentés, habitués à éviter les proies dotées du même motif coloré. Ces individus dépourvus de défenses ne sont alors plus dans une relation mutualiste vis-à-vis des individus toxiques portant le même motif coloré, mais dans une relation parasitaire, puisqu’ils en retirent des bénéfices tout en engendrant des coûts pour l’ensemble des autres proies mimétiques.
A cette échelle individuelle, il s’agit clairement d’une interaction parasitaire. Il n’en reste pas moins qu’à l’échelle des populations, les espèces mimétiques H. erato et H. melpomene sont considérées comme impliquées dans une relation mutualiste, même si la concentration moyenne en toxine est supérieure chez H. melpomene par rapport à H. erato. Dans la plupart des communautés naturelles où ces deux espèces co-existent, l’abondance de l’espèce H. erato est en effet bien supérieure à celle de H. melpomene : ainsi même si l’effet répulsif engendré par un individu H. erato est plus faible que pour un individu de l’espèce H. melpomene, la forte abondance locale de H. erato diminue tout de même fortement le risque de prédation pour tous les individus de l’espèce H. melpomene présents dans cette communauté. La présence au sein de la même communauté de l’espèce mimétique alternative engendre donc à l’échelle de la population, en moyenne, des bénéfices réciproques sur la survie.
Fig.2, A et B. Clichés de deux espèces de papillons (américains) héliconidés, mimétiques et mutualistes.
Fig.2A (à gauche): L’espèce fortement toxique Heliconius melpomene (« common postman » aux USA). Cliché D. Gordon E. Robertson, CC BY-SA 3.0. Fig.2B (à droite) : Accouplement de deux H. erato, de moindre toxicité. Cliché Tobias Pauk, CC BY-SA 2.0.
A l’autre extrême du continuum du niveau de défense chimique, l’effet répulsif chez certaines espèces de certains composés chimiques permet une augmentation importante de la survie en cas d’attaque – le prédateur relâchant immédiatement sa proie, sans lui faire de dommage, conférant ainsi un effet direct sur la survie individuelle. L’apprentissage par les prédateurs confère quant à lui un avantage supplémentaire, cette fois indirect, sur la survie des proies potentielles, en limitant la probabilité d’attaque. L’effet de la présence d’une autre espèce toxique, dont les individus participent aussi à l’apprentissage des prédateurs, peut avoir un effet indirect négligeable par rapport à l’effet direct de la forte répulsion liée à l’ingestion d’individus appartenant à une espèce au goût très désagréable.
Selon les variations des niveaux de défense chimique entre les espèces mimétiques, et selon la dynamique démographique locale des populations de ces espèces mimétiques, l’impact de la présence d’une espèce sur le maintien des autres espèces mimétiques au sein des mêmes localités ne sera pas forcément le même. Caractériser les abondances relatives des espèces potentiellement impliquées dans une relation mutualiste, ainsi que l’effet de ces abondances relatives sur la dynamique de leurs populations respectives, est crucial pour comprendre la nature de la relation écologique et l’impact sur la stabilité de l’écosystème. Pourtant, ce type de données est encore actuellement très rarement disponible pour la majorité des relations dites mutualistes étudiées en écologie.
La vie en communauté
Nous venons de voir l’importance des abondances relatives des espèces impliquées dans de mutualisme, mais la composition des communautés d’espèces vivant avec ces espèces a aussi un effet important sur l’émergence et le maintien du mutualisme. Par exemple la structuration spatiale ou en micro-habitat des communautés de prédateurs affecte fortement la distribution des cercles mimétiques de proies (Willmott et al. 2017). De plus, la disponibilité en proies alternatives aux proies répulsives impliquées dans des relations mutualistes conditionne l’avantage en survie conférée par le mutualisme : des prédateurs désespérément affamés sont en effet beaucoup plus enclins à ignorer le goût désagréable d’une proie, ce qui limite les bénéfices réciproques conférés par le mimétisme entre espèces de proies toxiques (Aubier & Sherratt 2020). La dynamique des populations locales des espèces de prédateurs et de proies alternatives, qui peuvent par exemple avoir des temps de génération et des saisonnalités différentes, modifie fortement les avantages individuels en survie des individus des espèces mimétiques. Le mutualisme entre espèces de proies s’avère ainsi fortement contexte-dépendant, et s’inscrivant au sein de communautés composées de nombreuses autres espèces dont l’abondance peut varier dans le temps.
Fig 3 : Variantes géographiques (sous-espèces) de deux espèces mimétiques toxiques d’Heliconidés, Heliconius melpomene (en haut) et H. erato (en bas). Source : Meyer A, 2006. PLoS Biology 4/10, e341 doi:10.1371/journal.pbio.0040341 CC BY 2.5
Et l’évolution dans tout ça ?
En plus de la dynamique démographique des différentes espèces impliquées dans le mutualisme, l’évolution des traits au sein des espèces peut également modifier les coûts et bénéfices associés aux interactions écologiques entre individus de différentes espèces. Comme évoqué précédemment, certains individus d’une espèce de proie mimétique peuvent être considérés comme des tricheurs puisqu’ils ne produisent pas le composé chimique répulsif tout en bénéficiant de la protection communautaire. Les variations au sein des espèces ne sont certes pas nécessairement aussi drastiques mais elles sont bien présentes et susceptibles d’être la cible de la sélection naturelle. Chez les papillons possèdant des défenses chimiques, l’évolution de la capacité à synthétiser des composés toxiques ou à les séquestrer à partir de plantes par exemple (Sculfort et al. 2021) peut transformer une relation mutualiste en parasitaire et vice et versa.
A l’inverse, l’existence d’interactions mutualistes influe fortement sur l’évolution des traits au sein des espèces, l’évolution des motifs de coloration dans une espèce agissant sur l’évolution des autres espèces mimétiques. Il existe ainsi des boucles de rétroaction entre la démographie et l’évolution des traits au sein des espèces, d’une part, et les relations écologiques entre les espèces partageant les mêmes habitats (i.e. vivant en sympatrie*), d’autre part. A l’échelle macro-évolutive, tenir compte des assemblages de communautés locales semble crucial pour comprendre les facteurs agissant sur la diversification des traits. A l’inverse, dans le domaine de l’écologie des communautés, prendre en compte l’histoire évolutive des espèces constituant les communautés et l’évolution de leurs traits respectifs est nécessaire pour comprendre la dynamique des écosystèmes.
Une question encore très largement ouverte est celle de l’impact des relations mutualistes sur la diversification des espèces. Dans le cas du mimétisme müllerien, on observe des variations des cercles mimétiques en fonction des régions géographiques et des micro-habitats et il est parfois supposé qu’un changement de coloration au sein d’une population, en générant une ressemblance à un cercle mimétique alternatif, pourrait favoriser la divergence des individus arborant cette nouvelle coloration par rapport à leur population ancestrale (Merrill et al. 2012). Les motifs mimétiques sont en effet qualifiés par certains auteurs comme des traits magiques pour la spéciation car leurs variations impliquent à la fois une adaptation écologique nouvelle et un changement de préférence sexuelle. Chez les papillons mimétiques par exemple, il a été observé des préférences sexuelles des mâles pour des femelles portant les mêmes motifs de couleur qu’eux-mêmes (préférence dite homogame*). Ainsi, lorsqu’un changement de couleur des ailes aboutit à un mimétisme envers d’autres espèces et à des accouplements privilégiés entre individus ayant ce nouveau motif, cela peut fortement promouvoir la divergence de la population des individus ayant le nouveau motif par rapport aux individus arborant le motif ancestral.
En considérant cette hypothèse dans un contexte spatial, un modèle d’évolution prédit ainsi une mosaïque géographique avec localement des communautés d’espèces mimétiques et des variations entre les régions géographiques (Aubier et al. 2017). Les relations mutualistes confèreraient ainsi une nouvelle dimension à la niche écologique des espèces dans la mesure où l’adaptation de différents cercles mimétiques influencerait le processus de diversification des espèces et leur co-existence en sympatrie*. Certains auteurs évoquent ainsi l’effet de la diversification des motifs mimétiques sur l’accélération des taux de spéciation dans certains clades* sein d’une même région géographique (Kozac et al. 2015). Cette idée, si elle semble relativement intuitive pour bon nombre de relations mutualistes, n’en reste pas moins peu testée, constituant une piste de recherche importante à la frontière entre écologie et évolution.
Fig. 4 : Divergence géographique et convergence évolutive mimétique chez les papillons (nymphalidés). Schéma phylogénétique montrant i) la différentiation morphologique de sous-espèces géographiques de papillons héliconinés (du genre Heliconius) et ithomiinés (du genre Melinae), mais aussi ii) leur coévolution mimétique (convergence) en sympatrie*. Source : Mathieu Joron, in : Joron M, et al. (2006), A conserved supergene locus controls colour pattern diversity in Heliconius butterflies. PLoS Biology: 4(10): e303. DOI: 10.1371/journal.pbio.0040303
Zoomer ou dézoomer : Les échelles changeantes du mutualisme
Souvent dans les sciences de la biodiversité, analyser un phénomène nécessite de le regarder à de nombreuses échelles, aussi bien temporelles que spatiales ou organisationnelles. Rares sont les cas où les études couvrent l’ensemble de ces échelles. Le mutualisme ne fait pas exception. Le mimétisme müllérien est un des rares cas étudiés et documentés, depuis l’identité des gènes impliqués dans les colorations mimétiques jusqu’à la dynamique des communautés* d’espèces mimétiques et leur macroévolution. Malgré cela, de nombreuses zones d’ombre persistent, comme par exemple la dynamique des populations en milieux naturels, ou plus simplement encore une estimation des abondances relatives de toutes les espèces impliquées dans un cercle mimétique local. Les passages entre échelles micro et macro évolutives sont aussi parfois limités. Dans de nombreuses espèces possédant des défenses chimiques, on observe fréquemment le maintien de plusieurs motifs mimétiques au sein mêmes des espèces ; cela remet en question l’effet de l’évolution de ces traits sur la spéciation, soulignant un certain découplage entre évolution des traits des individus et diversification des espèces (Chazot et al. 2025).
Cette nécessité de passer d’une échelle à l’autre, dans le cas du mutualisme par exemple, révèle également une difficulté épistémologique et méthodologique. Le mutualisme est explicitement défini à l’échelle des individus, il est d’ailleurs expérimentalement mesuré à cette échelle, comme par exemple lorsque sont comparés les taux d’attaque sur les proies mimétiques par des prédateurs dans différents contextes. Mais alors de quoi parle-t-on lorsque l’on parle de mutualisme à d’autres échelles ? Que sont des espèces mutualistes, des relations mutualistes, des communautés ou des réseaux d’interaction mutualistes, et comment les observer ? Que veut dire étudier le mutualisme à des échelles macro-évolutives ? Ces questions sont loin d’être résolues.
Conclusion
Qu’on se rassure : le mutualisme n’est pas le seul phénomène écologique dont l’intégration à différentes échelles apparaît ardue. Ce qui rend peut-être le mutualisme particulier, c’est qu’il est difficile de se départir à son sujet de nombreux a priori et anthropomorphismes (Raerinne 2023), qui le rendent particulièrement sensible à différents types de biais : méthodologiques, de perception, ou idéologiques. Par exemple il est loin d’être évident d’expliquer pourquoi, comme certains auteurs le proposent (Zeng & Wiens 2021), le mutualisme devrait être plus stable à l’échelle macro-évolutive que d’autres types d’interaction.
Glossaire
- Clade : groupe d’espèces apparentées issues d’une même lignée évolutive et comprenant tous les membres (disparus et actuels) de cette lignée.
- Communauté (biologique) : ensemble des individus d ’espèces biologiques apparentées, ou d’écologie similaire, observés dans une même localité. Exemples : communauté de papillons de Madagascar, communauté de bactéries d’un biofilm …
- Cercle mimétique : ensemble (de populations) d’espèces, partageant les mêmes motifs et observés dans la même localité. Les différents individus du cercle mimétique font face à la même communauté d’espèces prédatrices.
- Homogamie : accouplement préférentiel entre individus partageant un même trait (par exemple ici une même couleur).
- Sympatrie : partage d’une même aire géographique par plusieurs espèces. Ainsi des espèces sympatriques sont observées au sein d’une même localité.
Bibliographie
- Arias, M., Meichanetzoglou, A., Elias, M., Rosser, N., De-Silva, D. L., Nay, B., & Llaurens, V. (2016). Variation in cyanogenic compounds concentration within a Heliconius butterfly community: does mimicry explain everything?. BMC evolutionary biology, 16(1), 272.
- Aubier, T. G., Elias, M., Llaurens, V., & Chazot, N. (2017). Mutualistic mimicry enhances species diversification through spatial segregation and extension of the ecological niche space. Evolution, 71(4), 826-844.
- Aubier, T. G., & Sherratt, T. N. (2020). State-dependent decision-making by predators and its consequences for mimicry. The American Naturalist, 196(5), E127-E144.
- Chazot, N., Braga, M. P., Aubier, T. G., Llaurens, V., Willmott, K. R., & Elias, M. (2025). Bending the Course of Evolution: How Mutualistic Interactions Affect Macroevolutionary Dynamics of Diversification in Mimetic Ithomiini Butterflies. The American Naturalist, 206(1), 000-000.
- Chouteau, M., Arias, M., & Joron, M. (2016). Warning signals are under positive frequency-dependent selection in nature. Proceedings of the national Academy of Sciences, 113(8), 2164-2169.
- Chouteau, M., Dezeure, J., Sherratt, T. N., Llaurens, V., & Joron, M. (2019). Similar predator aversion for natural prey with diverse toxicity levels. Animal Behaviour, 153, 49-59.
- Doré, M., Willmott, K., Lavergne, S., Chazot, N., Freitas, A. V., Fontaine, C., & Elias, M. (2023). Mutualistic interactions shape global spatial congruence and climatic niche evolution in Neotropical mimetic butterflies. Ecology Letters, 26(6), 843-857.
- Joron, M., & Mallet, J. L. (1998). Diversity in mimicry: paradox or paradigm?. Trends in ecology & evolution, 13(11), 461-466.
- Kozak, K. M., Wahlberg, N., Neild, A. F., Dasmahapatra, K. K., Mallet, J., & Jiggins, C. D. (2015). Multilocus species trees show the recent adaptive radiation of the mimetic Heliconius butterflies. Systematic biology, 64(3), 505-524.
Mappes, J., Kokko, H., Ojala, K., & Lindström, L. (2014). Seasonal changes in predator community switch the direction of selection for prey defences. Nature communications, 5(1), 5016. - Merrill, R. M., Wallbank, R. W., Bull, V., Salazar, P. C., Mallet, J., Stevens, M., & Jiggins, C. D. (2012). Disruptive ecological selection on a mating cue. Proceedings of the Royal Society B: Biological Sciences, 279(1749), 4907-4913.
- Muhtasib, H., & Evans, D. L. (1987). Linamarin and histamine in the defense of adult Zygaena filipendulae. Journal of chemical ecology, 13(1), 133-142.
- Müller, F. (1879). Ituna and Thyridia: a remarkable case of mimicry in butterflies. Trans. Entomol. Soc. Lond, 1879, 20-29.
- Puissant, A., Chotard, A., Condamine, F. L., & Llaurens, V. (2023). Convergence in sympatric swallowtail butterflies reveals ecological interactions as a key driver of worldwide trait diversification. Proceedings of the National Academy of Sciences, 120(37), e2303060120.Raerinne, J. (2023). Myths of past biases and progress in biology. Theory in Biosciences, 142(4), 383-399.
- Sculfort, O., McClure, M., Nay, B., Elias, M., & Llaurens, V. (2021). Assessing the role of developmental and environmental factors in chemical defence variation in Heliconiini Butterflies. Journal of Chemical Ecology, 47(6), 577-587.Turner, J. R. G., &
- Speed, M. P. (1996). Learning and memory in mimicry. I. Simulations of laboratory experiments. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 351(1344), 1157-1170.
- Willmott, K. R., Robinson Willmott, J. C., Elias, M., & Jiggins, C. D. (2017). Maintaining mimicry diversity: optimal warning colour patterns differ among microhabitats in Amazonian clearwing butterflies. Proceedings of the Royal Society B: Biological Sciences, 284(1855), 20170744.
- Zeng, Y., & Wiens, J. J. (2021). Do mutualistic interactions last longer than antagonistic interactions?. Proceedings of the Royal Society B, 288(1958), 20211457.
Pour en savoir plus :
Articles de vulgarisation sur l’évolution de la coloration chez les papillons
- https://www.encyclopedie-environnement.org/vivant/pourquoi-papillons-colores/
- https://www.mnhn.fr/fr/les-papillons-morpho-nous-apprennent-comment-marche-l-evolution
Films de vulgarisation sur l’évolution de la coloration chez les papillons et leurs bases génétiques
Remerciements
Nous tenons à remercier nos équipes respectives, nos collaborateurs et collaboratrices, nos étudiants et étudiantes, la recherche étant un travail éminemment collectif. C’est grâce au dialogue au sein et entre les communautés scientifiques que la connaissance peut progresser. Nous remercions aussi Anne Teyssèdre, éditrice de ce Regard, pour ses remarques et suggestions.
—–
Edition, iconographie et mise en ligne : Anne Teyssèdre.

Bonjour Violaine et Sylvain,
et merci pour ce Regard perçant sur l’écologie et l’évolution du mutualisme, illustré ici entre espèces-proies (de papillons) plus ou moins toxiques. Ma question porte sur l’une des étapes de l’évolution de ce mutualisme, celle du mimétisme (müllerien ou batésien) au sein des communautés de papillons proies potentielles.
Parmi mes suggestions sur la première version du texte, il en est une -seule 🙂- que vous n’avez pas retenue. Face à la répétition multiple de la proposition « les papillons (toxiques) arborent un motif coloré (semblable) », je vous ai suggéré de recourir au registre de la communication (interspécifique, entre proies éventuelles et prédateurs), c’est-à-dire de remplacer une bonne partie des occurrences de cette phrase par des variantes du type : « les papillons signalent leur toxicité (éventuelle) par un motif coloré semblable ».
Mais cette suggestion n’a pas été retenue. Ma question est donc : sachant que l’évolution du mimétisme coloré chez les papillons est fondée sur la communication visuelle (non intentionnelle) entre ceux-ci et leurs prédateurs dotés de vision des couleurs, pourquoi écarter toute mention à (l’évolution) des signaux de communication (signaux dits d’avertissement, ‘honnêtes’ ou ‘trompeurs’) dans cet article sur le mutualisme et le mimétisme des papillons ?
Bien cordialement,
Anne
[Voir par exemple à ce sujet : « The Evolution of Animal Communication – Reliability and Deception in Signaling Systems » de W.A. Searcy & S. Nowicki, Princeton Univ. Press, 2005.
Ou ce livre (mien) de vulgarisation scientifique : « La Communication animale sur la scène de l’évolution », A. Teyssèdre, Nathan 1993. 2e édition : « Les clefs de la communication animale », Delachaux et Niestlé, 2010). ]
Bonjour,
La coévolution entre (1) les motifs de coloration aposématique ou cryptique et (2) les perceptions visuelles des conspecifiques ou des prédateurs fait l’objet d’un champ de recherche riche comme vous le mentionnez, et que nous invitons les lecteurs à explorer. Mais cette question n’était pas au centre de notre réflexion pour cet article, qui visait plus spécifiquement à mettre en évidence les difficultés dans la caractérisation des interactions mutualistes, à différentes échelles, de l’individu à la communauté.