La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce Regard R99 de Cendrine Mony, Philippe Vandenkoornhuyse et Claire Ricono, respectivement enseignants-chercheurs et doctorante en écologie à l’Université de Rennes, sur les interactions entre plantes et micro-organismes en agriculture.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
——-
Diversité des plantes et microorganismes
dans les agrosystèmes
Cendrine Mony(1), Claire Ricono(2) et Philippe Vandenkoornhuyse(3)
(1) Maître de conférences en écologie du paysage au laboratoire ECOBIO,
Rennes (UMR 6553), Prix SFE2 de la Recherche en 2020
(2) Doctorante en écologie microbienne au laboratoire ECOBIO
(3) Professeur en écologie microbienne et évolutive au laboratoire ECOBIO
Regard R99, édité par Anne Teyssèdre
——-
Mots clés : Interactions plantes-microorganismes, agriculture, agrosystèmes, microbiotes, hétérogénéité spatiale, préférence d’hôte, services écosystémiques, transitions agroécologiques
——–
- Résumé
- Introduction
- Les règles d’assemblage des organismes associés à une plante
- Effets de la diversité végétale sur les communautés de microorganismes
- L’influence de la diversité floristique à l’échelle locale et paysagère
- La diversité végétale, un levier pour l’agriculture de demain ?
- Glossaire
- Remerciements
- Bibliographie
- Regards connexes
- Forum de discussion sur ce regard
——
Résumé
Ce regard souligne l’importance de la diversité à toutes les échelles, de l’intra-parcelle à l’inter-parcelle (paysage), comme moyen pour préserver la diversité des microorganismes associés aux plantes. En raison de l’association préférentielle de certains microorganismes avec certaines plantes-hôtes, il est attendu que la diversité des plantes, qu’elle soit entre individus (diversité génotypique) ou entre espèces (diversité spécifique), ait une influence sur les microorganismes associés. Cette relation peut s’établir tout à la fois à échelle très locale, à celle du voisinage, de la parcelle et même du paysage, même si cette dernière est souvent peu prise en compte.
Introduction
De plus en plus de recherches démontrent le rôle fondamental des microorganismes dans le fonctionnement des agrosystèmes*. En effet, les microorganismes assurent de nombreuses fonctions au sein des écosystèmes, incluant non seulement le recyclage des nutriments mais aussi la nutrition minérale et hydrique des plantes ainsi que leur résistance aux stress environnementaux (Vannier et al., 2015). Les microorganismes colonisent par ailleurs tous les compartiments des plantes, souterrains ou aériens (Figure 1). Des travaux récents alertent sur l’existence de modifications profondes des assemblages de microorganismes du sol, et sur l’appauvrissement de leur diversité, en conséquence de certaines pratiques agricoles (p.ex. Xu et al., 2020), affectant à court terme les services écosystémiques associés tels que la fertilité des sols. La préservation de ces microorganismes, de cette biodiversité invisible représentant pourtant la plus grande proportion des espèces sur terre, est un enjeu clé notamment pour l’agriculture dont elle constitue l’un des piliers.
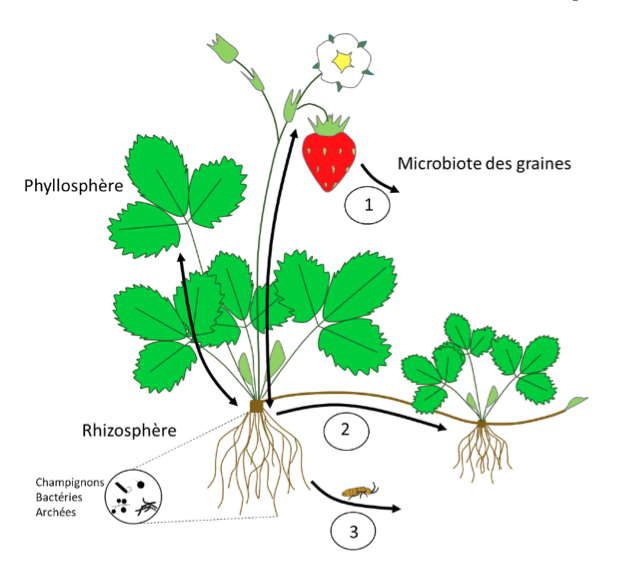
Figure 1 : Plante individuelle et ses microorganismes. Les microorganismes colonisent tous les compartiments de la plante (racine, feuille, tige, fruit). La rhizosphère correspond aux microorganismes associés à la surface extérieure de la racine, tandis que la phyllosphère correspond à ceux associés à la surface extérieure de la feuille. Au sein de chaque organe de la plante, des microorganismes sont aussi présents à l’intérieur des tissus (endosphère). Les flèches noires indiquent les transferts de microorganismes entre compartiments de la plante. Les microorganismes peuvent disperser d’une plante à une autre via les graines (1), par contacts entre racines ou croissance clonale (2), via des vecteurs externes (vent, eau, animaux) (3). (Schéma C. Mony et al.)
Les règles d’assemblage des microorganismes associés à une plante
La compréhension des règles d’assemblage des microorganismes a été au cœur de nombreuses questions de recherche depuis plusieurs années. En effet, ces microorganismes sont distribués de manière hétérogène dans l’espace et ce à différentes échelles spatiales, allant du centimètre carré à celle du paysage. La variabilité spatiale des facteurs locaux abiotiques (par exemple, caractéristiques physico-chimiques des sols), et plus récemment une limitation de la dispersion de ces microorganismes ont été parmi les causes avancées de cette hétérogénéité spatiale observée.
On sait depuis les années 2000 que l’identité de l’hôte influence également la structure des assemblages des microorganismes biotrophes (i.e., se développant en association avec un autre microorganisme, une plante ou un animal). Ainsi, Vandenkoornhuyse et ses collaborateurs ont démontré dès 2003 que les communautés de microorganismes associés aux plantes diffèrent dans leur composition selon l’identité des plantes hôtes, même lorsque celles-ci coexistent au sein d’un même environnement (Vandenkoornhuyse et al., 2003). Cet effet, appelé préférence d’hôte, a été expliqué par l’existence d’interactions fines entre plantes et microorganismes. Ces interactions conditionnent le recrutement des microorganismes constituant le microbiote* des plantes à partir du pool extérieur. Elles mettent en jeu des processus passifs liés à la colonisation des racines selon leur architecture et structure morphologique, et des processus actifs liés aux défenses des plantes, mais aussi à des mécanismes de sélection préférentielle de la plante envers les microorganismes qui lui sont le plus favorables.
Un des exemples les plus marquants concerne les champignons mycorhiziens* : la plante hôte attribue préférentiellement du carbone aux espèces les plus coopératives pour son développement, c’est-à-dire lui fournissant les nutriments nécessaires à sa croissance (Kiers et al. 2011). Ce mécanisme de « récompense » produit un phénomène de sélection ou filtration des espèces dans leur colonisation des racines des plantes. Ce phénomène de préférence d’hôte, interprété ici comme une conséquence de cette allocation préférentielle en carbone, peut ainsi s’observer au niveau du microbiote* associé aux différents compartiments de la plante. Il est également démontré au sein de génotypes différents d’une même espèce de plante. L’étude de Spor et al. (2020) a démontré par exemple une modification de la composition du microbiote racinaire entre cultivars* de blé selon leur histoire de sélection variétale.
Effets de la diversité végétale sur les communautés de microorganismes
Au sein des agrosystèmes*, la diversité végétale peut s’exprimer tant au niveau des gènes dans les populations (diversité génotypique) qu’à celui des espèces (diversité spécifique), via la flore spontanée ou cultivée. Cette diversité peut aussi s’analyser à toutes les échelles spatiales : à l’échelle locale, de quelques mètres à dizaines de mètres (parcelle par exemple), jusqu’à l’échelle du paysage, à quelques centaines de mètres et kilomètres (composition du paysage). Cette diversité peut ainsi conditionner les assemblages de microorganismes présents dans le sol par un effet ‘d’empreinte’ d’une plante sur le pool présent, médiée par le mécanisme de préférence d’hôte évoqué plus haut), mais également par la transmission via la dispersion des microorganismes d’une plante à l’autre (cf. Figure 1).
Cet effet d’empreinte a été montré au sein de systèmes simplifiés, par exemple en étudiant une plante entourée d’autres plantes de nature différente (effet de voisinage vu à l’échelle locale), ou plus rarement en étudiant un patch de végétation entouré de plusieurs autres taches d’habitats (effet de voisinage vu à l’échelle du paysage) (Figure 2). L’identité des plantes voisines influence le microbiote d’une plante cible avec des espèces ayant des effets favorables et d’autres défavorables sur la richesse en espèces de certains groupes de microorganismes (Bittebiere et al., 2019 ; Mony et al., 2020). Dans une étude conduite en conditions contrôlées, nous avons analysé les assemblages de champignons mycorhiziens* à arbuscules colonisant une plante cible, Medicago truncatula, cultivée au sein de 15 conditions différentes de voisinage monospécifique et démontré une variation du simple au double de la richesse spécifique* en champignons selon l’identité de la plante voisine, et notamment sa famille taxonomique d’appartenance (Mony et al., 2021). Cet effet de voisinage peut s’extrapoler à un effet plus global de la diversité en plantes.
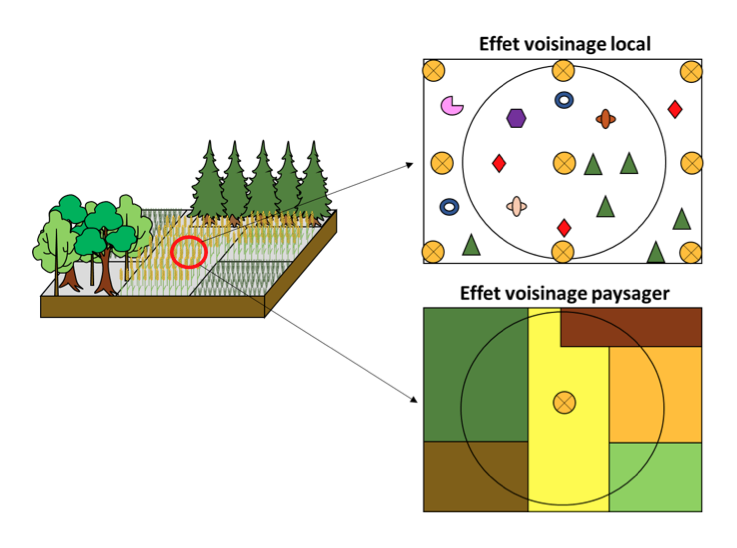
Figure 2 : Schématisation de la diversité à différentes échelles spatiales. La diversité ici se traduit par la richesse et l’abondance relative des espèces/couverts. L’échelle du voisinage local correspond ici à l’influence des adventices du blé (individus représentés par les formes géométriques, différant selon l’espèce) ainsi que des autres pieds de blé sur la plante cible située au centre du cercle (représentés par les ronds jaune barrés d’une croix). Cela peut être des individus de plantes appartenant à la même espèce ou à d’autres espèces, avec éventuellement plusieurs génotypes par espèce. Le voisinage paysager correspond ici à l’influence des différents types de couverts végétaux présents autour de la parcelle de blé (représentés ici par les parcelles de différentes couleurs). Cela peut être des couverts pluri- ou monospécifiques, pluri- ou monogénotypes. (Schéma C. Mony et al.)
La diversité en plantes peut ainsi conduire à des modifications du réservoir de symbiotes présents dans l’environnement et potentiellement recrutables par la plante. Il est notamment attendu une augmentation de la diversité en microorganismes lorsque la richesse spécifique en plantes est forte, et ce en raison de trois mécanismes possibles et non exclusifs : i) l’augmentation de la diversité de niches possibles pour les microorganismes (effet de complémentarité), ii) l’augmentation de la probabilité d’inclure une plante « refuge de diversité microbienne », c’est-à-dire présentant la capacité d’être associée à un grand nombre de microorganismes simultanément (hot-spot de diversité microbienne, effet d’échantillonnage 1) ou encore iii) l’augmentation de la probabilité d’inclure une plante dont le microbiote serait atypique et très différent des autres plantes hôtes (effet d’échantillonnage 2).
La diversité en plantes pourrait par ailleurs agir sur la dispersion des microorganismes d’un individu à un autre. En effet certaines plantes ou tâches de plantes pourraient agir comme facilitatrices de la dispersion (espèces très mycotrophes par exemple, effet facilitateur) tandis que d’autres pourraient au contraire être des barrières à la dispersion.
L’étude de ces différents mécanismes expliquant l’effet de la diversité en plantes sur la diversité en microorganismes en est à ses prémices, et une première étape est d’ores et déjà de faire le point sur les preuves empiriques ou expérimentales existantes dans la littérature.
L’influence de la diversité floristique à l’échelle locale et paysagère
L’effet de la diversité en plantes sur les microorganismes est un sujet traité avec des efforts variables dans la littérature scientifique. L’essentiel de la littérature sur le sujet s’est focalisé sur l’effet de la diversité spécifique (diversité des espèces) au sein d’un même assemblage local de plantes sur les microorganismes associés, qu’ils soient présents dans le sol à proximité ou dans les racines des plantes. Le microbiote* associé aux autres compartiments de la plante a été peu étudié (voir cependant Laforest-Lapointe et al., 2017, sur le microbiote de feuilles d’arbres). Néanmoins, ces travaux démontrent des effets en général positifs de la richesse floristique sur la richesse en microorganismes associés aux plantes (p.ex. Hiiesalu et al., 2014), bien que cela soit variable entre les groupes taxonomiques de microorganismes étudiés (p.ex. Mony et al., 2020). Cet effet richesse ne peut cependant être dissocié d’un effet identité des plantes, conduisant parfois à un signal faible voir absent.
Toujours à l’échelle locale, l’effet de mélanges de génotypes de plantes sur le microbiote associé est rarement étudié, et ce malgré de nombreuses preuves de l’existence de différences importantes entre génotypes. Un de nos travaux récents sur le blé démontre cependant que le microbiote d’individus cultivés au sein d’un mélange de trois cultivars* différents présentent plus d’espèces qu’attendues dans certains phyla* de bactéries et de champignons endophytes* (effet synergique de la richesse en génotypes) (Mauger et al., soumis). Le mélange de variétés ou la culture de mélanges plurispécifiques est l’une des pistes privilégiées dans certaines formes d’agriculture, par exemple en agriculture biologique.
L’effet de la diversité en plantes à l’échelle du paysage sur le microbiote des plantes est encore très peu étudié. L’essentiel de la littérature réalisé à cette échelle-là se focalise sur des approches épidémiologiques, c’est-à-dire étudie l’effet de la structuration du paysage sur la transmission de maladies, notamment via des microorganismes pathogènes. Certaines études démontrent que des paysages présentant une alternance de cultivars d’une plante cultivée entre parcelles, sont potentiellement plus résistants à la transmission de certains microorganismes pathogènes (Papaix-et-al., 2014), certains cultivars agissant comme barrière à la propagation entre champs. Cet effet d’une composition génotypique complexe à l’échelle du paysage reste à généraliser à d’autres guildes fonctionnelles* (par exemple aux microorganismes symbiotiques).
De manière surprenante, malgré l’accumulation de preuves et d’observations empiriques démontrant l’importance de la diversité des couverts végétaux au sein des paysages sur de nombreux groupes taxonomiques, le compartiment microbien est systématiquement mis de côté. L’un des freins à ces recherches est la découverte relativement récente de la limitation importante de la dispersion chez les microorganismes.
Plusieurs observations convergent depuis pour suggérer un effet potentiel de l’influence de la diversité à l’échelle des paysages sur le microbiote des plantes, notamment par la fourniture d’hôtes potentiels. Par exemple, le microbiote d’une plante cultivée peut différer en fonction de la proximité de la parcelle cultivée à certains types de couvert végétal (par exemple la présence d’habitats semi-naturels) (Ricono et al., soumis), suggérant que la préservation de zones riches en diversité peut servir de refuge à une forte diversité microbienne. Cet aspect s’observe y compris au niveau des pratiques agricoles elles-mêmes. Par exemple, nous avons démontré que la densité de haies au sein des paysages, ainsi que la proportion de cultures conduites en agriculture biologique, favorisent la diversité pour plusieurs phyla* de bactéries associées aux racines de blé, que celui-ci soit cultivé dans un champ en agriculture conventionnelle ou biologique. Ce résultat original démontre une échelle de réponse des plantes et microorganismes à la diversité des pratiques, qui se fait non pas seulement à l’échelle du champ cultivé mais aussi à celle des paysages.

Figure 3 : Paysage agricole, en Occitanie. (Cliché A. Teyssèdre.)
La diversité végétale, un levier pour l’agriculture de demain ?
L’utilisation de la diversité des plantes afin de maintenir les services écosystémiques fournis par leurs microorganismes symbiotiques semble être une piste prometteuse pour tendre vers une agriculture durable. Le développement de pratiques alternatives à l’agriculture conventionnelle propose pour certaines l’inclusion d’une plus grande diversité (génétique ou/et spécifique) au sein des systèmes. L’agriculture biologique, la permaculture ou encore l’agroforesterie sont des exemples où l’association de plusieurs génotypes, de cultures en mélange, ou la co-culture de plantes cultivées et spontanées – adventices ou arbres – sont promues. Leur succès peut être étudié au prisme de leurs effets positifs sur le compartiment microbien.
L’une des conséquences importantes des travaux sur l’effet de la diversité des couverts végétaux sur les microorganismes est également le choix de l’échelle de prise de décision quant à l’aménagement agricole. La confirmation d’un effet positif de la diversité des couverts sur la diversité microbienne à l’échelle des paysages laisse entrevoir une échelle de réponse bien au-delà de celle utilisée traditionnellement pour planifier les itinéraires techniques des parcelles, et suggère que la réflexion doit être menée de manière coordonnée entre exploitations agricoles lorsqu’il s’agit de préserver la fertilité biologique des sols.
Glossaire
Agrosystème, ou agroécosystème : Ecosystèmes mis en place et/ou gérés par l’homme pour une production agricole (e.g. culture, élevage, production fourragère).
Champignon mycorhizien : Champignon colonisant les racines d’une plante et vivant en symbiose avec elle. Le développement du champignon peut s’effectuer depuis l’intérieur des cellules de racines (endomycorhize) ou entre les cellules de la couche cellulaire périphérique des racines (ectomycorhize). Ils forment un réseau d’hyphes dans le sol.
Cultivar : Variété de plante obtenue le plus souvent par sélection et présentant des caractéristiques particulières en termes de traits biologiques (morphologiques, physiologiques) individuels et de performance agronomique.
Endophytes : Micoorganismes symbiotiques se développant à l’intérieur des tissus de l’organisme.
Guilde : Groupe fonctionnel, c’est-à-dire ensemble d’espèces partageant la même fonction ou le même effet sur leur hôte (e.g. guilde des organismes symbiotiques, pathogènes).
Microbiote : Ensemble des microorganismes (bactéries, champignons, protistes, archeae) vivant dans ou sur un hôte. Le microbiote chez une plante peut être décrit au niveau des feuilles (phyllosphère), des racines (rhizosphère et endosphère racinaire), des fleurs et fruits (carposphère).
Phylum : Embranchement, large groupe systématique au sein de la classification des espèces.
Richesse spécifique : Nombre d’espèces différentes dans une communauté écologique.
Remerciements
Les réflexions rapportées dans ce regard sont le fruit des travaux réalisés depuis près de dix ans pour les projets MYCOLAND puis MICROLAND, financés par les programmes PEPS et EC2CO du CNRS, le projet AGRIM financé par l’Agence Française pour la Biodiversité et Symbagri soutenu par la Fondation de France. Nous remercions également chaleureusement Anne Teyssèdre pour ses relectures attentives et corrections très pertinentes.
Bibliographie
Bittebiere A-K., Vandenkoornhuyse P., Maluenda E., Gareil A., Dheilly A., Coudouel S., Bahin M. & C. Mony, 2020. Past spatial structure of plant communities determines arbuscular mycorrhizal fungal community assembly. Journal of Ecology 108, 546-560.
Guo, J., Ling, N., Chen, Z., Xue, C., Li, L., Liu, L., Gao, L., Wang, M., Ruan, J., Guo, S., Vandenkoornhuyse, P. & Q. Shen, 2019. Soil fungal assemblage complexity is dependent on soil fertility and dominated by deterministic processes. New phytologist 226, 232-243.
Hiiesalu I., Pärtel M;, Daviison J;, Gerhold P;, Metsis M;, Moora M;, Opik M;, Vasar M;, Zobel M. & S.D. Wilson, 2014. Species richness of arbuscular mycorrhizal fungi: associations with grassland plant richness and biomass. New phytologist 203, 233-244.
Kiers E.T., Duhamel M., Beesetty Y., Mensah J.A., Franken O., Verbruggen E., Felbaum C.R., Kowalchuk G.A., Hart M.M., Bago A., Palmer T.M., West S.A., Vandenkoornhuyse P., Jansa J. & H. Bücking, 2011. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science 333, 880-882.
Laforest-Lapointe I., Paquette A., Messier C. & S.W. Kembel, 2017. Leaf bacterial diversity mediates plant diversity and ecosystem function relationships. Nature 546, 145-147.
Mauger S., Ricono C., Mony C., Chable V., Serpolay V., Biget M. & P. Vandenkoornhuyse, soumis. Differentiation of endospheric microbiota in ancient and modern wheat cultivar roots. Plant-Environment interactions
Mony C., Brunellière P., Vannier N., Bittebiere A-K. & P. Vandenkoornhuyse, 2020. Effect of floristic composition and configuration on plant root mycobiota: a landscape transposition at a small scale. New phytologist 225, 1777-1787.
Mony C., Gaudu V., Ricono C., Jambon O. & P. Vandekoornhuyse, 2021. Plant neighbors shape fungi assemblages associated with plant roots : a new understanding of niche-partitioning in plant communities. Functional Ecology.
Papaix, J., Touzeau, S., Monod, H. & C. Lannou, 2014. Can epidemic control be achieved by altering landscape connectivity in agricultural systems ? Ecological modelling 284, 35-47.
Ricono C., Vandenkoornhuyse P., Aviron S., Jambon O., Michon-Coudouel S., Causse Vedrines R., Mauger S. & C. Mony, soumis. Organic agriculture and hedegerows uphold endospheric wheat microbiota at field and landscape scale. FEMS.
Spor A., Roucou A., Mounier A., Bru D., Breuil M.-C., Dort F., Vile D., Roumet P., Philippot L. & C. Violle, 2020. Domestication-driven changes in plant traits associated with changes in the asebmly of the rhizosphere microbiota in tetraploid wheat. Scientific reports 10, 12234.
Vandenkoornhuyse P., Ridgway K.P., Watson I.J., Fitter A.H. & J.P.W. Young, 2003. Co-existing grass species have distinctive arbuscular mycorrhizal communities. Molecular Ecology 12, 3085-3095.
Vannier N., Mony C., Bittebière A.-K. & P. Vandenkoornhyuse, 2015. Epigenetic Mechanisms and Microbiota as a Toolbox for Plant Phenotypic Adjustment to Environment. Frontiers in Plant Science 6, e30515.
Xu Q., Ling N., Chen H., Duan Y., Wang S., Shen Q. & P. Vandenkoornhuyse, 2020. Long-term chemical-only fertilization induces a diversity decline and deep selection on the soil bacteria. mSystems 5, e00337–e00420.
Regards connexes
Regards sur les sols : https://sfecologie.org/tag/sols/
Regards sur l’agriculture : https://sfecologie.org/tag/agriculture/
Regards sur les interactions : https://sfecologie.org/tag/interactions/
Sur biodiversité et société : https://sfecologie.org/tag/societes/
Regard édité et mis en ligne par Anne Teyssèdre
——-
Forum de discussion sur ce regard

Un regard neuf sur la biodiversité des agroécosystèmes, qui pose les bonnes questions et fournit les bonnes solutions pour l’avenir de l’agriculture. Un bel exemple de passage de la recherche fondamentale à la recherche appliquée. Dommage que l’étude n’ait pas eu le temps d’être entre les mains de nos chers fonctionnaires européens. Encore une pierre dans le « jardin » de l’agriculture productiviste basée sur la simplification des agroécosystèmes…
Bonsoir,
Merci d’attirer notre attention sur ce compartiment peu étudié jusqu’à présent que constitue le microbiome des plantes – nous devrions plutôt dire les microbiomes, puisque comme vous le rappelez, les plantes elles-mêmes sont compartimentées, et j’imagine qu’on sait encore peu de chose sur les échanges de microbiotes entre endo- et exo-microbiomes, entre feuilles et racines, etc.
A vous lire on a cependant l’impression que vous considérez la diversité microbienne comme inconditionnellement favorable. Pourquoi pas, mais en a-t-on les preuves ? Et n’existe-t-il pas des « tricheurs » dans ces « communautés » qui par exemple pompent des nutriments sans rien donner en retour ?
Et puis, mais on ne saurait vous en faire grief car il est probablement impossible de tout aborder dans le cadre d’un tel regard, disposons nous d’informations sur les autres acteurs de ce qui doit nécessairement constituer un triptyque, à savoir la microfaune des sols (quand on sait notamment le rôle qu’on les lombricidés dans la digestion des bactéries du sol) ? Les expériences que vous relatez peuvent-elles êtres interprétées sans prendre en compte ce compartiment ?
Cordiales salutations
Bonjour François,
Voici des éléments de réponse à votre commentaire. Il existe bien une compartimentation du microbiote végétal (telle que schématisée par la figure 1 de ce Regard et explicitée dans la légende. Note de l’éditrice).
La rhizosphère est conditionnée par l’hôte végétal avec des métabolites secondaires émis par les plantes qui conditionnent la composition de cette rhizosphère. La rhizosphère est bien entendu recrutée à partir du réservoir de microorganismes du sol à proximité des racines. Le réservoir du sol est quant à lui sous l’influence de contraintes abiotiques et biotiques tel que suggéré dans le commentaire.
La rhizosphère est un compartiment clé à partir duquel une large proportion des microorganismes endosphériques racinaires est recrutée. On sait aussi depuis peu que cette endosphère racinaire contribue pour une part importante dans la composition de la phyllosphère (voir par exemple Xiong et al., New Phytol 2020).
On confère souvent au microbiote endosphérique des plantes des fonctions écologiques importantes pour l’hôte. Il est toutefois tout à fait juste que ces microorganismes endosphériques puissent avoir des effets négatifs (p.ex. pathogènes, pathogènes opportunistes, parasites) tel que suggéré dans le commentaire. Dans la nature, des symbiotes tricheurs (parasites de l’hôte) émergent et c’est une trajectoire évolutive théoriquement favorable pour le symbiote tricheur qui investit moins dans la relation symbiotique mais d’avantage dans sa propre survie et reproduction. Toutefois nous avons démontré que l’hôte est capable de trier les bons et mauvais coopérateurs par un mécanisme de récompense conditionné à l’investissement du symbiote (p.ex. Kiers et al., Science 2011). En d’autres termes les symbiotes les plus coopérateurs reçoivent d’avantage de carbone de l’hôte. Ce faisant, les mauvais coopérateurs voient leur avantage sélectif atténué.
Sur ce point concernant les trajectoires eco-évolutives, deux questions clés sont ouvertes et devront être considérées pour l’agriculture de demain. La première concerne l’état de coopération de microorganismes clés pour la plante-hôte, dans le réservoir des symbiotes recrutables. On peut supposer qu’une érosion de la richesse de ce réservoir conduise à une réduction de l’efficacité fonctionnelle (du niveau de coopération) des symbiotes restants. La seconde concerne la capacité des cultivars modernes à sanctionner les tricheurs, une fonction qui semble altérée et qui, de fait, pourrait permettre une augmentation forte de la fréquence des symbiotes tricheurs dans les sols agricoles. Ces deux aspects nécessitent un diagnostic de manière urgente. Pour ces questions et pour une agriculture plus durable, la réintroduction de diversité et richesse végétale spontanée ou non tel que développé dans cet article pourrait être très important.
Cendrine Mony & Philippe Vandenkoornhuyse
Merci pour ce très intéressant Regard. La dynamique spatiale et temporelle de la microflore du sol est un sujet encore très peu connu et les résultats apportés ouvrent des pistes très intéressantes, et une première base scientifique aux connaissances empiriques des agro écologues de toutes natures. On ne sait pas vraiment à quel point les microorganismes du sol sont incapables de se déplacer et si comme on peut le penser ils sont inactifs durant de longues périodes pour cette raison, combien de temps dure cette inactivité, comment elle se lève (sous l´action des organismes ingénieurs comme les racines, mais aussi les vers de terre, les termites ou les fourmis ?). On ne sait pas non plus s´il existe une différence notable entre les bactéries et les champignons unicellulaires et les champignons mycéliens qui ont une capacité à se déplacer théoriquement plus importante. Et finalement, on ne peut pas écarter l´hypothèse suggérée par divers travaux, qu´une partie de la microflore est à croissance lente de toutes façons et ne répond pas à la stimulation induite par les apports d´exsudats racinaires.
Et bien sûr, comme spécialistes des vers de terre, nous regrettons que le cloisonnement thématique empêche souvent les microbiologistes de prendre en compte dans leurs modèles théoriques un organisme qui peut digérer chaque année plusieurs centaines de t de terre par hectare, avec des effets très forts et assez bien étudiés, sur le peuplement microbien C´est un grand progrès de s´ intéresser à l´effet des racines, premiers ingénieurs de l´écosystème du sol ; il reste a intégrer dans le jeu tous les acteurs. On sait que toutes les plantes ne développent pas leurs racines fines dans tous les turricules de vers (pourtant riches en nutriments assimilables et en hormones de croissance). Et quid de la chaine des microprédateurs a qui d´autres spécialistes attribuent une importance énorme dans le contrôle des peuplements microbiens et le recyclage des nutriments, sans oublier les virus ?