La Société Française d’Ecologie (SFE) vous propose le regard de John Thompson et d’Ophélie Ronce sur la Fragmentation.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions après cet article. Les auteurs vous répondront et une synthèse des contributions sera ajoutée après chaque article.
Fragmentation des habitats et dynamique de la biodiversité
John. D. Thompson(1) et Ophélie Ronce (2)
(1) Centre d’Ecologie Fonctionnelle et Evolutive (CEFE), Montpellier
(2) Institut des Sciences de l’Evolution de Montpellier (ISEM)
( Fichier PDF )
Regard R6, édité par Anne Teyssèdre
———
Mots clés : Fragmentation, habitats, changements globaux, écologie, biodiversité, dynamique, paysage, métapopulations, populations, connectivité, facteurs d’impact.
———
La fragmentation, un processus multiforme
Rares sont les habitats non fragmentés à un certain degré. De nombreuses régions témoignent de la transformation des paysages, voire de leur transfiguration, par des activités humaines telles que l’urbanisation, la construction de routes, la déforestation ou l’intensification de l’agriculture. Ces activités réduisent les effectifs de certaines espèces, modifient leur distribution dans l’espace et les possibilités d’échanges entre populations, et mettent au contraire en contact des espèces d’habitats différents jusque là isolées. Mais qu’est-ce vraiment que la fragmentation d’un habitat ? Un patron à cartographier ? Une modification du fonctionnement de l’écosystème à décrypter ?
La fragmentation décrit un ensemble de processus qui transforme une surface continue d’habitat naturel en un nombre plus ou moins important de fragments de taille variable. L’ensemble de milieux qui en résulte – souvent hétérogène – séparant les fragments est communément désigné par le terme de « matrice » (Wilcove et al. 1986). La perte d’habitat peut se faire de plusieurs manières avec des conséquences très variables pour sa configuration spatiale (figure 1). La fragmentation peut se manifester par : (i) la réduction en surface d’un habitat, (ii) l’isolement de parcelles/fragments de l’habitat dans le paysage, (iii) l’augmentation du nombre de parcelles, (iv) la réduction de la taille de ces parcelles et (v) de plus grandes distances entre celles-ci, et (vi) une modification des propriétés de la matrice qui affecte le déplacement des individus…
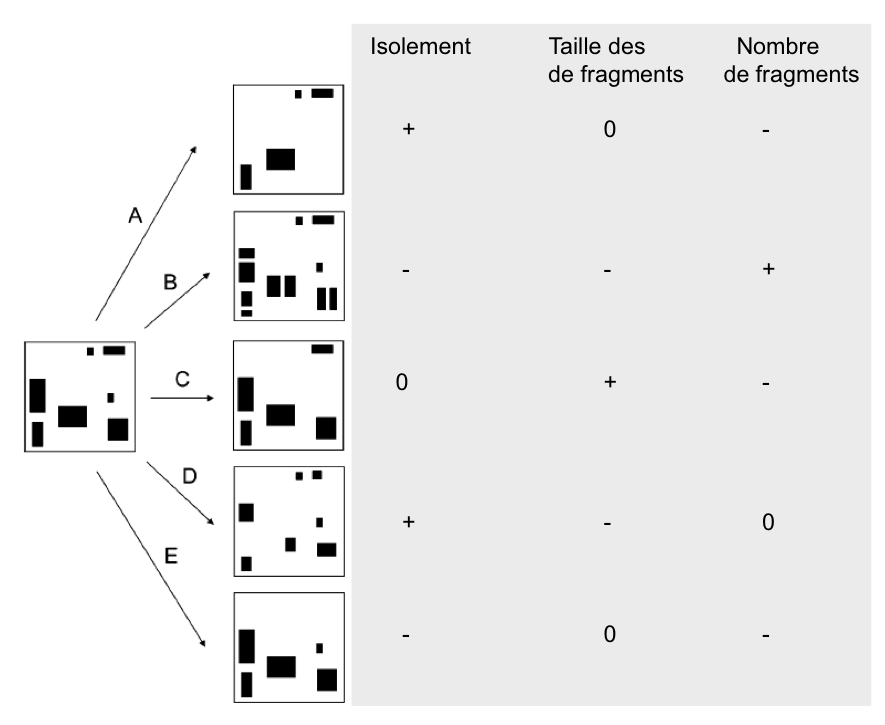
Fig.1 : La perte d’habitat peut se faire de plusieurs manières avec des conséquences très variables pour sa configuration spatiale. Dans certains cas le nombre de fragments diminuer (-) pendant que le degré d’isolement augmente (+), sans pour autant influencer (0) la taille moyenne des fragments (schéma A). Dans d’autres circonstances, le degré d’isolement diminue au contraire avec une augmentation du nombre de fragments de taille plus petite (schéma B). On peut aussi observer une augmentation soit de la taille moyenne des fragments lié à la perte des plus petits fragments (C) soit un nombre constant de fragments, de plus petite taille et plus isolés (schéma D). Finalement, une diminution du nombre de fragments peut également être compatible avec une diminution de leur isolement (schéma E)!
Des conséquences complexes
A l’image de la diversité de processus qui sous-tendent la fragmentation, l’étude de ses conséquences sur la diversité et le fonctionnement des communautés, sur la viabilité des populations et sur leur capacité de réponse évolutive, a produit des résultats d’une grande variété. L’analyse spatiale des patrons paysagers, comme le nombre et la distance entre les parcelles ou fragments d’habitat, ne renseigne que très partiellement sur le devenir des populations vivant dans ces fragments si elle n’est pas couplée à une analyse de la dispersion dans ces paysages, du fonctionnement démographique et génétique des populations. Par exemple, l’ouverture d’un habitat forestier liée à sa fragmentation facilite la dispersion par le vent des fruits du Frêne, et donc accroît de façon contre intuitive le brassage génétique chez cette espèce (Bacles et al. 2006).
La modification des mouvements des individus entre parcelles d’habitats a elle-même de multiples facettes. D’un point de vue évolutif, l’isolement des populations facilite leur adaptation aux conditions écologiques locales et est considéré comme une étape cruciale dans la diversification et l’émergence de nouvelles espèces. Cependant lorsqu’il est couplé à une forte réduction des effectifs des populations dans les fragments, l’isolement peut sévèrement compromettre la persistance des espèces habitant ces paysages. D’un point de vue démographique, la faible taille des populations les rend très sensibles aux aléas de survie et de reproduction tout au long de leur cycle de vie : même si les conditions de vie ne sont pas dégradées dans les fragments, le risque d’extinction pour des causes fortuites augmente fortement quand le nombre d’individus diminue. La recolonisation de ces fragments est alors difficile du fait de leur isolement. Le succès de reproduction dans les fragments de petite taille peut également être limité, comme chez la Gentiane des marais ou la Scirpe maritime, par la rareté du pollen compatible pour féconder les ovules (Charpentier et al; 2010).
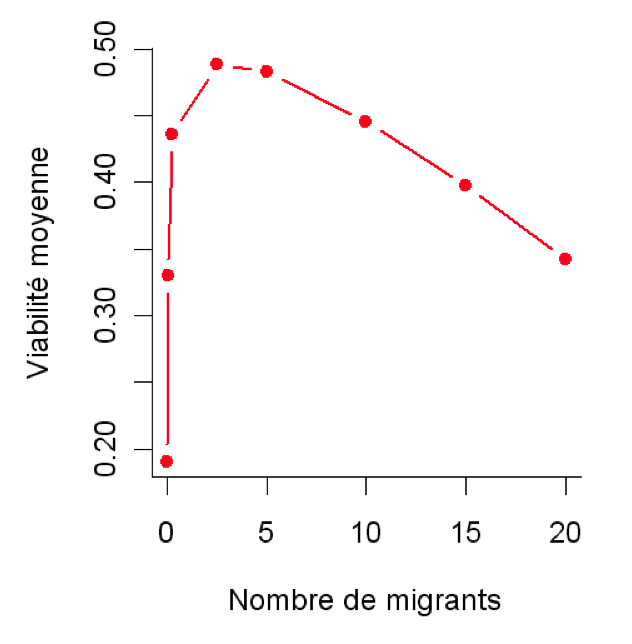
Fig.2 : En modélisant l’évolution de la viabilité des individus dans un paysage fragmenté, on montre que l’immigration de un à dix individus par génération dans chaque fragment d’habitat est optimale (d’après Lopez et al. 2009). Si l’immigration est trop faible, la population souffre de la consanguinité. Si l’immigration est trop forte, l’adaptation aux conditions écologiques locales est compromise. Le paysage simulé ici est composé de 25 fragments contenant chacun 32 individus et les conditions écologiques varient entre les fragments d’habitat, favorisant différents génotypes dans différentes localités.
La perte de diversité génétique associée aux baisses d’effectifs et à l’isolement des populations a également des conséquences néfastes sur leur viabilité: à court terme, la consanguinité accrue peut conduire à un déclin des performances des individus ; à moyen terme, l’efficacité de la sélection naturelle à éliminer des variants désavantageux ou à produire de nouvelles adaptations dans un environnement changeant est compromise. Un niveau d’isolement modéré correspondant à l’immigration en moyenne d’un individu par génération dans chaque parcelle d’habitat pourrait alors permettre d’atténuer fortement les effets délétères associés à la réduction des effectifs sans empêcher une adaptation locale (figure 2, Lopez et al. 2009).
Au-delà des effets néfastes, il convient néanmoins de se Fig.2 : poser la question : les espèces peuvent-elles s’adapter à vivre dans des petites parcelles d’habitat très isolées ? Une étude du fonctionnement des populations végétales en réponse à une fragmentation extrême suggère que oui (figure 3). La réponse évolutive des espèces confrontée à la fragmentation de leur habitat pourrait aggraver encore l’isolement des populations (voir aussi http://www.plant.wageningen-ur.nl/projects/plantdispersal/ et Riba et al. 2009). Cependant, nous avons encore peu d’éléments pour juger de la généralité de ces réponses évolutives et de leurs conséquences pour la persistance des espèces dans les paysages fragmentés. La perte de viabilité (et la réduction de la diversité en espèces) générée par la fragmentation des habitats peut prendre des décennies, voire des siècles.
De fait une espèce peut être présente sans que les conditions locales ne soient réunies pour garantir son maintien, comme on l’a démontré dans les pelouses calcaires fragmentées par l’agriculture intensive. Un certain nombre d’espèces risquent alors de disparaître en décalage avec une fragmentation antérieure de l’habitat qui est, néanmoins, la cause directe de leur perte. Il existe une sorte de « dette d’extinction » (Tilman et al 1994 ; ). Des signatures de la fragmentation des paysages sont pourtant déjà visibles, avec par exemple une perte de la viabilité dans les populations d’oiseaux au sein de paysages où il ne reste que des fragments d’habitat de petite taille (Brooks et al 1999).

Fig.3 : Evolution des capacités de dissémination des graines en milieu urbain chez Crepis sancta. Cette petite plante de la famille des asteracées produit sur chaque plante de graines à papus qui dissémine bien avec le vent (b) et des grosses graines qui se disséminent peu (c) – ou « nd ». Elle est présente dans des grandes populations plus continues en milieux rural (d) et des petites fragments de végétation en milieu urbain (e). Une étude récente (Cheptou et al. 2008) révèle une rapide adaptation de cette espèce à la configuration spatiale de ses populations en ville. Prédiction : la sélection naturelle devrait favoriser les plantes produisant plus de grosses graines en ville – pour réduire des pertes de dissémination. Résultats : On observe une réduction de l’investissement dans la dissémination en milieu fragmenté (f : Proportion de graines à faible capacité de dissémination (type « nd ») par plante).
Les fragments ne sont pas des îles
Dès ses origines au début des années 1970, la recherche sur la fragmentation des habitats a constaté que des petits fragments de nature contiennent moins d’espèces que les grands, suivant ainsi la célèbre relation aire – espèces prédite par la théorie de la biogéographie des îles (MacArthur & Wilson 1967). Selon cette relation, la composition des petites parcelles ne représente qu’un échantillon de celle des grandes. La concordance entre les observations et la théorie biogéographique des îles a favorisé l’idée que les fragments d’habitat, entourés d’une mer d’habitats défavorables voire hostiles, sont comparables aux îles.
A partir de cette supposition, un ensemble de principes concernant la taille, la forme et la distance entre fragments a été proposée en tant qu’outil à la décision pour la sélection des zones de protection de la nature. Or, à travers le paysage, les fragments ne sont pas toujours dans des conditions uniformes et ne sont pas non plus totalement épargnés des influences extérieures (pollutions, introductions, modifications des flux). L’interaction entre les espèces et la matrice environnante est aussi un élément essentiel, notamment pour le déplacement des espèces (perméabilité des espaces de connexion) et leur persistance localement (Janzen 1983). Les fragments représentent alors des éléments d’un paysage hétérogène et le cadre de réflexion, par exemple pour la gestion des zones de protection, est plutôt paysager qu’insulaire.
Plus récemment, le maintien et/ou la restauration de la connectivité écologique d’un paysage sont devenus un axe essentiel des politiques émergentes de conservation. Or les scientifiques manquent de recul sur le long terme et l’incertitude persiste au sujet de l’efficacité des corridors qui devraient permettre aux espèces de se déplacer entre habitats favorables à leur persistance. Dans un monde où les changements climatiques commencent à forcer l’adaptation et la migration des espèces, un objectif majeur sera alors d’identifier l’impact des modifications de superficie et de configuration spatiale des habitats sur la capacité des espèces à migrer avec ces changements.
——–
Bibliographie
Bacles, C. F. E., Lowe, A. J., Ennos, R. A. 2006. Effective seed dispersal across a fragmented landscape. Science 311:628.
Brooks, T. M., S. L. Pimm, and J. O. Oyugi. 1999. Time lag between deforestation and bird extinctions in tropical forest fragments. Conservation Biology 13:1140–1150.
Charpentier, A., P. Grillas, and J. D. Thompson. 2000. The effects of population size limitation on fecundity in mosaic populations of the clonal macrophyte Scirpus maritimus (Cyperaceae). American Journal of Botany 87:502-507.
Cheptou, P.-O., Carrue, O., Rouifed, S., Cantarel, A. 2008. Rapid evolution of seed dispersal in an urban environment in the weed Crepis sancta. Proceedings of the National Academy of Sciences USA 105: 3796-3799.
Janzen, D. H. 1983. No park is an island: Increase in interference from outside as park size decreases. Oikos 41:402-410.
Lopez, S., Rousset, F., Shaw, F. H., Shaw, R. G. et Ronce, O. 2009. Joint effects of inbreeding and local adaptation on the evolution of genetic load after fragmentation. Conservation Biology 23: 1618-1627.
MacArthur, R. H., and E. O. Wilson. 1967. The theory of island biogeography. Princeton University Press, Princeton.
Riba, M., Mayol, M., Giles, B. E., Ronce, O., Imbert, E., Van der Velde, M., Chauvet, S., Ericson, L., Bijlsma, R., Vosman, B., Smulders, M. J. M. and Olivieri, I. 2009. Darwin’s wind hypothesis: does it work for plant dispersal in fragmented habitats? New Phytologist 183: 667-677.
Wilcove, D. S., C. H. McLellan, and A. P. Dobson. 1986. Habitat fragmentation in the temperate zone. Pages 237-256 in M. E. Soulé, editor. Conservation Biology. The science of scarcity and diversity. Sinauer Associates Inc., Sunderland, Massachussets.
Pour en savoir plus
Thompson, J.D. (2008). Des fragments de nature : éléments d’une hétérogénéité paysagère façonnée par l’homme. In Entre l’Homme et la Nature : une démarche pour des relations durables. Réserves de Biosphère – Notes Techniques 3 (ed L. Garnier), pp. 50-53. UNESCO, Paris.
———
Article édité par Anne Teyssèdre

Je suppose que l’impact de la fragmentation d’un habitat sur la dynamique des espèces qui le peuplent – par exemple celui de la réduction de parcelles de forêts disséminées dans une vaste ‘matrice’ de terres agricoles – varie non seulement avec l’état de le matrice, mais aussi avec l’identité du groupe fonctionnel ou taxon considéré : insectes, oiseaux, arbres, ‘plantes herbacées’, mammifères carnivores, champignons basidiomycètes,… Ceci parce que ces groupes ou taxons diffèrent largement par la densité de leurs populations et leur mobilité/capacité de dispersion.
La capacité d’accueil (capacité de charge) mais aussi la connectivité d’un paysage donné doivent donc largement varier en fonction du groupe fonctionnel ou systématique considéré. Comment prendre en compte ceci dans les stratégies d’aménagement des territoires et de préservation de la biodiversité ? [En particulier, pour l’élaboration de la trame ‘verte et bleue’ préconisée par le Grenelle de l’Environnement ?]
« l’isolement des populations facilite leur adaptation aux conditions écologiques locales et est considéré comme une étape cruciale dans la diversification et l’émergence de nouvelles espèces »
Est ce que cela veut dire que la fragmentation peut aussi avoir du bon ? l’homme créant des paysages très hétérogènes, est ce que cela ne peut pas finalement être un facteur de diversification à long terme ?
Les perturbations des échanges génétiques accompagnant la fragmentation des paysages pourraient en principe avoir des conséquences positives ou négatives sur la diversification; l’isolement naturel des populations lié à différents évennements climatiques ou géologique joue effectivement un rôle majeur dans les processus de spéciation. Cependant je connais pas d’exemple clair où il est avéré que la fragmentation des habitats par l’homme ait eu de forts effets positifs sur la diversification dans la nature. D’une part ces processus de diversification se produisent peut être sur des pas de temps plus long que la rapide modification des paysages (nous n’aurions alors pas le recul pour détecter les conséquences évolutives de ces modifications). D’autre part les effets de perte d’habitat et de réduction des effectifs qui vont de concert avec l’isolement croissant dominent probablement la dynamique et l’évolution de ces populations de façon négative. Il serait intéressant d’explorer cette question plus avant.
Notons que la diversification écologique de certaines espèces est clairement liée à leur adaptation divergente dans des milieux modifiés par l’homme (par exemple l’évolution de la tolérance aux métaux lourds chez certaines plantes colonisant les anciens sites miniers). Peu d’espèces cependant ont montré la capacité à s’adapter à ces millieux extrêmes. Ceci suggère une fois de plus que les conséquences évolutives des modifications des paysages par l’homme varient de manière fortement idiosynchratique d’un paysage à l’autre et d’une espèce à l’autre.
Les échelles de réponses des espèces à l’hétérogénéité du paysage et au degré de fragmentation des habitats sont très variables. Les déplacements entre sites disjoints se font à des échelles spatiales très variables : de l’ordre des centaines de mètres pour les amphibiens entre mares et sites d’hivernage, ils peuvent être, pour les canards hivernants, de l’ordre d’une dizaine de kilomètres entre les sites d’alimentation et les sites de repos. Ainsi, les capacités de dispersion et les exigences écologiques des espèces conditionneraient la densité nécessaire du maillage des espaces au sein d’un réseau écologique. D’où la question : « Comment prendre en compte ceci dans les stratégies d’aménagement des territoires et de préservation de la biodiversité ? [En particulier, pour l’élaboration de la trame ‘verte et bleue’ préconisée par le Grenelle de l’Environnement ?] ».
Tout d’abord, je dirai qu’il est essentiel d’identifier les enjeux de connectivité sur un territoire donnée. De manière schématique, on peut dire que les déplacements s’opèrent à trois niveaux : les déplacements des individus pour effectuer les différentes phases de leur cycle de vie (mouvements journaliers entre sites de nidification et de chasse, migrations saisonnières, …) ; l’établissement de nouvelles populations en réponse aux changements de milieu (la fermeture des milieux ouverts est un exemple par excellence) avec surtout des échanges (génétiques) lors de la fondation d’une nouvelle population (fonctionnement de type « métapopulation ») ; enfin, des déplacements de l’aire de répartition des espèces en réponse aux changements à long terme.
Proposition phare de la loi du 12 juillet 2010 portant l’engagement national pour l’environnement, l’outil « trame verte et bleue (TVB) » représente un des principaux engagements de la France dans l’évolution déjà visible sur le plan international d’une territorialisation des enjeux de biodiversité pour minimiser les conséquences de la fragmentation des habitats. Dans un objectif de préservation, gestion et remise en bon état des milieux nécessaires aux continuités écologiques, la TVB contribue à deux grandes ambitions : (i) identifier les espaces (ou « réservoirs ») importants pour la préservation de la biodiversité et les relier par des corridors écologiques en tenant compte de la biologie des espèces et des flux génétiques, et (ii) améliorer la qualité et la diversité des paysages.
En partant du postulat que la continuité sert à leur déplacement, il est proposé de cibler le maintien ou la remise en bon état de cette continuité à plusieurs échèles (nationale, régionale et communale) pour différents groupes d’espèces pas trop rares et caractéristiques chacun d’un type d’habitat donné. La localisation des habitats associés à ces groupes d’espèces permet de réfléchir aux continuités à maintenir ou restaurer (approche « espèces puis habitats »). Les propositions du COMOP TVB proposent aussi d’adopter où nécessaire une approche habitat-espèces en utilisant l’outil ZNIEFF. Un point important ici concerne le fait que les déplacements se font très souvent entre types de milieux différents qui permettent d’assurer les différentes phases du cycle de vie. Ici la connectivité écologique se base sur une complémentarité de milieux différents. Une approche qui intègre la diversité de milieu à l’échelle d’un paysage serait aussi nécessaire.
Une précision pour les non spécialistes : le COMOP TVB était le Comité Opératoire du Grenelle de l’Environnement chargé en octobre 2007 de réfléchir à la mise en place d’une ‘trame verte et bleue’ sur l’ensemble du territoire français ; une ‘ZNIEFF’ est une zone d’intérêt écologique, faunistique et floristique, au statut d’espace protégé particulier…
Par ailleurs, John, pourrais-tu illustrer ta réponse ci-dessus à Miss Erable, sur la prise en compte des caractéristiques biologiques des espèces, telles que la mobilité, le cycle de vie, etc. dans la conception et la mise en place de cette fameuse trame verte, par un ou deux exemples concrets ?
L’identification des zones naturelles d’intérêt écologique faunistique et floristique (ZNIEFF) comprend le recensement (non exhaustif) des parties du territoire abritant des éléments rares, remarquables, protégés ou menacés du patrimoine naturel (faune, flore et habitats naturels). Les ZNIEFF n’ont pas de statut de protection mais représente un outil de connaissance et d’information sur les richesses du patrimoine naturel au service de l’aménagement du territoire.
Pour de nombreuses espèces animales les exigences d’habitats peuvent changer selon la période de l’année nécessitant le mouvement d’individus entre sites (exemple des amphibiens entre mare de ponte et sous-bois pour hivernage). Pour d’autres les mouvements se font plus régulièrement entre site de reproduction et terrains d’alimentation. Dans d’autres cas, comme chez le chamois et le bouquetin, on peut observer des déplacements d’individus entre populations différentes et la colonisation de nouveaux sites.
Vaste question très intéressante, illustrant bien la difficulté de rendre des décisions « générales » (p.e. définir des règles de connectivité minimale à établir entre fragments résiduels) alors qu’il n’y a peut-être que des cas particuliers.
Même si les fragments ne sont pas tout à fait des îles, ils y ressemblent beaucoup tout de même, et il faut rappeler que certaines espèces s’en accommodent fort bien. Nombre d’oiseaux marins par exemple ne peuvent se reproduire que sur des « fragments » d’habitat isolés du reste parce qu’ils n’y ont pas de prédateurs ou de concurrents. On peut donc prédire que certaines espèces tireront parti de cette fragmentation, d’autres non pour les raisons abondamment précisées dans le texte introductif. Par ailleurs, il me semble un peu vain de compter sur la fragmentation comme mécanisme de création d’espèce susceptible de pallier à la perte de biodiversité, n’en déplaise aux tenants de la spéciation écologique, les pas de temps impliqués ne sont pas les mêmes. In medio stat virtus, alors pourquoi ne pas adopter une règle de précaution un peu chèvre/chou : une certaine dose de connectivité rétablie ou préservée serait en moyenne plus favorable que plus de connectivité du tout ? Un peu à la manière des métapopulations les plus à même de maintenir de la diversité génétique, celles où la migration est ni trop forte, ni trop faible.
On pourrait appeler ça le modèle « normand »…
Tiens, Jacques Adit n’a pas posté de commentaires….curieux.
Juste une précision pour souligner un paradoxe : la fragmentation est souvent vue à travers un filtre qui contient un « jugement de valeur » implicite : c’est le découpage d’un milieu favorable (exemple des forêts), dans une matrice défavorable (exemple des grandes cultures). Mais rares sont les études qui portent sur des espèces (ex : l’alouette des champs, le vanneau huppé) appréciant les milieux ouverts et qui n’apprécient pas une fragmentation de ce milieu par découpage de celui-ci lors de l’implantation d’une trame verte arborée par exemple. Ce jugement de valeur est associé à une réalité : il y a plus d’espèces forestières que commensales des cultures. Il n’empêche que lorsqu’on s’intéresse aux conseils destinés aux agriculteurs, que leur dit-on ? Fractionnez ! C’est-à-dire apportez de l’hétérogénéité dans la mosaïque cultivée, et découpez vos trop grandes parcelles. Il faudrait donc probablement préciser ce que l’on fractionne, ce qui revient à donner une « valeur » aux habitats, question essentielle de toute action en faveur de la biodiversité.
En réaction au commentaire de Xavier Letheve, je voudrais souligner que la mise en place de haies au sein de larges surfaces céréalières (monoculture de blé en Beauce par ex.) doit bénéficier à la biodiversité agricole :
– d’une part, parce que la présence d’arbres ou d’arbustes est nécessaire à la colonisation des terres cultivées par de nombreuses espèces animales, spécialistes ou non des milieux agricoles, et en particulier justement par des oiseaux. Mis à par le groupe des alouettes et cochevis (alaudidés), qui nichent au sol, la plupart les passereaux des régions agricoles construisent leur nid dans des arbres ou les buissons (linotte mélodieuse, pie grièche, tarier des près..), voire des granges et greniers (hirondelles des cheminées) ; ces espèces jouent un rôle important dans le contrôle des insectes phytophages et la régulation des chaînes trophiques.
– Accessoirement, ces haies participent à la régulation du climat local, et à la rétention de d’eau par les sols..
– Par ailleurs, l’installation de haies étroites au sein de larges surfaces céréalières n’est pas à proprement parler une mesure de « fragmentation » de l’habitat agricole, telle que présentée dans ce regard, car elle ne réduit que marginalement i) la surface totale de ces champs et ii) les déplacements des organismes (donc les flux géniques) entre les « parcelles » ainsi délimitées.
(Ceci à l’inverse de la reforestation ou de l’urbanisation en zone agricole, qui réduisent effectivement la surface des terres cultivées et peuvent limiter les flux géniques entre parcelles.)