La Société Française d’Ecologie (SFE) vous propose le regard 66 sur un des plus riches habitats de mer Méditerranée et pourtant assez méconnu.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
———-
Les récifs coralligènes, un habitat sous-marin riche en biodiversité mais vulnérable
Par Florian Holon(1) et Julie Deter(2)
1 : docteur en écologie marine et co-gérant d’Andromède Océanologie, Carnon (France)
2 : Chef de projets R&D à Andromède océanologie et Maitre de conférences associé à l’université de Montpellier, Institut des sciences de l’évolution, ISEM UMR5554 UM-CNRS-IRD (France)
____
Mots clés : biodiversité marine; écologie marine; méditerranée, plongée; bio-concrétions; DCSMM
Introduction
La mer Méditerranée est la plus grande (2,969,000 km²) et la plus profonde (moyenne 1460 m, maximum 5267 m) des mers fermées de notre planète (Coll et al., 2010). Point chaud de biodiversité*, elle contient presque 18 % de la biodiversité marine connue (Bianchi et Morri, 2000; Coll et al., 2010) soit environ 17 000 espèces alors qu’elle ne couvre que 0,8 % de la superficie marine mondiale (Defant, 1961). Parmi les écosystèmes les plus riches de Méditerranée figurent les récifs coralligènes (Figure 1) dénommés ainsi pour le corail rouge qu’ils abritent (Marion, 1883). Ce sont des habitats d’intérêt communautaire (Directive 92/43/CEE) dont la conservation requiert la désignation de zones de conservation spéciale au niveau européen (dites zones Natura 2000). Cette conservation passe également par la réglementation des activités de pêche. Ainsi le règlement CE 1967/2006 concernant des mesures de gestion pour l’exploitation durable des ressources halieutiques en Méditerranée stipule qu’« au-dessus des habitats coralligènes et des bancs de maerl*, il est interdit de pêcher en utilisant des chaluts, dragues, sennes de plage ou filets similaires ».

Figure 1 : Récifs coralligènes en forme de massifs au large de Fréjus (France)- © Laurent Ballesta
1.Un habitat beau et riche…construit par des algues

Fig. 2 : Tombant de coralligène à Villefranche-sur-mer © Laurent Ballesta
Les récifs coralligènes se développent, selon la transparence de l’eau, entre -12 et -120 mètres de profondeur sous forme de massifs ou de tombants verticaux (Ballesteros, 2006) (Figure 2). Seuls récifs calcaires d’origine biogène* en Méditerranée, ils résultent principalement de l’accumulation lente (1 à 4 mm / an) d’algues calcaires sciaphiles* (majoritairement des corallines (Figure 3), (Ballesteros, 2006; Laborel, 1961; Laubier, 1966; Sartoretto et al., 1996) et d’animaux bio-constructeurs comme les bryozoaires, les serpulidés, les cnidaires, les mollusques, les éponges, les crustacés et les foraminifères (Hong, 1980; Ros et al., 1985) sur de longues périodes (estimation de l’âge moyen entre 25 et 200 ans) (Garrabou et Ballesteros, 2000; Teixidó et al., 2011). D’autres espèces dites érodeuses, appartenant à des groupes variés (éponges, annélides, mollusques), creusent des galeries dans lesquelles vit une endofaune* riche (903 espèces ont par exemple été trouvées dans 370 g de poids sec de récif ; Ballesteros 2006). Servant de support de fixation et d’habitat pour de nombreux organismes, les récifs coralligènes présentent une richesse, une biomasse et une productivité équivalent à celles des assemblages de récifs coralliens tropicaux (Bianchi, 2001).

Figure 3 : Algues corallines constructrices de récifs coralligènes © Florian Holon
Plus de 1800 espèces sont associées aux récifs coralligènes (représentant 15 à 20 % des espèces connues de la Méditerranée), parmi lesquelles figurent plusieurs espèces protégées ou commerciales telles que le corail rouge, le chapon, le mérou brun, l’oursin diadème, la langouste ou la grande cigale de mer (Ballesteros, 2006; Bianchi et Morri, 2000; Coll et al., 2010). Toutefois la diversité en espèces (diversité taxonomique) n’est pas la seule à être particulièrement élevée dans ces récifs. En effet, les diversités fonctionnelle* et phylogénétique*, deux autres types de diversités biologiques y sont également fortes. Sur un site donné, les diversités fonctionnelle et phylogénétique augmentent à mesure que l’on se rapproche de la surface. Toutefois, plus les sites sont profonds et plus les communautés (assemblages d’espèces) sont différentes entre elles, notamment entre -50 et -70 m où les différences sont les plus fortes (Doxa et al., 2016). Peu de données existent sur les capacités de dispersion des espèces associées aux récifs coralligènes (voir le regard R60) mais pour les quelques espèces longévives étudiées, les distances varient de quelques dizaines de centimètres pour le corail rouge à 160 km pour les gorgones rouges (Ledoux et al., 2010; Mokhtar-Jamaï et al., 2011).
Egalement connues pour leur grande valeur esthétique, les récifs coralligènes constituent des zones privilégiées pour le tourisme sous-marin et la plongée loisir. Les préférences humaines pour certains sites sont principalement expliquées par la présence d’organismes de type arbustif, aux couleurs vives et présentant des contrastes intenses (Tribot et al., soumis). En France, ces sites sont particulièrement présents aux alentours de Marseille, Hyères et au Nord de la Corse (Tribot et al., soumis).
2.Une répartition large mais morcelée
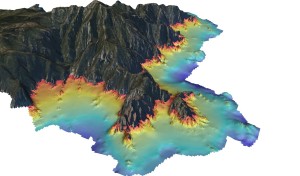
Figure 4: Modèle Numérique de Terrain d’une bathymétrie fine (pixel de 2 m) pour la cartographie des récifs coralligènes. (en gris la zone terrestre, en rouge la zone -10 m et en bleu foncé la zone à -60 m) © Andromède océanologie
Les récifs coralligènes sont largement (2763 km²) présents sous formes d’ilots le long des côtes Méditerranéennes mais leur répartition exacte n’est pas encore entièrement connue (Giakoumi et al., 2013). Sur la base des données existantes (principalement au Nord du bassin), des modèles prenant en compte la bathymétrie*, l’inclinaison des fonds et l’apport en nutriment prédisent une répartition plus importante en mer Egée et Adriatique (Martin et al., 2014).
Depuis 2014, date de la première cartographie fine et continue (résolution de 20 m) des habitats côtiers français en Méditerranée, nous savons que les 1700 km de côtes françaises Méditerranéennes abritent 2 661 ha de récifs coralligènes « aplatis » sur une carte 2D ou 2932 ha si on prend en compte la verticalité (carte 3D) de cet habitat (Holon F., 2015, Figure 4). Toutefois, ce chiffre ne considère pas le volume véritablement représenté par cet habitat de par les différentes strates (encroûtante à arbustive) d’organismes qu’il fixe et l’endofaune qu’il abrite de par sa structure intra-récif complexe (réseau de galeries ;Ballesteros, 2006). Ce volume serait particulièrement intéressant à connaître puisque directement en lien avec les capacités de stockage de CO2 des récifs coralligènes et les risques de relargage en cas d’acidification de l’eau de mer dans les prochaines décennies (Martin et Gattuso, 2009; Noisette et al., 2013; Martin et al., 2013).
3.Activités humaines et menaces autour des récifs coralligènes
Les perturbations d’origine anthropique directe ou indirecte auxquelles les récifs coralligènes (voir Regard RO2) sont soumis comprennent principalement les dommages mécaniques causés par des pratiques de pêche destructrices, la pollution, la sédimentation, la fréquentation par les plongeurs, les invasions biologiques, les foyers de mortalité de masse liée à des anomalies de température, et les effets synergiques de ces facteurs de stress (Ballesteros, 2003; Cebrian et al., 2012; Piazzi et al., 2012, 2005; Teixidó et al., 2013).
De manière générale, la pollution empêche la bio-construction et entraine un appauvrissement biologique (nombre et quantité d’espèces) au profit d’espèces généralistes et érodeuses ( Hong, 1983, 1980; CAR/ASP, 2003). L’impact des polluants à proprement parler reste peu connu, mais on sait que les ions orthophosphates (H2PO4– , HPO42-, PO43- ), présents dans certains engrais utilisés en agriculture par exemple peuvent empêcher la calcification (Simkiss, 1964) à l’origine même de la construction des récifs. Des apports sédimentaires trop élevés (eaux usées ou fonds remués) sont à l’origine d’un excès de sédiments recouvrant le thalle* des algues encroûtantes, limitant ainsi leur accès à la lumière et donc leur développement (Laborel, 1961) ou limitant le recrutement de nouveaux individus (Sartoretto, 1996).
La pêche au chalut de fond est, quant à elle, à l’origine de la destruction de grandes zones coralligènes par destruction directe des récifs ou par augmentation de la turbidité et de la sédimentation (Boudouresque et al., 1990). La pêche du corail rouge a aussi été la cause de grandes destructions de récifs coralligènes, comme cela a été rapporté par Ortiz (1986) qui décrit que pour 15 kg de corail rouge pêchés, 50 kg d’organismes benthiques (principalement des gorgones) ont été prélevés en mer d’Alboran. De même, les pêches traditionnelles et de loisirs en ciblant préférentiellement certaines espèces ont des conséquences négatives sur les écosystèmes coralligènes car entrainant un déséquilibre dans les diversités (Bell, 1983; Garcia-Rubies et Zabala, 1990).
Ainsi des études ont mis en évidence l’impact de la plongée loisir sur les gorgones (Linares et al., 2005), les bryozoaires (Sala et al., 1996; De La Nuez-Hernández et al., 2014), les ascidies (Luna-Pérez et al., 2011, 2010; Naranjo et al., 1996) ou les poissons Il apparaît ainsi que la présence sur le long terme de nombreux plongeurs cumulés sur une période estivale restreinte engendre un impact négatif significatif sur les communautés coralligènes (Plathong et al., 2000; Tratalos et Austin, 2001), par la remise en suspension d’argile limoneux ou par contact physique (fragmentation ou dommages tissulaires) (Barker et Roberts, 2004; Luna-Pérez et al., 2009; Uyarra et Côté, 2007). Il a par exemple été observé qu’en un an, après ouverture aux plongeurs d’un site jusqu’alors protégé, la densité du bryozoaire Pentapora fascialis a été divisée par deux aux îles Mèdes (Garrabou et al., 1998).
Cette présence intensive de plongeurs peut également induire des modifications au niveau du type d’espèces présent dans les récifs coralligènes. En effet, en présence de pressions de fortes intensités, les communautés coralligènes pourraient être dominées par des organismes incrustants ou massifs au détriment des espèces érigées trop exposées aux mouvements des plongeurs (Garrabou et al., 1998).
Les activités humaines sont aussi à l’origine de l’entrée de nouvelles espèces en Méditerranée, que ce soit par le trafic maritime, l’ouverture du canal de Suez, ou encore l’importation de coquillages, etc. Certaines espèces d’algues introduites ont la capacité d’envahir le coralligène et le menacent. C’est le cas par exemple de la petite algue rouge Womersleyella setacea (Athanasiadis, 1997) qui recouvre les algues constituant le concrétionnement coralligène en formant un tapis dense. Cette espèce exotique envahissante bloque ainsi l’accès à la lumière, accroit le piégeage sédimentaire (Airoldi et al., 1995) et entre en compétition avec d’autres espèces autochtones (Ballesteros, 1998; Piazzi et al., 2002), entrainant, de ce fait, une destruction du récif. D’autres algues peuvent envahir les récifs coralligènes comme Caulerpa taxifolia qui a envahi des communautés coralligènes au Cap Martin (Meinesz, 1999), ou encore Asparagopsis taxiformis (Ballesteros and Rodriguez-Prieto, 1996) et Lophocladia lallemandii (Patzner, 1998) aux Baléares.
Enfin, le changement climatique peut aussi toucher les récifs coralligènes malgré leur profondeur. Un réchauffement plus long et fort des eaux en été 1999 a par exemple entrainé une vague de mortalité importante notamment des gorgones (Ben Mustapha et El Abed, 2001; Perez et al., 2000; Romano et al., 2000) quand une tempête est capable de détruire jusqu’à la moitié des espèces d’un site comme en 2008 aux îles Mèdes (Espagne) (Teixidó et al. 2013).
4.Un habitat sous surveillance

Figure 5 : Plongeur en recycleur (circuit fermé) réalisant des quadrats photographiques sur un récif coralligène selon la méthode de Deter et al. (2012b). © Andromède océanologie
En dépit de leur valeur économique et écologique, les récifs coralligènes restent encore mal connus. En effet, leur localisation profonde plus difficile d’accès, mais aussi leur forte diversité et leur dynamique lente rendent cet écosystème difficile à étudier (Kipson et al., 2011). Toutefois, les travaux sur cet écosystème (et sur les écosystèmes marins en général) se multiplient et la connaissance augmente grâce à la directive cadre stratégie pour le milieu marin (DCSMM, 2008/56/CE) qui fixe les principes suivis par les États membres de l’Union Européenne afin d’atteindre un bon état écologique des eaux marines d’ici 2020. Cette directive a un objectif de développement durable : elle vise à maintenir ou rétablir un bon fonctionnement des écosystèmes marins (diversité biologique conservée et interactions correctes entre les espèces et leurs habitats, océans dynamiques et productifs) tout en permettant l’exercice des usages en mer pour les générations futures. Quelques indices ont ainsi été récemment proposés pour suivre et évaluer l’état de santé des communautés coralligènes ou la qualité des eaux qui les environnent comme le COARSE (COralligenous Assessment by ReefScape Estimation; Gatti et al., 2015) basé sur des observations directes ou le CAI (Coralligenous Assemblage Index; Deter et al., 2012b) et l’ESCA (Ecological Status of Coralligenous Assemblages; Cecchi et al., 2014) basés sur des analyses photographiques (Figure 5). En France, le réseau de surveillance RECOR soutenu par l’Agence de l’eau recueille depuis 2010 des quadrats photographiques et des données descriptives concernant cet habitat sur 169 stations réparties entre 17 et 90 mètres de profondeur (données disponibles sur la plateforme cartographique Medtrix sur www.medtrix.fr). Des projets participatifs voient également le jour pour évaluer biodiversité (Lagourgue, 2015) et/ou intérêt paysager (Medobs-sub) de ces récifs.
5.Conclusion
Pour conclure, à l’instar des récifs coralliens (construits par des animaux associés à des algues unicellulaires en eaux éclairées) pour les pays tropicaux, les récifs coralligènes (construits par des algues en eaux peu éclairées) ont tout pour devenir un symbole à protéger pour les pays côtiers Méditerranéens. En effet la forte et belle biodiversité qu’ils abritent présente un intérêt de conservation en soi mais aussi halieutique comme touristique. Les connaissances sur cet écosystème sont longtemps restées parcellaires mais sont en train de fortement se développer. Restent à préserver et à faire connaitre les atouts et la fragilité de cet habitat.
Glossaire :
* Bathymétrie : domaine scientifique visant à cartographier la profondeur et le relief des fonds océaniques et marins
*Biogène : issu de l’activité biologique
*Biodiversité ou diversité biologique : diversité des organismes vivants et des écosystèmes
*Diversité fonctionnelle : richesse en fonctions/rôles écologiques (différents régimes alimentaires par exemple)
*Diversité phylogénétique : diversité relative aux liens de parenté entre taxons
*Endofaune : animaux vivant enfouis dans le substrat
*point chaud de biodiversité (« biodiversity hotspot ») : une zone particulièrement riche d’un point de vue de la diversité biologique
*Maerl : substrat biogène constitué principalement par des algues rouges calcaires s’accumulant dans les fonds marins vaseux ou sablonneux
*Sciaphile : se dit d’une espèce qui se développe préférentiellement en zone d’ombre
*Thalle : appareil végétatif d’un organisme vivant ne possédant ni feuilles, ni tiges, ni racines (ex : algue, champignon, lichen, mousse…)
Références :
Directive habitat 92/43/CEE, code 1170-14: Reefs, coralligenous assemblage
Airoldi, L., Rindi, F., Cinelli, F., 1995. Structure, Seasonal Dynamics and Reproductive Phenology of a Filamentous Turf Assemblage on a Sediment Influenced, Rocky Subtidal Shore. Mar. Bot. 38.
Athanasiadis, a., 1997. North Aegean Marine Algae. IV. Womersleyella setacea (Hollenberg) R. E. Norris (Rhodophyta, Ceramiales). Bot. Mar. 40, 473–476. doi:10.1515/botm.1997.40.1-6.473
Ballesteros, E., 2006. Mediterranean coralligenous assemblages: a synthesis of present knowledge. Oceanogr. Mar. Biol. An Annu. Rev. 44, 123–195.
Ballesteros, E., 2003. The coralligenous in the Mediterranean Sea: Definition of the coralligenous assemblage in the Mediterranean, its main builders, its richness and key role in benthic ecology as well as its threats. Proj. Prep. a Strateg. Action Plan Conserv. Biodivers. Mediterr. Reg. (SAP BIO). RAC/SPA—Regional Act. Cent. Spec. Prot. Areas.
Ballesteros, E., 1998. Addicions a la fauna d’invertebrats bentònics marins de l’Arxipèlag de Cabrera (Illes Balears, Mediterrània Occidental). Bolletí de la Societat d’Història Natural de les Balears, 41: 41-48. Bolletí Soc. Història Nat. Balear. 41, 41–48.
Ballesteros, E., Rodriguez-Prieto, C., 1996. Preséncia d’Asparagopsis taxiformis (Delile) Trevisan a Balears. Boll. Soco Hist. Nat. Balear. 39, 135–138.
Barker, N.H.L., Roberts, C.M., 2004. Scuba diver behaviour and the management of diving impacts on coral reefs. Biol. Conserv. 120, 481–489. doi:10.1016/j.biocon.2004.03.021
Bell, J.D., 1983. Effects of Depth and Marine Reserve Fishing Restrictions on the Structure of a Rocky Reef Fish Assemblage in the North-Western Mediterranean Sea. J. Appl. Ecol. 20, 357–369. doi:10.2307/2403513
Ben Mustapha, K., El Abed, A., 2001. Données nouvelles sur des éléments du macro benthos de Tunisie. Rapp. la Comm. Int. la Mer Méditerranée 36, 358.
Bianchi, C.N., 2001. La biocostruzione negli ecosistemi marini e la biologia marina italiana. Biol. Mar. Mediterr. 8, 112–130.
Bianchi, N., Morri, C., 2000. Marine biodiversity of the Mediterranean Sea: situation, problems and prospects for future research. Mar. Pollut. Bull. 40, 367–376. doi:10.1016/S0025-326X(00)00027-8
Boudouresque, C.F., Meinesz, A., Ballesteros, E., Ben Maiz, N., Boisset, F., Cinelli, F., Cirik, S., Cormaci, M., Jeudy de Grissac, A., Laborel, J., Lanfranco, E., Lundberg, B., Mayhoub, H., Panayotidis, P., Semroud, R., Sinnassamy, J.M., Span, A., 1990. Livre Rouge “Gérard Vuignier” des végétaux, peuplements et paysages marins menacés de Méditerranée. MAP Tech. Rep. Ser. 43. UNEP/IUCN/GIS Posidonie. Athens. 250.
CAR/ASP – Centre d’Activités Régionales pour les Aires Spécialement Protégés, 2003. Le coralligène en Méditerranée. Proj. pour la préparation d’un Plan d’Action Strat. pour la Conserv. la Biodiversité dans la Région Méditerranéenne (PAS – BIO).
Cebrian, E., Linares, C., Marschal, C., Garrabou, J., 2012. Exploring the effects of invasive algae on the persistence of gorgonian populations. Biol. Invasions 14, 2647–2656. doi:10.1007/s10530-012-0261-6
Cecchi, E., Gennaro, P., Piazzi, L., Ricevuto, E., Serena, F., 2014. Development of a new biotic index for ecological status assessment of Italian coastal waters based on coralligenous macroalgal assemblages. Eur. J. Phycol. 49, 298–312. doi:10.1080/09670262.2014.918657
Coll, M., Piroddi, C., Steenbeek, J., Kaschner, K., Lasram, F.B.R., Aguzzi, J., Ballesteros, E., Bianchi, C.N., Corbera, J., Dailianis, T., Danovaro, R., Estrada, M., Froglia, C., Galil, B.S., Gasol, J.M., Gertwage, R., Gil, J., Guilhaumon, F., Kesner-Reyes, K., Kitsos, M.S., Koukouras, A., Lampadariou, N., Laxamana, E., de la Cuadra, C.M.L.F., Lotze, H.K., Martin, D., Mouillot, D., Oro, D., Raicevich, S., Rius-Barile, J., Saiz-Salinas, J.I., Vicente, C.S., Somot, S., Templado, J., Turon, X., Vafidis, D., Villanueva, R., Voultsiadou, E., 2010. The biodiversity of the Mediterranean Sea: Estimates, patterns, and threats. PLoS One 5. doi:10.1371/journal.pone.0011842
Coma, R., Polà, E., 1999. Seguiment temporal de la gorgònia Paramuricea clavata de les illes Medes. Exercici 1999. Univ. Barcelona. Ined.
Coma, R., Polà, E., Zabala, M., Ros, J., 2001. Effect of recreational activity on the coralligenous community: a decade of assessment of demographic parameters of the gorgonian Paramuricea clavata. Poster Present. Eur. Mar. Biol. Symp. Maó, Menorca.
De La Nuez-Hernández, D., Valle, C., Forcada, A., Correa, J.M.G., Fernández Torquemada, Y., 2014. Assessing the erect bryozoan Myriapora truncata (Pallas, 1766) as indicator of recreational diving impact on coralligenous reef communities. Ecol. Indic. 46, 193–200. doi:10.1016/j.ecolind.2014.05.035
Defant, A., 1961. Physical Oceanography, Pergamon P. ed.
Deter, J., Descamp, P., Ballesta, L., Boissery, P., Holon, F., 2012a. A preliminary study toward an index based on coralligenous assemblages for the ecological status assessment of Mediterranean French coastal waters. Ecol. Indic. 20, 345–352.
Deter, J., Descamp, P., Boissery, P., Ballesta, L., Holon, F., 2012b. A rapid photographic method detects a depth gradient in coralligenous assemblages. Journ. of Exp. Biol. 20, 418-419; 75-82.
Doxa, A., Holon, F., Deter, J., Villeger, S., Boissery, P., Mouquet, N., 2016. Mapping biodiversity in three-dimensions challenges marine conservation strategies: The example of coralligenous assemblages in North-Western Mediterranean Sea. Ecol. Indic. 61, 1042–1054. doi:10.1016/j.ecolind.2015.10.062
Garcia-Rubies, a, Zabala, M., 1990. Effects of total fishing prohibition on the rocky fish assemblages of Medes Islands marine reserve (NW Mediterranean). Sci. Mar.
Garrabou, J., Ballesteros, E., 2000. Growth of Mesophyllum alternans and Lithophyllum frondosum (Corallinales, Rhodophyta) in the northwestern Mediterranean. Eur. J. Phycol. 35, 1–10. doi:10.1080/09670260010001735571
Garrabou, J., Sala, E., Arcas, A., Zabala, M., 1998. The impact of diving on rocky sublittoral communities: a case study of a bryozoan population. Conserv. Biol. 12, 302–312. doi:10.1046/j.1523-1739.1998.96417.x
Gatti, G., Bianchi, C.N., Morri, C., Montefalcone, M., Sartoretto, S., 2015. Coralligenous reefs state along anthropized coasts: Application and validation of the COARSE index, based on a rapid visual assessment (RVA) approach. Ecol. Indic. 52, 567–576. doi:10.1016/j.ecolind.2014.12.026
Giakoumi, S., Sini, M., Gerovasileiou, V., Mazor, T., Beher, J., Possingham, H.P., Abdulla, A., Çinar, M.E., Dendrinos, P., Gucu, A.C., Karamanlidis, A. a., Rodic, P., Panayotidis, P., Taskin, E., Jaklin, A., Voultsiadou, E., Webster, C., Zenetos, A., Katsanevakis, S., 2013. Ecoregion-Based Conservation Planning in the Mediterranean: Dealing with Large-Scale Heterogeneity. PLoS One 8. doi:10.1371/journal.pone.0076449
Holon, F., 2015. Interactions entre écosystèmes marins et pressions anthropiques. Applications au suivi et à la gestion des eaux côtières de la mer Méditerranée. Thèse de l’université de Montpellier. Accessible sur https://tel.archives-ouvertes.fr/tel-01279487v1
Hong, J.-S., 1980. Etude faunistique d’un fond de concrétionnement de type coralligène soumis à un gradient de pollutrion en Méditerranée nord-occidentale (Golfe de Fos). Thèse Dr. Univ. Aix-Marseille II 1–268.
Kipson, S., Fourt, M., Teixidó, N., Cebrian, E., Casas, E., Ballesteros, E., Zabala, M., Garrabou, J., 2011. Rapid biodiversity assessment and monitoring method for highly diverse benthic communities: A case study of mediterranean coralligenous outcrops. PLoS One 6, 11–13. doi:10.1371/journal.pone.0027103
Laborel, J., 1961. Le concrétionnement algal “coralligène” et son importance géomorphologique en Méditerranée. Recl. des Trav. la Stn. Mar. d’Endoume. 23, 37–60.
Lagourgue, L., 2015. Etat des lieux de la science participative sur les algues et proposition de voies d’utilisation et de valorisation des données intrantes. Rapport de master GIBioTE de l’université de Montpellier et de l’université de Sherbrooke
Laubier, L., 1966. Le coralligène des Albères: monographie biocénotique. Ann. l’Institut Océanographique Monaco. 43 139-316.
Ledoux, J.B., Garrabou, J., Bianchimani, O., Drap, P., Féral, J.P., Aurelle, D., 2010. Fine-scale genetic structure and inferences on population biology in the threatened Mediterranean red coral, Corallium rubrum. Mol. Ecol. 19, 4204–4216. doi:10.1111/j.1365-294X.2010.04814.x
Linares, C., Coma, R., Diaz, D., Zabala, M., Hereu, B., Dantart, L., 2005. Immediate and delayed effects of a mass mortality event on gorgonian population dynamics and benthic community structure in the NW Mediterranean Sea. Mar. Ecol. Prog. Ser. 305, 127–137. doi:10.3354/meps305127
Luna-Pérez, B., Valle, C., Sánchez-Lizaso, J.L., 2009. Benthic impacts of recreational divers in a mediterranean marine protected area. ICES J. Mar. Sci. 66, 517–523. doi:10.1093/icesjms/fsp020
Luna-Pérez, B., Valle, C., Vega Fernández, T., Sánchez-Lizaso, J.L., Ramos-Esplá, a. a., 2010. Halocynthia papillosa (Linnaeus, 1767) as an indicator of SCUBA diving impact. Ecol. Indic. 10, 1017–1024. doi:10.1016/j.ecolind.2010.02.010
Luna-Pérez, B., Valle-Pérez, C., Sánchez-Lizaso, J.L., 2011. Halocynthia papillosa as SCUBA diving impact indicator: An in situ experiment. J. Exp. Mar. Bio. Ecol. 398, 33–39. doi:10.1016/j.jembe.2010.11.013
Marion, A.F., 1883. Esquisse d’une topographie zoologique du Golfe de Marseille. Annales du Musée d’Histoire Naturelle de Marseille, 1 : 1-108.
Martin, C.S., Giannoulaki, M., De Leo, F., Scardi, M., Salomidi, M., Knitweiss, L., Pace, M.L., Garofalo, G., Gristina, M., Ballesteros, E., Bavestrello, G., Belluscio, a., Cebrian, E., Gerakaris, V., Pergent, G., Pergent-Martini, C., Schembri, P.J., Terribile, K., Rizzo, L., Ben Souissi, J., Bonacorsi, M., Guarnieri, G., Krzelj, M., Macic, V., Punzo, E., Valavanis, V., Fraschetti, S., 2014. Coralligenous and maërl habitats: predictive modelling to identify their spatial distributions across the Mediterranean Sea. Sci. Rep. 4, 1–8. doi:10.1038/srep05073
Martin, S., Gattuso, J.-P., 2009. Response of Mediterranean coralline algae to ocean acidification and elevated temperature. Glob. Chang. Biol. 15, 2089–2100. doi:10.1111/j.1365-2486.2009.01874.x
Meinesz, A., 1999. Killer Algae, The True Tale of Biological Invasion. Univ. Chicago. Chicago London. doi:10.1016/S0006-3207(00)00054-9
Milazzo, M., Anastasi, I., Willis, T.J., 2006. Recreational fish feeding affects coastal fish behavior and increases frequency of predation on damselfish Chromis chromis nests. Mar. Ecol. Prog. Ser. 310, 165–172. doi:10.3354/meps310165
Mokhtar-Jamaï, K., Pascual, M., Ledoux, J.B., Coma, R., Féral, J.P., Garrabou, J., Aurelle, D., 2011. From global to local genetic structuring in the red gorgonian Paramuricea clavata: The interplay between oceanographic conditions and limited larval dispersal. Mol. Ecol. 20, 3291–3305. doi:10.1111/j.1365-294X.2011.05176.x
Naranjo, S. a., Carballo, J.L., García-Gómez, J.C., 1996. Effects of environmental stress on ascidian populations in Algeciras Bay (southern Spain). Possible marine bioindicators? Mar. Ecol. Prog. Ser. 144, 119–131. doi:10.3354/meps144119
Noisette, F., Egilsdottir, H., Davoult, D., Martin, S., 2013. Physiological responses of three temperate coralline algae from contrasting habitats to near-future ocean acidification. J. Exp. Mar. Bio. Ecol. 448, 179–187. doi:10.1016/j.jembe.2013.07.006
Ortiz, A., Masso, C., Soriano, O., Limia, J., 1986. La barra italiana como arte depesca del coral rojo (Corallium rubrum L.) en el mar de Albor n (SE de Espa¤a). Boletín Inst. Español Oceanogr. 3, 83–92.
Patzner, R. a., 1998. The invasion of Lophocladia (Rhodomelaceae, Lophotaliae) at the northern coast of Ibiza (western Mediterranean Sea). Bolletí la Soc. d’Història Nat. Balear. 41, 75–80.
Perez, T., Garrabou, J., Sartoretto, S., Harmelin, J.-G., Francour, P., Vacelet, J., 2000. Mortalité massive d’invertébrés marins : un événement sans précédent en Méditerranée nord-occidentale. Comptes Rendus l’Académie des Sci. – Ser. III – Sci. la Vie 323, 853–865. doi:10.1016/S0764-4469(00)01237-3
Piazzi, L., Balata, D., Ceccherelli, G., Cinelli, F., 2005. Interactive effect of sedimentation and Caulerpa racemosa var. cylindracea invasion on macroalgal assemblages in the Mediterranean Sea. Estuar. Coast. Shelf Sci. 64, 467–474. doi:10.1016/j.ecss.2005.03.010
Piazzi, L., Gennaro, P., Balata, D., 2012. Threats to macroalgal coralligenous assemblages in the Mediterranean Sea. Mar. Pollut. Bull. 64, 2623–2629. doi:10.1016/j.marpolbul.2012.07.027
Piazzi, L., Pardi, G., Balata, D., Cecchi, E., Cinelli, F., 2002. Seasonal dynamics of a subtidal north-western Mediterranean macroalgal community in relation to depth and substrate inclination. Bot. Mar. 45, 243–252. doi:10.1515/BOT.2002.023
Plathong, S., Inglis, G.J., Huber, M.E., 2000. Effects of self-guided snorkeling trails on corals in a tropical marine park. Conserv. Biol. 14, 1821–1830. doi:10.1046/j.1523-1739.2000.99301.x
Romano, J.C., Bensoussan, N., Younes, W. a N., Arlhac, D., 2000. Anomalie thermique dans les eaux du golfe de Marseille durant l’ete 1999. Une explication partielle de la mortalite d’invertebres fixes? Comptes Rendus l’Academie des Sci. – Ser. III 323, 415–427. doi:10.1016/S0764-4469(00)00141-4
Ros, J., Romero, J., Ballesteros, E., Gili, J., 1985. The circalittoral hard bottom communities: the coralligenous. Margalef Ed. West. Mediterr. Pergamon Press. Oxford 263–273.
Sala, E., Garrabou, J., Zabala, M., 1996. Effects of diver frequentation on Mediterranean sublittoral populations of the bryozoan Pentapora fascialis. Mar. Biol. 126, 451–459.
Sartoretto, S., 1996. Vitesses de croissance et de bioérosion des concrétionnements «coralligènes» de Méditerranée nord-occidentale. Rapport avec les variations Holocènes du niveau marin. Trav. Univ. – Thèse Nouv. Dr. Univ. d’Aix-Marseille 2 60.
Sartoretto, S., Verlaque, M., Laborel, J., 1996. Age of settlement and accumulation rate of submarine “coralligène” (−10 to −60 m) of the northwestern Mediterranean Sea; relation to Holocene rise in sea level. Mar. Geol. 130, 317–331. doi:10.1016/0025-3227(95)00175-1
Simkiss, K., 1964. Phosphates As Crystal Poisons of Calcification. Biol. Rev. Camb. Philos. Soc. 39, 487–505. doi:10.1111/j.1469-185X.1964.tb01166.x
Teixidó, N., Casas, E., Cebrián, E., Linares, C., Garrabou, J., 2013. Impacts on Coralligenous Outcrop Biodiversity of a Dramatic Coastal Storm. PLoS One 8. doi:10.1371/journal.pone.0053742
Teixidó, N., Garrabou, J., Harmelin, J.G., 2011. Low dynamics, high longevity and persistence of sessile structural species dwelling on mediterranean coralligenous outcrops. PLoS One 6. doi:10.1371/journal.pone.0023744
Tratalos, J. a, Austin, T.J., 2001. Impacts of recreational SCUBA diving on coral communities of the Carribean island of Gran Cayman. Biol. Conserv. 102, 67–75.
Tribot, A.-S., Mouquet, N., Villéger, S., Raymond, M., Hoff, F., Boissery, P., Holon, F., Deter, J., Soumis. Taxonomic and functionnal diversity increase the aesthetic value of coralligenous reefs.
Uyarra, M.C., Côté, I.M., 2007. The quest for cryptic creatures: Impacts of species-focused recreational diving on corals. Biol. Conserv. 136, 77–84. doi:10.1016/j.biocon.2006.11.006
Le texte de ce regard est sous licence Creative Commons by-sa 4.0.
Article édité et mis en ligne par Benoit Goussen


Commentaires récents