La Société Française d’Ecologie (SFE) vous propose ce regard de François Bonhomme, Directeur de Recherche à l’Institut des Sciences de l’Evolution de Montpellier, sur les mécanismes de la spéciation.
Ce « regard » est adapté d’un article du même titre et même auteur, paru dans le n°18 d’Espèces (éditrice: Cécile Breton), version éditée pour cette plateforme SFE par Anne Teyssèdre.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
Le doigt de Darwin
par François Bonhomme, Directeur de Recherche CNRS,
Institut des Sciences de l’Evolution de Montpellier (ISEM)
——-
Mots clés : Evolution, adaptation, spéciation, mécanismes, spéciation écologique
——–
Si les adaptations, spectaculaires ou non, existent bel et bien, quel rôle jouent-elles dans la formation de nouvelles espèces et pourquoi nous semble-t-il souvent plus naturel de penser qu’elles sont la cause plutôt que la conséquence de cette diversification ? C’est l’objet de ce regard qui vise à questionner le paradigme répandu dans les médias scientifiques mais aussi dans la littérature de vulgarisation, selon lequel la puissance des mécanismes d’adaptation différentielle des organismes aux conditions locales d’environnement est telle qu’elle sépare relativement facilement les génomes des populations concernées en entités reproductivement isolées, constitutives alors d’espèces différentes. (Voir par exemple le n°480 du magazine La Recherche consacré à ce sujet en septembre 2013, dans l’éditorial duquel on peut lire : «On découvre que deux espèces peuvent diverger même sans séparation géographique. Il n’est pas exclu qu’au final ce soit même le cas de figure le plus fréquent.»)
Comment passe-t-on d’une à deux espèces ?
Le sujet est suffisamment vaste pour qu’il soit impossible d’en faire le tour en quelques lignes. A condition bien sûr qu’on se place dans une perspective transformiste et non pas fixiste, il est une question fondamentale qui se pose aux observateurs du monde vivant depuis les philosophes grecs jusqu’aux évolutionnistes modernes. Question qui se présente sous deux facettes complémentaires, bien qu’elles n’aient pas toujours été clairement séparées l’une de l’autre: celle de la diversification des espèces en entités génétiquement séparées(cladogénèse ) et celle de leur évolution phénotypique et/ou adaptative éventuelle au fil du temps (anagénèse). En se focalisant sur la première facette, la question fondamentale est de savoir comment se produit le passage d’une à deux (ou plusieurs) entités nouvelles. Dans ce questionnement, les rôles respectifs de l’adaptation et de l’isolement géographique comme moteur principal de la mise en place d’une barrière reproductive ont fait et font toujours l’objet de nombreux débats.
Pour faire simple, plusieurs visions sont en lice pour attribuer à l’un ou l’autre mécanisme le rôle principal dans la séparation des espèces, ou spéciation. L’une considère que le mode prépondérant est celui de la spéciation par isolement géographique (on dit aussi par vicariance ou en allopatrie, ou sans flux de gènes) : A la suite d’un événement initial de séparation physique dans l’espace que les génomes, évoluant chacun pour leur propre compte, divergent progressivement jusqu’à devenir mutuellement incompatibles de sorte que, lorsqu’un improbable événement de remise en contact survient au bout d’un temps suffisamment long, on constate que les individus ne sont plus capables de se croiser librement ou que leurs descendances sont stériles. Ce dernier point est le critère le plus généralement admis pour dire qu’on a alors affaire de manière certaine à deux espèces distinctes, si l’on excepte le cas particulier des allopolyploïdes chez les plantes notamment. Ce modèle a été largement popularisé, par exemple par Ernst Mayr (1984).
L’autre mécanisme proposé comme important ne fait pas appel à un isolement préalable de deux populations, mais stipule plutôt que c’est la force de l’adaptation différentielle à des contrastes environnementaux ou à des conditions de vie distinctes au sein du même biotope qui, peu à peu, transforme un pool génique unique en deux sous-ensembles distincts. Ces adaptations différentielles limiteraient les échanges de gènes entre les deux pools, ceci conduisant alors progressive-ment à leur isolement reproductif plus ou moins complet. L’unité de lieu ayant été respectée dès le début – comme dans les meilleures pièces du théâtre classique –, on parle alors de spéciation écologique, en sympatrie ou avec flux de gènes puisque la reproduction reste possible entre les individus. Ce mode de spéciation, dont on trouve les germes déjà chez Darwin et plus nettement chez Wallace (1912, a connu un grand regain de popularité depuis les années 80 comme mentionné plus bas, et on trouvera aisément sur internet une profusion de références aux travaux d’auteurs tels que ceux cités en référence de cet article, il suffit de mettre « sympatric speciation » dans les mots-clés.
Pour expliquer que les génomes des deux futures espèces deviennent progressivement incompatibles, la première modalité fait surtout appel, après l’isolement initial, à des événements plus ou moins fortuits qui ne manquent pas de les affecter au cours du temps quoiqu’il arrive, alors que la seconde met en avant le rôle primordial de l’adaptation à des conditions de vie différentes comme moteur de la différenciation.
L’adaptation, moteur de la spéciation ?
Dans le premier cas, l’adaptation n’est pas forcément absente, mais elle est fortuite: deux lignées de la même espèce ancestrale, isolées par exemple à la suite d’une migration de part et d’autre d’une chaîne de montagnes, rencontreront éventuellement des conditions de vie différentes (climat, nourriture, parasites, etc.) et pourront développer des adaptations nouvelles leur permet-tant d’occuper des niches écologiques distinctes. Mais, même si ce n’était pas le cas et si leur niche était restée absolument inchangée depuis leur séparation, les deux espèces naissantes vont inexorablement diverger et leurs génomes devenir incompatibles au cours du temps, du fait même de leur structure matérielle qui n’est jamais figée. Ces génomes sont en effet le siège de réajustements permanents liés à des phénomènes aussi divers que la dérive génétique*, les mutations ou l’impact des éléments transposables* (qui rendent le contenu des chromosomes structurellement différents au cours du temps), ainsi qu’à des forces sélectives largement indépendantes de l’environnement qui découlent de la nécessaire coadaptation* des gènes entre eux.
Les manifestations de ces divergences peuvent être internes et affecter des processus cellulaires de base ; elles peuvent également se manifester sur le phénotype des individus comme dans le cas de la sélection sexuelle : les modifications morphologiques (apparition de certains caractères sexuels secondaires, par exemple) résultent pour l’essentiel de la compétition pour accéder aux partenaires de l’autre sexe sans que cela soit nécessairement lié à une meilleure adaptation aux conditions environnementales. Cette sélection suivra nécessairement son cours de manière indépendante dans les deux lignages, rendant leurs systèmes de reproduction et donc leurs génomes progressivement moins compatibles, jusqu’à ce que la barrière reproductive soit totale. Les lignages seront alors complètement différenciés au point de pouvoir éventuellement coexister sur le même territoire. Nous les identifierons alors avec sûreté comme des espèces différentes.
Dans le cas où, au contraire, les populations n’ont pas été préalablement séparées, le moteur proposé est l’adaptation différentielle qui résulte de la sélection naturelle pour des conditions environnementales contrastées (l’amont ou l’aval d’une rivière, la transition entre eau douce et eau salée, entre sol calcaire et sol siliceux,…) ou plus abruptes (passage d’un hôte à un autre pour un parasite). Il est facile de comprendre que les pressions de sélection diffèrent de part et d’autre de ces transitions, et que si des mutations apparaissent ou préexistent, ce n’est vraisemblablement pas les mêmes qui seront avantageuses (et donc avantagées) à chaque extrémité du gradient environnemental. Si cet impact de la sélection différentielle (on dit aussi disruptive) peut s’envisager très facilement dans l’espace d’une seule génération, toute la question est de savoir comment un tel mécanisme peut cumuler ses effets d’une génération sur l’autre malgré les échanges génétiques occasionnés par la reproduction sexuée.
Pour que cela se produise, il faut en effet contrebalancer les effets de la migration et de la reproduction qui vont avoir tendance à recombiner et réhomogénéiser les génotypes que l’adaptation différentielle avait triés. Les mécanismes invoqués pour amplifier ainsi les différences génétiques et phénotypiques stipulent par exemple que des comportements ou des adaptations particulières se mettent en place (choix d’habitat, choix de partenaire chez les animaux, morphologie de l’appareil reproducteur chez les plantes, asynchronisme de reproduction entre le haut et le bas du gradient environnemental, etc.) de telle manière que les génotypes intermédiaires soient produits en moins grand nombre qu’attendu et que cela aboutisse de facto à une réduction progressive des flux géniques par accumulation de part et d’autre du gradient d’une série de gènes d’adaptation locale. Cette réduction permettrait alors aux mêmes mécanismes de divergence génomique que ceux invoqués plus haut de se mettre en place, conduisant in fine à l’isolement reproductif de deux espèces. Cette façon de voir les choses a des racines historiques profondes, puisqu’en fait elle correspond peu ou prou à la déclinaison moderne de ce que Darwin suggérait dans la seule figure de son livre L’origine des Espèces (cf. Fig.1).
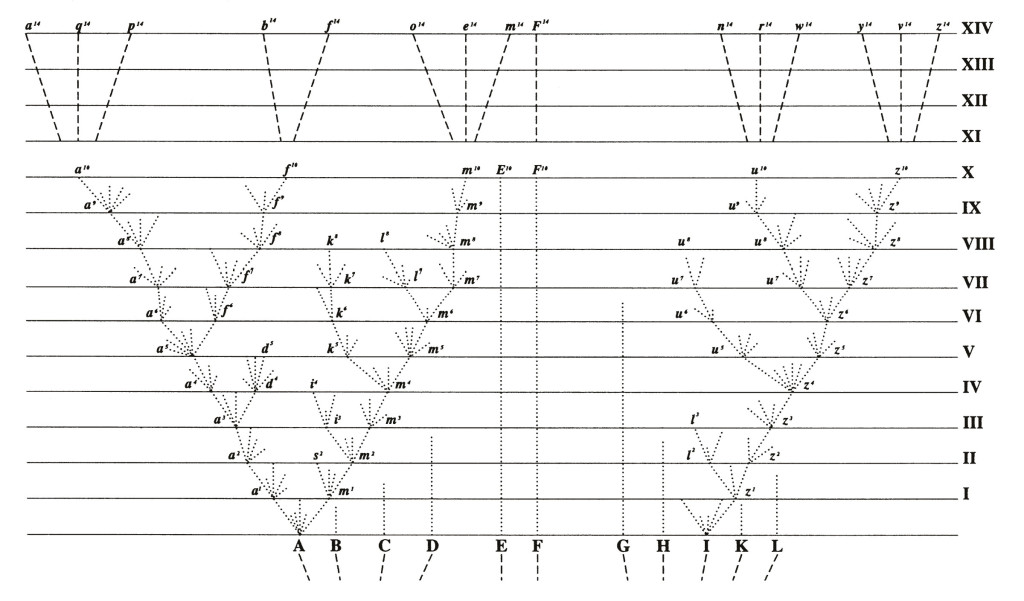
Fig.1 : L’idée somme toute assez naturelle que, pour des raisons de compétition, seules les formes les plus différentes écologiquement peuvent survivre en un lieu, avait été suggérée par Charles Darwin dans L’Origine des Espèces en 1859, livre où l’espèce est qualifiée d’”effet poussé de la variation”. Dans la seule figure de ce livre, la généalogie théorique montre de petits bouquets de variations à chaque tranche de temps. De là à penser que cette différenciation écologique est le moteur de la spéciation et non pas simplement la condition du maintien des lignages en un même lieu, il y a un pas facilement franchi bien que les cas indiscutablement étayés restent peu nombreux.
Les deux hypothèses reçoivent-elles la même attention ?
Le propos n’est pas ici de faire une revue exhaustive de ces mécanismes ni des débats théoriques qu’ils suscitent entre spécialistes. Il faudrait en effet plusieurs pages pour exposer la complexité des modèles théoriques qui cherchent à explorer sous quelles conditions les gènes qui participent à l’adaptation locale peuvent s’accumuler de part et d’autres du gradient environnemental et créer de l’isolement reproductif. Cela nécessite de prendre en compte l’importance de l’effet des mutations sur le différentiel de valeur sélective (« fitness ») entre individus, leur liaison génétique éventuelle et leur effet conjoint ou non sur des traits de reproduction ou de dispersion, ainsi que de voir comment ceci interagit avec la migration et le niveau de stabilité du milieu. Il faut aussi préciser les termes, quand on parle de sympatrie* et d’allopatrie* (parapatrie*, microallopatrie, péripatrie, stasipatrie, …) et certains auteurs vont jusqu’à proposer que là n’est pas vrai-ment la question, qu’il existe un continuum de situations allant de l’une à l’autre (Fitzpatrick et al, 2008, 2009.).
Ceci n’ôte néanmoins rien à ce qui suit car il s’agit bien plutôt de discuter d’un biais de perception (et de publication) qui découlerait de notre intérêt intrinsèque pour les phénomènes adaptatifs plutôt que pour des processus de divergence que l’on pourrait qualifier de purement mécaniques. Et curieusement, ce biais existe également dans la littérature scientifique (en tout cas c’est la thèse que nous défendons ici), car lorsqu’on regarde en effet dans une base de données bibliographique internationale avec les mots-clés “spéciation” (ou “divergence”) associés à “écologique” ou “sympatrique” plutôt qu’à “géographique” ou “allopatrique” on trouve un biais énorme en faveur des premiers tant pour le nombre d’articles concernés (3 400 et 800 respectivement pour les 25 dernières années) que pour le nombre de citations qu’ils ont reçues (109 000 et 24 500 respectivement). L’écologique ou le sympatrique attire donc quatre fois plus l’attention que le géographique ou l’allopatrique. Ceci reflète-t-il de manière adéquate l’importance du modèle sympatrique dans la nature ?
Si l’on décortique le nombre de cas d’espèces – c’est le cas de le dire – associé à ces publications (en dehors des articles purement théoriques), on s’aperçoit que la première version est associée à un relativement petit nombre d’espèces, et un peu toujours les mêmes, alors que la deuxième version recouvre une diversité beaucoup plus grande.
Deux cas d’école
Sans rentrer dans les détails de la polémique, un certain nombre de ces cas présentés comme étant de bons candidats pour être des espèces nouvelles ayant émergé de manière sympatrique ou “écologique” se sont révélés ultérieurement erronés. Ainsi, un des plus emblématiques d’entre eux est celui de la mouche du pommier nord-américaine Ragholetis pomonella, originairement inféodée à une aubépine et chez laquelle il existe désormais deux races distinctes : l’une inféodée au pommier et l’autre toujours à une aubépine.

Fig. 2 : La mouche du pommier nord-américaine, Rhagoletis pomonella (© J. Berger-Bugwood.org/Creative Commons).
Des analyses faisant appel au séquençage de différents gènes ont cependant montré que ce scénario ne reflétait pas une réalité aussi simple (Feder et al. 2003), même si Rhagoletis pomonella est toujours invariablement reprise dans la littérature comme l’exemple classique de spéciation sympatrique. Selon ces analyses, il apparaît désormais probable que plusieurs écotypes de mouches à fruit préexistaient à l’arrivée du pommier en Amérique du Nord. Celui-ci aurait “capturé” une lignée méridionale ayant divergé de la précédente il y a plus d’un million d’années et préalablement spécialisée sur une autre espèce d’aubépine. Cette lignée aurait “emprunté” par hybridation des gènes à l’écotype du nord au moment de son installation sur le pommier. Il n’y a donc pas d’indice que le mode “sympatrique” ait été impliqué dans la divergence initiale de ces écotypes, même si à l’heure actuelle les versions “pommier” et “aubépine” qu’on trouve aux États-Unis sont peut-être dans une phase de renforcement de leur isolement reproductif.
Un cas un peu analogue a été récemment rapporté pour des poissons habitant les lacs de cratères africains qui étaient considérés comme des exemples emblématiques de spéciation rapide et quasi simultanée aboutissant aux fameux “essaims d’espèces” (species flocks) apparus de manière sympatrique après une colonisation unique de chaque cratère. Des études moléculaires plus poussées (Martin et al., 2015) ont montré qu’en réalité, dans chaque cratère étudié, il fallait faire intervenir plusieurs phases de colonisation par des espèces ou sous-espèces proches suivies d’hybridation (féconde dans ce cas) entre celles-ci, pour expliquer la diversité obtenue, même si les auteurs n’excluent pas des événements subséquents de différenciation à l’intérieur de chaque cratère. Il existe de nombreux autres cas qui ne résistent pas non plus à l’analyse, que ce soit celui des épinoches de mer et celles d’eau douce, ou encore celui des formes à coquilles fine ou épaisse du bigorneau Littorina saxatilis selon qu’il habite le haut ou le bas de l’estran. Pour ces cas également, les données publiées indiquent que la séparation des lignées était en fait très ancienne, et qu’il est parfaitement possible de considérer que la divergence initiale pouvait plutôt correspondre à des épisodes d’isolement géographique ancien, comme cela s’est souvent produit suite aux oscillations climatiques du Quaternaire.
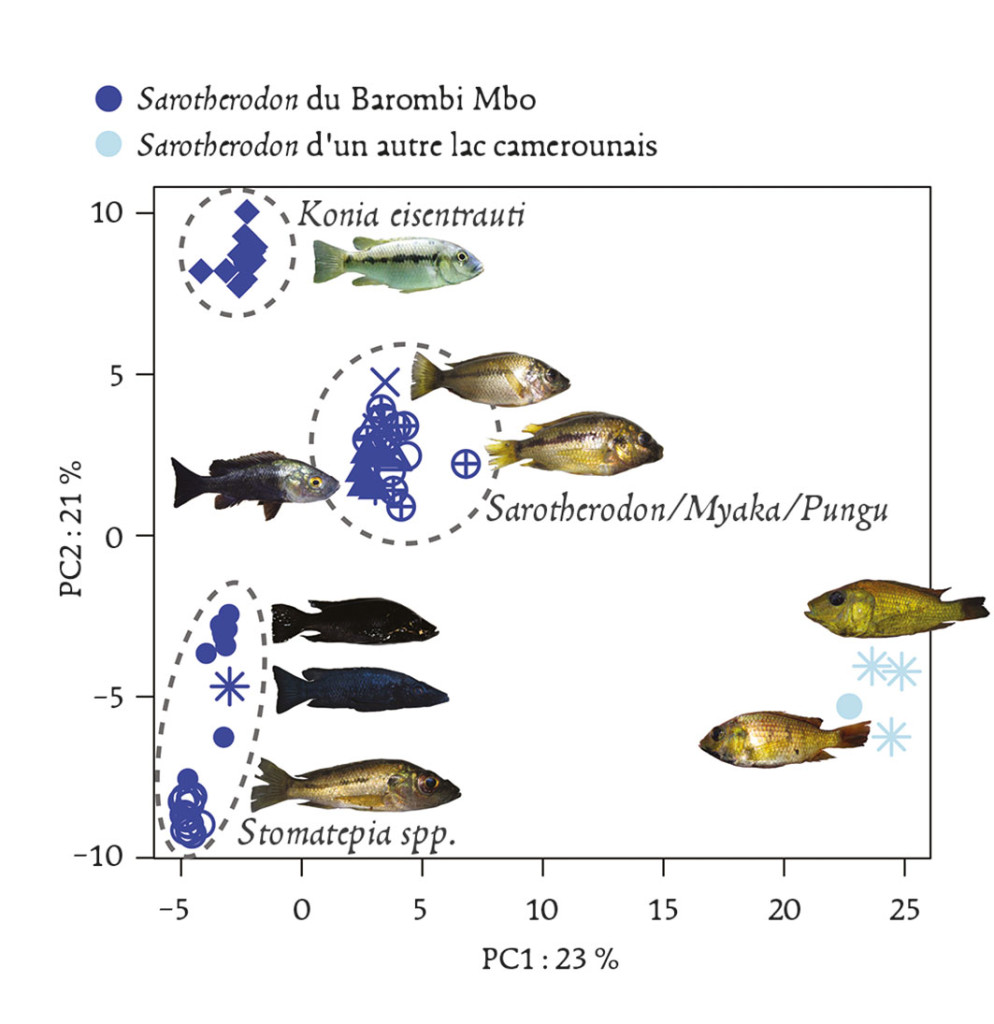
Fig. 3 : Spéciation écologique chez des cichlidés lacustres ? Le lac volcanique Barombi Mbo, d’origine récente, abrite une guilde de poissons écologiquement et morphologiquement différenciés bien que très proches et appartenant au même genre. Cet “essaim d’espèces”, ainsi que celui d’autres lacs similaires, a souvent été pris comme exemple emblématique de spéciation rapide à partir d’une espèce fondatrice unique. Cette figure représente l’éloignement génétique de trois groupes d’espèces du lac relativement à deux espèces du même genre prélevées ailleurs au Cameroun. Dans l’hypothèse d’une différenciation purement sympatrique et sans apport génétique extérieur, ces groupes devraient se différencier dans des directions indépendantes et de manière équidistante par rapport au groupe exté-rieur, ce qui n’est manifestement pas le cas dans cette analyse réalisée sur plusieurs milliers de mar-queurs dispersés dans le génome. Il faut donc faire appel à des scénarios plus compliqués d’hybridation et d’échanges génétiques entre pools géniques préalablement différenciés pour expliquer cette différen-ciation “intra-lac”, ou au moins son initiation. (D’après Martin et al. 2015).
Quoi qu’il en soit, et sans rentrer dans des querelles de spécialistes – car les disputes vont bon train et tout le monde n’est pas d’accord sur l’interprétation des situations mentionnées ci-dessus –, le nombre de cas prouvés comme résultant sans équivoque d’un phénomène de spéciation écologique reste très faible par rapport à l’immense majorité des autres cas. Pourquoi alors observe-t-on cette disproportion énorme dans la quantité d’encre qui leur est respectivement consacrée ? À cela, il peut y avoir deux types d’explication.
La première découlerait précisément du caractère rare ou exceptionnel du phénomène de spéciation écologique: quand vous pensez avoir observé un tel cas, vous cherchez à le mettre en avant, car tout ce qui est exceptionnel est mieux valorisé que ce qui est banal, en termes de visibilité (et donc de citation – un point auquel les chercheurs sont particulièrement attentifs). Les conséquences de ce type de biais sont importantes pour le fonctionnement même de la communauté scientifique, car il est plus difficile de publier des résultats « ordinaires » et la course au « scoop » va renvoyer des articles sérieux dans des publications de deuxième rang. Les non spécialistes du domaine ne vont donc voir que ce qui « surnage » dans les revues à forte visibilité et vont prendre pour acquis que la communauté scientifique dans son ensemble adhère à ces thèses. Ceci n’est probablement pas le fait de la seule controverse exposée ici, et doit malheureusement toucher bien d’autres domaines également.
La deuxième explication, que défend l’auteur de ce regard, est beaucoup plus subjective. La vision de la sélection naturelle comme moteur prépondérant (et non comme simple accompagnateur) de la spéciation en réponse aux contraintes adaptatives divergentes exercées par l’environnement correspondrait en fait à une idéologie de substitution qui viendrait combler un manque par rapport aux récits antiques de la Création auxquels les scientifiques ne se réfèrent plus collectivement depuis deux siècles environ. Ici, on remplace le doigt de Dieu par celui de Darwin ! Car nous aimons les belles histoires, et si les contraintes environnementales sont capables de “séparer les pools géniques en deux” au point d’en faire de nouvelles espèces différemment adaptées, alors leur existence même est le fruit de la nécessité… et le monde n’est pas complètement désenchanté. Malheureusement, la réalité est probablement beaucoup plus le fait du hasard et de la contingence, et cela ne plaît peut-être pas à beaucoup d’entre nous, car – pour des raisons profondes capables d’orienter nos choix épistémiques à notre insu – nous sommes souvent allergiques au hasard. Au fond, même si personne ne se permet de souhaiter la renaissance du vieux paradigme panglossien selon lequel tout est pour le mieux dans le meilleur des mondes (Gould & Lewontin, 1979), l’ « adaptationisme » serait un penchant encore très répandu chez les biologistes bien que nombre d’entre eux ne sont probablement pas prêts à le reconnaitre… .
Glossaire
Allopatrique : Qui se produit dans des lieux distants.
Co-adaptation génique : Les gènes –ou leur produits- interagissent entre eux de manières multiples et ne peuvent donc évoluer indépendamment les uns des autres à l’intérieur d’une espèce. Il en va ainsi par exemple dans le cas très connu des interactions entre les gènes du noyau et ceux de la mitochondrie pour former la chaîne respiratoire. Le gène qui code pour la sous-unité mitochondriale de la cytochrome-oxydase doit produire une protéine compatible avec la sous-unité codée par le noyau pour que le transfert d’électron se produise correctement. Une évolution de l’un implique nécessairement une coévolution de l’autre. Comme les trajectoires mutationnelles ne seront pas les mêmes dans deux espèces proches, le fonctionnement respiratoire de leurs hybrides éventuels pourra se révéler défectueux, par rupture de co-adaptation. Un bon exemple de ceci est à voir dans les travaux de l’équipe de R. Burton sur le copépode Tigriopus californicus.
Dérive génétique : variation aléatoire des fréquences alléliques (allèles = variants d’une même gène) d’une génération à l’autre, due au nombre fini d’individus participant à la reproduction. La dérive génétique est d’autant plus importante que la population est petite.
Éléments transposables, transposons : Séquences d’ADN capables de se dupliquer et de se ré-insérer ailleurs dans le génome, dont ils peuvent constituer jusqu’à plus de 95 % selon les espèces. Il existe plusieurs mécanismes de transposition, mais ils résultent tous en une modification locale de la séquence constitutive des chromosomes, participant ainsi à leur évolution structurale.
Parapatrique : Qui se produit dans des lieux géographiquement contigus.
Phénotypique : Tout ce qui a trait à la forme, et par extension à d’autres caractères, désigne tout ce qui résulte de l’expression des gènes en interaction avec l’environnement.
Sympatrique : Qui se produit en un même lieu.
Bibliographie
Feder JL. et al., 2003. Allopatric genetic origins for sympatric host-plant shifts and race formation in Rhagoletis . PNAS 100, 18 pp. 10314-10319
Fitzpatrick B. M., J. H. A. Fordyce and S. Gavrilets, 2008. What, if anything, is sympatric specia-tion? J. Evol. Biol. 21: 1452-1459.
Fitzpatrick B. M., J. H. A. Fordyce and S. Gavrilets, 2009. Pattern, process, and geographic modes of speciation. J. Evol. Biol. 22: 2342-2347.
Gould S.J. & R. Lewontin, 1979. The spandrels of San Marco and the Panglossian paradigm : a critique of the adaptationnist program, Proc. R. Soc. London B 205.
Mayr E., 1984. Populations, espèces et évolution. Hermann. Trad. Française de l’ouvrage original de 1970.
Martin C.H. et al., 2015. Complex histories of repeated gene flow in Cameroon crater lake cichlids cast doubt on one of the clearest examples of sympatric speciation”, Evolution, doi :10.1111/evo.12674
Wallace A. R., 1912. « Influence of Natural Selection upon Sterility and Fertility ». In Darwinsim: An Exposition of the Theory of Natural Selection with Some of Its Applications (3rd ed.). pp. 173–179.
—
Article édité et mis en ligne par Anne Teyssèdre.

Bonjour et merci beaucoup pour ce « regard » très instructif. La spéciation, il en est également question dans un article paru ce jour sous l’intitulé « la séparation des espèces, presque sous nos yeux » dans le supplément du Monde d’aujourd’hui (http://www.lemonde.fr/sciences/article/2016/03/07/zoologie-la-separation-des-especes-presque-sous-nos-yeux_4877855_1650684.html). Cet article évoque un cas de spéciation -semble-t-il – très rapide et se produisant « sous nos yeux » (l’auteure évoque environ 150 ans) chez deux populations sympatriques d’Epinoche. L’article conclut en donnant la parole à Guillaume Lecointre qui apporte une certaine modération à ce constat.
Que pensez-vous de ce cas issu de recherches d’un doctorant de l’université de Berne? D’une façon générale, pensez-vous que sous l’influence de facteurs environnementaux propre à l’anthropocène (changement climatique, impacts des polluants chimiques…), le phénomène ici décrit de spéciation très rapide pour des espèces sympatriques est de nature à s’amplifier à l’avenir?
Merci pour votre analyse,
Bien cordialement,
David HAPPE
Bonjour,
Bien entendu, nous avons lu et discuté cet article avec intérêt dans notre équipe lors d’une réunion biblio. Et je pense qu’il illustre très exactement ce que je dis dans le regard ci-dessus: dans cet article on fait comme si on partait d’une situation entièrement nouvelle il y a 150 ans (introduction unique, population d’origine homogène,…) et une sélection extraordinairement rapide de variants nouveaux qui en même temps, adapterait les populations locales à leur nouvel environnement et les isolerait génétiquement de manière à constituer de futures nouvelles espèces.
Or il existe de par le monde de nombreuses populations d’épinoches montrant des écotypes alternatifs marin/eau douce ou lac/rivière. Ces différenciations écotypiques sont sous-tendues par un certain nombre de gènes bien différenciés dont la divergence de certains est estimée à plus d’un million d’années. Ces écotypes produisent en général souvent des hybrides et ne sont donc pas complétement étanches l’un à l’autre. Ils sont même largement perméables pour certains gènes dits neutres situés chromosomiquement loin des gènes différenciés. De telle sorte qu’il a été montré en plusieurs occasion que, par exemple, des populations d’eau douce pouvaient se redifférencier à partir de populations d’eau de mer voisines en train de recoloniser l’espace (après la déglaciation par exemple) à condition que les haplotypes* « d’eau douce » soient capables de migrer de proche en proche d’une population de rivière à la suivante via quelques hybrides.
* : Un haplotype est un ensemble de gènes situés côte à côte sur un chromosome; gènes qui sont généralement transmis ensemble à la génération suivante, et sont donc dits liés.
Il en est de même pour les écotypes lac/rivière, et des introductions multiples et/ou via quelques hybrides suffisent à faire en sorte que les gènes de l’un et l’autre écotypes soient capables de se différencier spatialement, après recolonisation des gradients environnementaux qui se présentent à eux. Etant donné que l’on ne sait pas grand-chose de la distribution il y a deux siècles de ce petit poisson facilement transporté, le scénario d’introduction concomitante ou successive des haplotypes* « rivière » et « lac » est plus que probable.
Il est frappant de constater que le grand public (par le truchement des journalistes qui l’informent) est friand de ce genre d’histoire, et qu’elles sont donc considérées comme vraies à partir du moment où elles sont reprises en boucle. J’espère que certains lisent aussi ces regards…
Bon, et bien l’activité de ce blog n’est pas trépidante… C’est probablement que tout le monde est d’accord avec ce qui est écrit, ou bien que comme ce n’est pas sur twitter, tout ceci passe inaperçu et ce n’est plus très tendance de perdre du temps à poster des réponses argumentées…
Alors tant pis, j’en remets une couche et propose à la discussion l’argumentation ci-dessous:
– l’extinction et la non-adaptation à des changements environnementaux sont monnaie courante au cours de l’évolution, et probablement beaucoup plus fréquentes que le contraire.
– il existe quasiment partout des gradients environnementaux, ou bien des transitions plus abruptes d’un milieu à un autre (écotones) mais très étendues, ou bien encore de nombreuses espèces proches de celles qui sont impliquées dans une symbiose ou un parasitisme donné. Pourtant il n’y a pas des écotypes omniprésents à chaque extrémité de chaque gradient, ou bien des races d’hôtes sur chaque espèce-hôte potentielle, qui auraient tous vocation à devenir in fine des espèces à part entière. Si effectivement on connait des situations où il semble qu’une « espèce » ou ses avatars se déploie à travers un certain nombre de situations écologiquement diversifiées (et ce sont celles qui font la plupart du temps l’objet des publications citées dans ce Regard), il me semble qu’il existe aussi un très grand nombre d’espèces hautement spécialisées sur une seule niche très étroite. Et que ceci serait plutôt la majorité des cas…
Donc s’adapter prend en général beaucoup de temps. Ça on le savait, mais ça veut probablement dire aussi que s’adapter vers un autre optimum adaptatif en situation de flux génique persistant qui exercerait une force de rappel importante vers la situation de départ est encore plus difficile…
Bonjour,
et merci encore à François B. pour ce beau regard sur la spéciation écologique..
J’ai plusieurs remarques (un peu en retard, désolée!).. Par exemple, à propos des mécanismes de la spéciation sympatrique, si je reprends cette phrase – extraite de ce regard n°65:
« Les mécanismes invoqués pour amplifier ainsi les différences génétiques et phénotypiques stipulent par exemple que des comportements ou des adaptations particulières se mettent en place […] de telle manière que les génotypes intermédiaires soient produits en moins grand nombre qu’attendu[…]. »
Je pense que la spéciation sympatrique est favorisée justement lorsque ces comportements et adaptations particulières, non pas (ou pas seulement) se mettent en place après ou en réponse au changement d’habitat ou de conditions de vie, mais PRÉEXISTENT à ce changement. C’est plus simple avec une « exaptation » (selon le terme de S. Gould) !
Par exemple, les « juvéniles » de nombreuses espèces animales (invertébrés comme vertébrés) s’imprègnent au cours de leur développement (à l’état de larve pour les insectes par exemple, de juvéniles pour les poissons, mammifères et oiseaux..) de certaines caractéristiques physiques de leur habitat local, colonie, hôte ou parent nourricier (parent biologique ou non). Puis s’appuient sur ces caractéristiques pour orienter leur comportement, notamment lors de la recherche de bonnes conditions de reproduction à l’âge adulte..
De très nombreuses espèces d’insectes spécialistes d’une certaine plante hôte, par exemple, recherche à l’âge adulte – à l’odorat ou/et à la vue – pour y pondre leurs oeufs, une plante de l’espèce où elles se sont développées en tant que larve.
=> De même que les saumons déplacés à l’âge de juvénile -par un expérimentateur- dans un autre cours, puis émigrés en mer, regagnent à l’âge adulte le torrent où ils ont grandi, de même une femelle de « mouche de l’aubépinier », pondue « par erreur » dans une fleur de pommier, peut/doit à l’âge adulte rechercher activement à l’odorat un pommier pour y pondre ses oeufs..
Cette « erreur » sur la plante hôte est héritable en d’autres termes (cf. le regard n°25 d’Etienne Danchin).
Ce type d’imprégnation aux conditions de vie larvaire ou juvénile devrait favoriser la spéciation écologique, surtout (hypothèse):
– chez les espèces (dites stratèges r) à fort taux de multiplication,
– en période d’apparition/émergence de nombreux nouveaux habitats (et niches écologiques associées), comme c’est la cas actuellement sous la pression croissante de nos sociétés…
Je réponds brièvement (avec retard, chacun son tour!) aux remarques d’Anne ci-dessus.
Sur un plan mécanistique, oui des mécanismes d’imprégnation, de transmission sociale, voire d’épigénétique et plus généralement de plasticité peuvent faciliter le maintien à la génération suivante de phénotypes « favorables » en terme de séparation spatiale et reproductive des individus voire des infrapopulations. Mais comme nous le savons, tous ces mécanismes sont réversibles, et la question et celle de la stabilité dans le temps de ce genre de phénomènes qui doit être suffisamment grande pour qu’ils puissent être consolidés par des évolutions génétiques concomitantes susceptibles d’aboutir in fine à de la spéciation sympatrique. Et c’est bien là où le bât blesse, car les temporalités des deux mécanismes sont très différentes. Il faut un (très) grand nombre de générations pour qu’un nombre suffisant de gènes deviennent suffisamment incompatibles pour que tout ne soit pas remis en cause par l’échange d’individus entre infrapopulations. Or n’importe quelle perturbation du milieu intervenant à une échelle décennale, centennale, voire millénaire (et nous savons bien que rien n‘est stable en ce bas monde) suffira à remettre à l’heure les pendules de l’imprégnation, de la transmission sociale et de l’épigénétique.
Sur le plan idéologique, je pense que le grand intérêt porté à ces mécanismes est un peu disproportionné par rapport à leur importance réelle, en tout cas pour leur contribution aux mécanismes de la spéciation, et que cela reflète exactement les deux mêmes causes de biais soulignés dans ce regard. A savoir, ce qui se publie mieux que le reste d’une part, et d’autre part une envie de raconter des belles histoires : non seulement la sélection naturelle finirait par multiplier les espèces in situ en réponse aux variations environnementales, mais lesdites variations lui donneraient un gentil coup de pouce grâce à des mécanismes qui sont souvent vendus comme non-mendéliens…
Que tal François !
Merci pour cet article qui nous éclaire encore davantage sur la prépondérance éblouissante de la spéciation allopatrique sur toute autre et aussi de celle du hasard sur la nécessité. Le biais biblio, tu l’expliques très bien : le rare vaut plus que le fréquent et le doigt de Darwin est toujours là pour qu’on obtempère.
Ceci dit, même si les contacts secondaires d’espèces formées en allopatrie permettent, preuve moléculaire à l’appui, de réfuter bien souvent l’hypothèse de la spéciation sympatrique, il reste beaucoup plus facile de démontrer une spéciation allopatrique, avec l’argument massue de la barrière au flux de gènes à l’appui, qu’une spéciation sympatrique supposant à la fois des mécanismes adaptatifs complexes et de rejeter l’hypothèse de contacts secondaires. D’où la nécessité d’encourager les recherches sur l’hypothèse de la spéciation sympatrique ;-).
En fait il n’y a aucun antagonisme (sauf entre les chercheurs) entre les deux modes de spéciation et c’est peut-être là où la spéciation sympatrique peut s’exprimer (même rarement) que l’on obtient les taux de diversité spécifique et d’endémicité les plus élevés ? Peut-être qu’en fait les doigts de Darwin et de Wallace se rejoignent en Amazonie, ou dans les barrières récifales, ou dans le rift africain ?
Quoi qu’il en soit nous continuerons à te tenir au courant de nos recherches en Amazonie et savons que nous pouvons compter sur ton sens critique. Merci encore.
Abrazos,
JF
Holà camarade !
Deux éléments de réponse:
-contrairement aux idées reçues, c’est assez difficile d’exclure l’un ou l’autre modèle quand le temps écoulé entre le début de la divergence n’est pas très important, qu’il y a encore du polymorphisme ancestral et des flux géniques intermittents, même en allopatrie. Dans ces cas-là même, on risque de conclure plus souvent à tort à un modèle sym- plutôt qu’allopatrique.
-oui, en dehors de l’allopatrie stricte il existe nécessairement un continuum de situations écologiques qui vont de la parapatrie avec flux de gènes intermittent, à la micro-allopatrie qui pourraient conduire éventuellement à des spéciations mais la question est, comme rappelé dans le commentaire ci-dessus, la stabilité de ces situations aux échelles de temps nécessaires. Et là, on peut avoir des doutes, même en Amazonie…
Hasta la victoria para l’(allo)patria !
Bonjour,
Merci pour ce regard très intéressant.
J’ai une question de néophyte, qui paraîtra peut-être grossière et simpliste mais peut-on imaginer que la sympatrie soit une vue de l’esprit, un point de vue et qu’il y aie toujours isolement géographique au préalable , suffisamment ancien pour avoir permis « la barrière reproductive »?
Concernant « le doigt de Dieu » je suis assez d’accord sur ces biais à la fois de publication aussi bien scientifiques que de vulgarisation. Et je pense aussi que cela découle d’un besoin intrinsèque de croyance ou d’idée « directrice ». Je pense notamment aux textes qui parlent de l’orthogénèse et de l’évolution d’une lignée dans un « but » adaptatif. Peut-être avons nous toujours besoin de simplifier l’idée pour l’accepter. Il en va de même pour l’adaptation, combien de textes sur l’adaptation des organismes à la vie terrestre, alors que je pense que l’exaptation est plus judicieuse. Mais peut-être que cela laisse trop de place au hasard et enlève l’idée inconsciente de volonté, du tout est à la bonne place et a un sens.
Bien cordialement
Je pense Ludivine que vous n’êtes pas si néophyte que ça et que vous avez bien perçu le message de ce regard (un peu oblique par rapport à certaines chapelles dominantes, hélas…). En fait, il y a forcément un continuum de situations qui brouille les pistes (comme décrit dans les articles de Fitzpatrick et coll. cités plus haut), d’autant plus que la vraie question, indépendamment des arrières-plans idéologiques et de publiabilité, est à mon avis celle de la stabilité temporelle desdites situations pour qu’elles soient susceptibles d’accoucher d’un isolement reproductif pérenne.
Finalement, le résumé de la problématique pourrait-être « l’adaptation différentielle est-elle à même d’engendrer seule de l’isolement reproductif sans le concours de la géographie, même avec l’intervention de « gènes magiques » qui localiseraient ipso facto les individus dans des unités reproductives différentes, ou bien au contraire faut-il une amorce d’isolement « mécanique » préalable suffisamment longue pour que des incompatibilités génétiques se mettent en place, certaines d’entre elles liées à des adaptations différentielles mais pas forcément ? ».
Bonjour,
Je suis néophyte aussi. J’imaginais naïvement la spéciation comme chose obligatoire, je veux dire comme étant la base même de la nature du vivant qui veut qu’aucun objet reproduit (enfant) ne soit le même que l’objet parent. Il me semblait comme obligatoire que les espèces se forment automatiquement et cela sans faire appel à un changement d’environnement.
Ma question : Des simulations informatiques sur cela ont déjà dû être faites (Il s’agirait de permettre à un objet initial de se multiplier dans un même lieu sans jamais que ses enfants et petits-enfants soient les mêmes que les prédécesseurs afin de respecter ainsi la nature transmutative du vivant).
Connaissez-vous des études de ce genre? Savez-vous ce qu’on obtiendrait à différents termes, un continuum ou des espèces?
Bonjour Michel,
Sur le premier point, vous avez raison, il n’y a quasiment jamais de reproduction à l’identique, c’est pourquoi les espèces évoluent de manière inexorable au cours du temps, même si leur apparence externe peut apparaître inchangée. Mais la question discutée ici n’est pas exactement celle-ci. Il s’agit de savoir si deux espèces filles peuvent naître d’un seul et même ensemble originel sans séparation préalable dans l’espace.
Bien entendu, il y a des chercheurs qui font des simulations avec des populations d’individus in silico, de différentes manières, et dans certains conditions ils voient des groupes d’individus se structurer jusqu’à ne plus échanger d’information génétique entre eux. On pourrait parler à ce moment-là de début de spéciation. Mais la question est alors celle du réalisme ou de la validité des paramètres utilisés pour ces simulations, ainsi que de la stabilité temporelle des conditions dans lesquelles ces bifurcations de trajectoires évolutives éventuellement apparaissent. Car pour que ces bifurcations se traduisent en espèces reproductivement incompatibles, sinon en espèces sonnantes et trébuchantes, il faut des temps très longs dans l’immense majorité des cas…
Merci de votre retour François,
Je pensais être et dans la question discutée (spéciation dans un même espace, avant ou après adaptation) et aussi dans le titre (Le doigt de Darwin), ces deux choses n’en faisant qu’une, il me semble. En effet, la question pourrait peut-être être un biais épistémologique et donc créer, pour ceux qui veulent y répondre, un des fameux doigts que vous voyez.
Pour certains, ce doigt sera Dieu, pour Darwin ce fut les lois de la Nature – avec N majuscule – , pour vous c’est le hasard et la contingence, pour l’environnementaliste ce sont les contraintes environnementales. Bref, aucune personne, cultivée par le mythe occidental prométhéen (Darwin inclus) ne semble prêt à penser qu’aucun doigt extérieur n’existe, et que ce dont on parle peut, dans la réalité, se dissoudre dans le vivant. C’est que cela ferait du vivant un objet créateur et sortirait ainsi du ressort du mythe de la création extérieure. Pour beaucoup de scientifiques, on sort par la même opération du cahier des charges des sciences. Il vous semble ainsi que je suis hors sujet alors qu’en fait, je ne pourrais n’être que hors mythe. À voir!
Peut-être, nous remarquerons que les Dieux, la Nature (au sens Darwinien comme au sens actuel commun), le hasard ou la contingence n’ont pas la nature pour créer la spéciation. Soit ils n’ont pas de substance donc encore moins de pouvoir, soit ils ne sont pas des invariants et ne peuvent détenir donc une propriété.
Tous ces concepts peuvent expliquer la spéciation mais malheureusement tous ces concepts-là, sans exception, sont d’une façon ou d’une autre, éthérés. La science ne devant expliquer notre contexte que par notre contexte et non par des concepts et objets inexistants, il faudrait donc, question d’épistémologie, encore chercher la réponse à la question ailleurs… ou comme la pierre philosophale ne pas chercher.
La spéciation pourrait bien juste être « dans » la nature transmutative du vivant, juste un de ses effets poussés et non à chercher « dans » un doigt extérieur. Qu’on en soit témoin en un même lieu ou par le truchement de lieux différents sont deux observations aussi non validantes que les expériences in silico. Il me semble que cette question est juste un biais de pensée et un biais de lecture. Bref, que la spéciation serait le doigt.