La Société Française d’Ecologie (SFE) vous propose cette semaine le regard de Laurent Tarnaud, chercheur en écologie comportementale au Muséum National d’Histoire Naturelle, sur l’écologie et le comportement des macaques japonais de Yakushima.
Ce « regard » est une version complétée et adaptée pour la plateforme SFE de l’article du même auteur, « Les yakuzarus, macaques de l’île Montagne », paru dans le n°6 d’ESpèces daté de décembre 2012.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions après cet article. Les auteurs vous répondront et une synthèse des contributions sera ajoutée après chaque article.
Ecologie et comportement des yakuzarus,
macaques de Yakushima
par Laurent Tarnaud
Chercheur associé au laboratoire d’Eco-anthropologie et d’Ethnobiologie
du Muséum national d’histoire naturelle (MNHN)
Mots clés : Macaque du Japon, Yakushima, primates, écologie, comportement, alimentation, développement, apprentissage,
préservation de la biodiversité, primatologie, zoopharmacognosie, Japon
———
Yakushima (屋久島), l’île montagne
Au sud de l’île de Kyushu, une des quatre grandes îles de l’archipel japonais, l’île de Yakushima dresse avec majesté, au-dessus des vagues, 42 sommets granitiques de plus de mille mètres d’altitude. Le plus haut, le Miyanoura daké, culmine à 1935 mètres. Couverts de neige en hiver, ses reliefs verdissent aux printemps d’un tapis de bambous d’où émergent des rocs nus et dressés qui parsèment les crêtes sommitales et dont les habitants disent qu’ils abritent des dieux… Dessous, des forêts, dont certaines sont plusieurs fois séculaires, dévalent les pentes jusqu’à la mer. Le relief accidenté de l’île est traversé par de nombreux torrents et cascades alimentés par les précipitations annuelles qui peuvent atteindre 10 m sur les sommets (4,4 m sur le littoral).
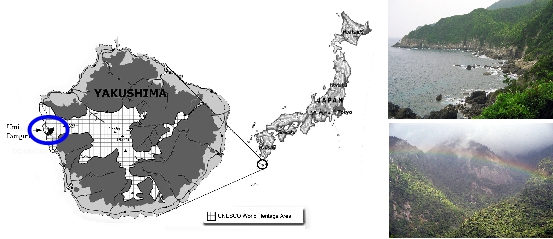
Carte : Localisation de l’île de Yakushima dans l’archipel japonais et site d’étude des macaques japonais.
La partie quadrillée délimite le Parc national de Kirishima-Yakushima. Clichés: L. Tarnaud.
Avec l’île voisine de Kirishima, Yakushima forme le parc national de Kirishima-Yakushima. Il englobe 21 % des terres émergées de Yakushima et abrite une biodiversité patrimoniale, notamment pour sa flore subalpine et forestière. Yakushima est située à la frontière des régions biotiques paléarctique et orientale. Elle est couverte à basse altitude de forêts sempervirentes subtropicales, tandis que, dans les derniers étages, croissent des forêts tempérées. Les écosystèmes rencontrés sont uniques et abritent des plantes remarquables par leur endémisme (94 espèces) ou leur distribution à la limite sud de leur aire géographique (plus de 200 espèces).
Cette flore est aussi caractérisée par un très grand nombre de plantes épiphytes (lianes principalement) et de fougères, totalisant plus de 300 espèces ou sous-espèces, ainsi que par plusieurs espèces rares de lichens. Yakushima abrite, en outre, la mangrove la plus septentrionale du globe. Quatre sous-espèces de mammifères et d’oiseaux endémiques y vivent, dont le Cerf de Yakushima (Cervus nippon yakushimae), le Rossignol Akahigé (Erithacus akahige tanensis) et le Macaque de Yakushima présenté dans cet article. C’est, enfin, un lieu de ponte pour les tortues vertes (Chelonia mydas) et caouannes (Caretta caretta). C’est aussi au cœur des forêts millénaires de Yakushima, où croissent les yakusugi (les cèdres du Japon, Cryptomeria japonica) – dont les plus célèbres sont âgés de 1000 à 3000 ans –, que le cinéaste japonais Miyazaki a puisé son inspiration pour écrire son film d’animation mondialement connu, Princesse Mononoké.
Les yakuzarus (ヤクザル)
Pour le primatologue, Yakushima présente l’intérêt d’abriter une population de primates non approvisionnée en nourriture et étudiée depuis les années 1970 : la sous-espèce de macaques japonais Macaca fuscata yakui, localement désignée sous le vocable de yakuzaru, le singe de Yakushima, “saru” signifiant singe en japonais. Son observation a permis d’importantes découvertes dans le domaine de l’écologie sociale et des relations complexes que ces singes entretiennent avec le milieu. En 2008, un apprentissage alimentaire inconnu pour l’espèce a été mis en évidence par l’auteur (voir plus loin).
Les yakuzarus se distinguent des macaques japonais des îles principales (Macaca fuscata fuscata) par leur petite taille et le gris plus clair de leur pelage, qui pourraient être des adaptations au climat plus clément de Yakushima, située au Sud du Japon. La taille inférieure de cette sous-espèce méridionale répond en effet à la règle de Bergmann (zoologue allemand du 19e siècle) qui stipule que la masse des animaux à sang chaud (homéothermes), mammifères et oiseaux, tend à varier dans le sens inverse des températures et donc à augmenter avec la latitude. Une grande taille permet d’avoir un rapport “surface de contact/volume” inférieur à celui d’un animal de petite taille, et donc d’économiser de l’énergie. La tonalité claire du pelage des yakuzarus pourrait obéir à la même contrainte de thermorégulation dans un climat plus clément, mais cette hypothèse reste à démontrer. Autres particularités, la queue des yakuzarus est plus longue que celle des macaques de la sous-espèce fuscata et leurs yeux ont une forme en amande plus allongée.
Régime alimentaire et habitat
Les macaques de l’île de Yakushima vivent en groupes de 25 à 30 individus qui exploitent de petits domaines vitaux qui se recouvrent à plus de 60 %. Ces domaines vitaux, de 90 ha en moyenne, sont près de 2,5 fois plus petits que ceux des groupes du Nord du Japon (220 ha). Là encore, la géographie peut expliquer cette différence : au Nord, les hivers sont plus rigoureux et les forêts moins riches en termes d’espèces et de densité végétale. Les forêts de Yakushima abritent, par exemple, plus de 13 fois plus d’arbres à l’hectare que celles de l’île de Kinkazan, l’autre site d’étude historique des macaques japonais.
Les macaques sillonnent ces domaines pendant la journée à la recherche de fruits, de graines, de glands, de feuilles, d’invertébrés (insectes) et de vertébrés (lézards). Ils parcourent en moyenne un kilomètre et demi par jour. Consommateurs opportunistes, omnivores, ils exploitent un très large éventail d’aliments : plus de 250 espèces végétales ingérées par ces singes ont ainsi été recensées. En 2008, il a été mis en évidence la consommation de feuilles de graminées dentées et agrémentées de poils que les animaux roulaient en boule dans leur bouche avant de les avaler (Dagg, 2009). Ces observations complètent les preuves déjà nombreuses de l’utilisation des plantes par les primates pour se soigner(Huffman, 2003). Les macaques roulent aussi les chenilles entre les paumes des deux mains pour retirer leurs poils urticants, puis ingèrent immédiatement après des feuilles matures ou mortes, vraisemblablement pour piéger les poils restants et faciliter la digestion (voir plus loin la section sur la « pharmacie animale »).
Organisation sociale
L’organisation sociale des macaques du Japon repose sur une hiérarchie stricte et sur le népotisme. Le non-respect des rangs de dominance donne lieu à des comportements agressifs (agonistiques). A contrario, d’autres espèces du genre Macaca, comme le macaque de Tonkéan (Macaca tonkeana), ont organisé leurs relations sociales autour de la tolérance. Comme chez la plupart des simiens, les mâles dominent les femelles et chaque sexe obéit à des règles de dominance qui lui sont propres.
Les comportements agonistiques indirects ou de soumission comme le “sourire” (retroussement des lèvres qui découvre la dentition) sont fréquents. À l’approche d’un dominant, l’individu subordonné tourne généralement le dos ou s’esquive. Les combats sont d’autant plus violents chez cette espèce qu’il existe un système d’alliances où mâles et femelles peuvent prêter main-forte à un individu agresseur ou agressé. Ces alliances dépendent des “intérêts” de chacun : se faire bien voir des dominants ou défendre un “parent” (pour les femelles). Pour apaiser les tensions, les macaques se réconcilient en se toilettant mutuellement. Le toilettage est aussi un moyen de marquer son rang hiérarchique, le subordonné toilettant le dominant plus souvent et plus longuement que ce dernier ne le fait.
Les groupes sociaux de macaques japonais sont matrilinéaires. Ils sont constitués de plusieurs lignées de femelles apparentées qui entretiennent des relations privilégiées, les plus vieilles dominant les plus jeunes. Devenues mères, elles exercent un contrôle strict des interactions de leur enfant avec les membres du groupe placés plus haut dans la hiérarchie. Leurs descendants hériteront de leur rang de dominance et domineront des individus plus âgés et adultes. Les mâles, à leur maturité sexuelle (aux alentours de cinq ans), émigrent et cherchent un nouveau groupe. Ils y resteront en moyenne trois ans, un peu plus s’ils deviennent des individus dominants.
Reproduction et développement
Les macaques du Japon sont des reproducteurs saisonniers. Ils s’accouplent à l’automne, de septembre à novembre. Une des stratégies de reproduction des mâles est le “gardiennage” assuré par le mâle dominant, qui maintient les femelles en œstrus à son contact, dissuadant ainsi les autres prétendants. Mais les femelles peuvent choisir de quitter le groupe pendant cette période, et de copuler avec des mâles étrangers au groupe. À Yakushima et dans l’île de Kinkazan, il a ainsi été estimé que 41 % des copulations étaient le fait de mâles d’un autre groupe.
Les jeunes naissent après 172 jours de gestation en moyenne, aux mois de mai et juin de l’année suivante. Les femelles, reproductrices à l’âge de cinq ans, mettent bas tous les deux ans. Un quart des jeunes succomberont avant la fin de leur première année de vie. S’il naît autant de mâles que de femelles à Yakushima, un déséquilibre entre le nombre de mâles et de femelles (sexe-ratio) en faveur des mâles est observé chez les sujets de plus de trois ans. Un même déséquilibre du sexe-ratio est observé les années de forte production fruitière (“mast-fruiting”). Le développement d’un mâle est énergiquement plus coûteux pour la mère que celui d’une femelle. Les jeunes macaques naissent à la fin du printemps, alors que le milieu est riche en ressources alimentaires. Cette richesse et cette diversité permettent aux mères de satisfaire leurs besoins énergétiques accrus par l’allaitement et le transport du jeune.
Dès la seconde semaine de vie, sous la surveillance maternelle, les jeunes macaques japonais explorent leur environnement. Jusqu’à la fin de leur première année, leur mère leur servira de modèle pour apprendre à sélectionner et manger les ressources du milieu. Au contact de leurs congénères, ils maîtriseront aussi, peu à peu, les règles de la vie en société. Les apprentissages précoces sont primordiaux et se déroulent au contact des autres membres du groupe qui offrent, de manière répétée, à la fois des mises en situation (expositions) et des modèles : au jeune, ensuite, d’apprendre individuellement par essais et erreurs.
Ces apprentissages se déroulent pendant des périodes sensibles de développement. Il a ainsi été montré que, si le jeune macaque observe avec attention sa mère manipuler des aliments dès son premier mois d’existence, ce n’est qu’une fois sevré qu’il se met à les manipuler, à flairer la bouche de l’adulte et à fouiller là où son modèle a fouillé avant lui. Clichés : Laurent Tarnaud.

Apprentissage alimentaire par l’observation. Un macaque juvénile regarde avec attention sa mère fouiller dans le sable (lit de rivière) à la recherche de graines dans un trou qu’elle a creusé (photo de gauche). Il en pioche une à son tour
pendant qu’elle nettoie cet aliment en le roulant entre la paume de ses mains (photo de droite). © L. Tarnaud
Cette phase d’exploration alimentaire suivie de manipulations et d’ingestions (qui participent certainement d’un renforcement du goût et du début de la digestion chez l’apprenant) dure jusqu’à la fin de la première année de vie, puis n’est quasiment plus observée ensuite (Tarnaud et Yamagiwa, 2008). Cette recherche éthologique vient conforter les rares études sur les apprentissages alimentaires qui montrent que les primates, lémuriens ou simiens acquièrent leur régime alimentaire en bas âge, à une période correspondant à la fin de l’enfance et au début de la juvénilité. Cette temporalité éclaire le processus des apprentissages alimentaires chez l’homme, apprentissages que l’on soupçonne fortement d’intervenir avant l’âge de cinq ans, chez l’enfant.
———————————————————————————————————————-
La pharmacie animale, ou zoopharmacognosie
L’utilisation par les animaux de plantes pour se soigner est suspectée depuis longtemps. Par exemple, Aristote, au IVe siècle, dans son « histoire des animaux » observait que les chiens ingurgitent de l’herbe pour se faire vomir. Depuis, de nombreuses anecdotes d’automédication ont été rapportés dans de nombreux taxa (éléphants, buffles, tigres, perroquets…) et chez les primates non humains. Les chercheur Rodriguez et Wrangham (1993) ont proposé le concept de « Zoopharmacognosie » pour rendre compte de l’usage des plantes ayant des propriétés médécinales comme traitement et prévention des maladies par les animaux. Chez les primates, le vocable zoopharmacognosie est souvent remplacé par celui d’automédication qui sous-entend une relative conscience de l’usage d’items aux principes actifs. Cet usage ne se limite pas à l’ingestion de parties de plantes aux propriétés curatives.
Par exemple, comme il l’a été souligné dans cet article, les macaques japonais de l’île de Yaksuhima avalent des feuilles de graminées dentées et poilues après les avoir roulées boule en bouche pour pièger leurs parasites intestinaux (nématodes). Les singes sapajous (Cebus apella) frottent leur pelage à l’aide d’arthropodes qui sécrètent un répulsif participant très certainement à une protection antiparasitaire ou antiseptique globale (Simmen et Tarnaud, 2011). L’ingestion de terre (géophagie) est aussi suspectée avoir une action anti-diarrhéique ou antiparasitaire (Krishnamani et Mahaney, 2000). Ainsi l’ingestion de terre par les lémurs bruns de Madagascar et Mayotte à la saison sèche pourrait favoriser l’absorption de certains métabolites secondaires, notamment des tannins condensés, contenus dans les feuilles consommées en grandes quantités à cette époque de l’année (cf. photo ci-contre).
L’automédication des primates repose sur l’ingestion volontaire en petite quantité, de certaines parties de plantes contenant des composés chimiques (métabolites secondaires) aux principes actifs, utilisés par les végétaux comme défenses chimiques. Ces métabolites secondaires seraient « détournés » au profit de l’organisme qui les ingère dans un but préventif ou curatif. Ce bénéfice expliquerait pourquoi les primates consomment des parties de plantes potentiellement toxiques. Plusieurs, études menées en captivité ont montré que des animaux étaient capables de recouvrer un bon état de santé en favorisant l’ingestion d’items contenant des substances actives, y compris aux gouts répulsifs (amertume, acidité). Par exemple, l’équipe de Vitazkova (2001) rapporte que les souris luttent avec efficacité contre le paludisme en sélectionnant parmi plusieurs choix des solutions contenant de la quinine.
Cependant, Hladik (1998) souligne que l’emploi du mot « médicament » et donc celui « d’automédication » doit être envisagé avec beaucoup de précaution. Il sous-entend que les individus ont une certaine conscience de l’effet curatif qui résultera de l’ingestion de telle ou telle partie de plantes. Il propose, à l’instar des sociétés humaines qui utilisent des plantes aux effets curatifs, notamment sous forme d’épices, que les primates non humains puissent échantillonner et ingérer en petites quantités un grand nombre de plantes dont l’ajout au régime alimentaire produirait par accumulation des bénéfices en termes de bonne santé comme cela vaut pour les vitamines, par exemple.
Cela expliquerait pourquoi les régimes alimentaires des primates non humains contiennent un grand nombre d’items alors que seulement quelques uns rendent vraiment compte de ce régime. Par exemple, les lémuriens bruns (Eulemur fulvus) consomment en saison des pluies et en saison sèche en forêt sèche un total de 28 et 20 parties de plantes mais seulement, respectivement, 8 et 4 de ces items décrivent 80% du régime alimentaire des individus (Tarnaud, 2004). Il a cependant été montré pour cette espèce que les faibles quantités ingérées ne prédisaient pas de l’effet antiparasitaire des items, certains, efficaces, pouvant être consommés en grandes quantités (Nègre et al.,2006).
Dans ce contexte, la mise en évidence d’un apprentissage dédié à la consommation de plantes aux principes actifs pour bénéficier de leurs effets curatifs s’avère extrêmement complexe. Il se pourrait donc que l’effet préventif et curatif de l’ingestion régulière d’un grand nombre d’items alimentaires dont l’addition participent à décrire le régime alimentaire des primates non-humains, soit complété par des comportements à visée médicinale et observables dans certaines situations de stress physiologique, comportements résultant de l’intrication de plusieurs types d’apprentissage qu’il reste à démontrer.
———————————————————————————————————————-
Yakuzarus et conservation
La population de macaques japonais de l’île de Yakushima est recensée chaque année et compte entre 4 000 et 5 000 individus qui recolonisent peu à peu le milieu. L’augmentation de cette population provoque des tensions avec les agriculteurs locaux, et notamment avec les producteurs des oranges “Ponkan”, appréciées des Japonais. Les propriétaires d’orangeraies sont obligés d’ériger des défenses électriques coûteuses autour de leurs plantations.
Cependant, Yakushima profite d’une dynamique singulière qui a permis de préserver la biodiversité unique de l’île : la relation durable de la communauté scientifique avec les habitants. C’est sous l’impulsion des chercheurs que le parc national des îles Kirishima-Yakushima a été créé en 1964, puis que certaines parties sont devenues des réserves intégrales en 1974 et 1992 ; c’est encore sous leur égide que l’île a été déclarée patrimoine mondial de l’Unesco, en 1994. Enfin, c’est grâce à leur combat que la route appelée Seibu-rindo, réputée comme incontournable pour qui veut découvrir Yakushima, n’a pas été agrandie. Cette route serpente à travers le parc national sous le couvert des arbres qui, en se rejoignant par endroits, forment un tunnel végétal.
Ce travail de protection a renforcé l’attractivité de l’île en tant que destination touristique. Ce succès repose sur la relation étroite que, dès le départ, les chercheurs ont nouée avec les habitants et les autorités administratives. De nombreuses associations ont été créées et, régulièrement, des conférences sont organisées. Informations et préoccupations y sont partagées afin que d’une réflexion collective émergent des solutions associant respect des activités humaines et conservation.
La primatologie japonaise
La primatologie japonaise est, à bien des égards, précurseur de la primatologie occidentale moderne. En 1948, le chercheur Imanishi est allé étudier, avec deux étudiants devenus célèbres, Itani et Kawamura, les macaques de l’île de Koshima. Son objectif était de comprendre l’origine de la société humaine. Pour ce faire, il a utilisé une méthode éthologique devenue classique en primatologie : l’identification et l’observation individuelle des animaux. Il a aussi eu recours à la distribution de nourriture pour les habituer à l’homme, méthode qui sera employée par Jane Goodall avec les chimpanzés, quelques années plus tard. L’observation quotidienne d’animaux dans leur milieu naturel faisait écho à la démarche méthodologique et contemporaine des éthologues européens Tinbergen et Lorenz. Aux États-Unis, cette approche fut novatrice, car les chercheurs travaillaient, sous l’impulsion du courant behavioriste, sur des animaux captifs.
Les apports scientifiques d’Imanishi, d’Itani et de Kawamura sont nombreux. Ce sont les premiers à avoir mis en évidence les mécanismes sociaux régissant la vie de groupe des macaques sauvages. Imanishi proposa le concept de culture animale pour les décrire, concept qui continue de faire débat en sciences… et bien au-delà de la seule primatologie. En 1953, Kawamura rapporta le comportement innovant d’une jeune femelle, Imo, qui lavait dans l’eau de mer les patates douces distribuées par l’homme pour en retirer les grains de sable. Elle fera de même, plus tard, avec du riz. Ce comportement de lavage s’est ensuite transmis aux autres jeunes puis a été diffusé entre les générations. Imanishi et Itani seront aussi les premiers primatologues à étudier les grands singes en Afrique. Leurs travaux influenceront de nombreux étudiants et chercheurs.
Nous devons à Imanishi Le monde des êtres vivants, un livre dans lequel il propose une approche globale (holistique) et philosophique de la biologie pour expliquer pourquoi l’homme vit en société. Largement ignoré hors des frontières japonaises, bien que proposant une alternative à un certain réductionnisme de la théorie darwinienne, cet ouvrage a façonné la primatologie japonaise moderne… dont le dynamisme est toujours salué.
———————————————————————————————————————-
Bibliographie
Dagg C (2009) Ishoku Dougen: the medicinal use of plants and clays by wild Japanese macaques. Ph.D. Dissertation, Department of Anthropology, University of Georgia, Athens.
Forbey JS, Harvey AL, Huffman MA, Provenza FD, Sullivan R, Tasdemirk D (2009). Exploitation of secondary metabolites by animals : A response to homeostatic challenges. Integrative and Comparative Biology, 49, 314-328.
Hladik M (1998). Aliments et médicaments : des « traditions » chez les chimpanzés et de leurs interprétations. In : Ducros A, Ducros J & Joulian F, la culture est-elle naturelle ? Histoire, épistémologie et applications récentes du concept de culture. Paris Editions Errance, 151-161.
Huffman MA (2003). Animal self-medication and ethnomedicine : exploration and exploitation of the medicinal properties of plants. Proceedings of the Nutrition Society, 62, 371-381.
Krishnamani R, Mahaney WC (2000). Geophagy among primates : adaptive significance and ecological consequences. Animal Behaviour, 59, 899-915.
Nègre A, Tarnaud L, Roblot JF, Gantier JC, Guillot J. (2006). Plant consumed by Eulemur fulvus in Comoros Islands (Mayotte) and potential effects on parasites of the intestinal tract. International Journal of Primatology, 27: 1495-1517.
Rodriguez E, Wrangham RW (1993). Zoopharmacognosy : the use of medicinal plants by animals. In : Downum KR, Romeo JT &
Stafford H, Recent advances in phytochemistry.
Simmen B, Tarnaud L (2011). Utilisation des sécrétions de myriapodes chez les lémurs et les sapajous : fonction urative ou signalisation sociale ? Revue de primatologie [En ligne], 3 | 2011.
Vitazkova SK, Long E, Paul A, Glendinning JI (2001). Mice suppress malaria infection by sampling a “bitter”chemotherapy agent. Animal Behaviour, 61, 887-884.
Tarnaud L, Yamagiwa J. (2008). Age-dependent patterns of intensive observation on elders by free-ranging young Japanese macaques (Macaca fuscata yakui) within foraging context on Yakjushima. American Journal of Primatology, 70: 1103-1113.
Tarnaud L. (2004). Ontogeny of feeding behaviour of Eulemur fulvus in the dry forest of Mayotte. International Journal of Primatology, 25: 803-824.
Thierry B (2007). Unity in diversity : Lessons from macaques societies. Evolutionary Anthropology, 16 : 224-238.
Yamagiwa J (2008). History and present scope of field studies on Macaca fuscata yakui at Yakushima island, Japan. International Journal of Primatology, 29 : 49-64.
Yamagiwa J., Izawa K., Maruhashi T. (1998). Long-term studies on wild Japanese macaques in natural habitats at Kinkazan and Yakushima: Preface. Primates, 39, 255–256.
Pour en savoir plus (en français) :
Danchin E., 2011. L’hérédité non génétique. Regards et débats sur la biodiversité, SFE, Regard n°25 du 13 décembre 2011.
Jozet-Alves C., 2012. Les animaux se projettent-ils dans le temps ? Regards et débats sur la biodiversité, SFE, Regard n°29 du 8 mars 2012.
Teyssèdre A., 2006. La Communication animale. Paris, Delachaux et Niestlé. (Et Les stratégies sexuelles des animaux. Paris, Nathan, 1995.)
Ce « regard » est une version éditée par Anne Teyssèdre et complétée par l’auteur, pour la plateforme SFE, de l’article « Les yakuzarus, macaques de l’île Montagne » paru dans le n°6 d’ESpèces de décembre 2012.
——







Merci pour cet article très intéressant !
Une petite question : vous évoquez une copulation de 41% des femelles avec des mâles d’un autre groupe. Au regard de la dispersion des mâles, on s’attend à ce que le risque de consanguinité soit quasi nul en cas de copulation avec un membre du groupe, et pourrait même augmenter en copulant avec un mâle d’un autre groupe. Est-ce qu’il a été mis en évidence des bénéfices de cette copulation avec des mâles extérieurs ? Est-ce un choix de la femelle ou un « kidnapping » de la part des mâles (à l’instar des mâles dits satellites de certaines espèces…) ? Est-ce que des critères de choix du mâle par les femelles ont déjà été mis en évidence chez cette espèce ?
Deuxième question : la sexe-ratio est équilibrée à la naissance mais se biaise en faveur des mâles, alors que vous affirmez que le développement d’un mâle est plus couteux. Connaissez-vous les raisons de cette mortalité des femelles ? Le déséquilibre que vous évoquez à propos des années à forte production fruitière résulte, si je comprends bien, d’un biais de naissance cette fois. Dans ce cas, cela sous-entendrait un bénéfice pour les femelles à produire des mâles ?
En espérant que mes questions ne soient pas trop naïves, je vous souhaite une bonne continuation !
Il n’a pas été prouvé que les copulations extragroupes apportaient un bénéfice particulier aux femelles. Il est généralement avancé comme hypothèse que ces femelles « vagabondes » réduisent le stress associé aux harcèlements des mâles résidents. Cela serait une stratégie supplémentaire à celles développées à l’intérieur du groupe pour réduire ce stress : copulation avec plusieurs mâles mais avec le mâle dominant au moment de la réceptivité (stratégie de gardiennage pour le mâle) pour écourter la période de fertilité (Matsubara, Sprague, 2004, vol 25, pp 901-917).
Pour le sexe ratio, j’ai peur de ne pas avoir de réponse et je crains que la littérature ne soit pas d’une grande aide dans le sens ou les résultats semblent contradictoires. Ceci dit, la théorie suppose que les mâles soient plus couteux à produire que les femelles pour les mères chez les primates non humains (PNH). Par exemple, chez le macaque rhesus, les poids des mâles à la naissance et à un an sont supérieurs à ceux des femelles (Fred et al., 1993, Behavioral Ecology and Sociobiology, Vol 32, pp 103-109). Il est donc intéressant pour les femelles de produire des mâles les années à forte disponibilité alimentaire. Je n’ai, par contre, aucune explication à fournir pour la surmortalité constatée des femelles de plus de 3 ans. Est-ce associé à un stress pour des individus qui deviennent primipares ?
Bonjour,
Pour compléter la réponse de Laurent, j’aimerais souligner que les variations du sex-ratio à la naissance chez les espèces de primates polygames (ou plus exactement polygynes) est un casse-tête pour nombre de chercheurs depuis plus de vingt ans. Selon la théorie de l’allocation maternelle des sexes (sex allocation), ce sex-ratio à la naissance devrait/pourrait varier avec le statut social et/ou l’âge de la mère, mais également avec la richesse/saturation du milieu (compétition pour les ressources locales), qui varie elle-même entre populations et d’une année à l’autre. Résultat : le sex-ratio à la naissance dévie significativement de 50:50 (autant de nouveaux-nés mâles que femelles) chez de très nombreuses espèces de primates polygynes, mais pas dans le même sens selon l’espèce ou la population étudiée.
Un article de synthèse (méta-analyse) assez récent à ce sujet : « Birth sex ratio and social rank: consistency and variability within and between primate groups » de Gabriele Schino, Behav. Ecol. 15, pp 850-856, 2004.
Voir aussi cet article de Craig Packer et al, 2000 : « Problems with primate sex ratios », Phil. Trans. R. Soc. Lond. B 355, 1627-1635.
Votre article, passionnant pour une philosophe, pose « l’éternelle » question, pas si éternelle que ça, d’une conscience animale…
Pourquoi les animaux, en l’occurrence les macaques de l’île de Yakushima, choisissent-ils des plantes ? Comment le sait-on ?
Ne mangent-ils pas n’importe quoi ? Pourquoi ?
Qu’est-ce qui laisse croire à une (auto) médication ?
Pourquoi les petits observent-ils leur mère ?
Pourquoi les Japonais s’intéressent-ils à l’éthologie avec pertinence ?
Certaines croyances occidentales sont-elles autant d’ « obstacles épistémologiques »à l’éthologie ?
Cordialement.
L’éthologie pose « naturellement » le problème de la conscience animale (ou d’une certaine conscience animale car il reste à déterminer sa nature et sa portée) en démontrant que le développement des comportements et leurs l’expressions résultent d’un va et vient complexe non linéaire et indirect, plus ou moins neurologiquement intégré, entre prédéterminations génétiques et influences environnementales.
Pourquoi les yakuzarus et plus largement les primates choisissent-ils des plantes ? D’abord pour couvrir leurs besoins énergétiques et nutritionnels, besoins qui varient selon le sexe, l’âge et le statut reproducteur de l’individu. Il existe une littérature riche sur cette thématique (Nutrient Requirements of Nonhuman Primates, 2003. The National Academic Press, Washington DC. Www. Nap.edu). A savoir toutefois, que nos connaissances proviennent d’un petit nombre de modèles animaux et qu’il reste encore bien des questions à résoudre (notamment celles des stratégies alimentaires des primates où plusieurs théories s’affrontent).
L’histoire évolutive de l’espèce joue aussi un rôle important au travers des adaptations des systèmes digestifs (Chivers DJ. 1992. Diets and guts. In: The Cambridge Encyclopedia of Human Evolution, Cambridge University Press, pp. 60-64.). Il peut y avoir une dimension hédonique à la prise alimentaire même si elle est très difficile à prouver. La consommation d’aliments riches en sucre avant les autres moins riches mais également disponibles chez le singe capucin et l’enfant nous renseigne sur cet aspect (Adessi et al. 2004. Taste perception and food choices in capuchin monkeys and human children. Primatologie. 2004; 6: 101–128). (A suivre…)
Suite des réponses en pointillés…
Pourquoi « croire » à l’automédication. ? Parce que certaines observations la sous-entendent. L’exemple le plus proche de nous est la purge du chat, la consommation d’une herbe pour se faire vomir. Chez les primates, en 1977, Wrangham (Feeding behavior of chimpanzees in Gombe National Park, Tanzania. In : Clutton-Brock TH, Primate Ecology : studies of feeding and ranging behaviour in lemurs, monkeys and apes, New-York, New-York Academic Press, 503-538.) observe des chimpanzés ingurgitant sans mastiquer des feuilles d’ Aspilia mossambicensis, une herbacées ne faisant pas partie de leur régime alimentaire habituel. Les feuilles sont ensuite retrouvées dans les fèces des animaux avec des parasites intestinaux piégés dans leur pilosité (Wrangham RW, Nishida T (1983). Aspilia spp. leaves : a puzzle in the feeding behavior of wild chimpanzees. Primates, 24, 276-282). Mais l’observation seule est insuffisante à déclarer une ingestion, automédication (exemple d’un comportement susceptible d’avoir 2 fonctions différentes dans la revue de Primatologie, -Simmen, Tarnaud, 2011. Utilisation des sécrétions de myriapodes chez les lémurs et les sapajous : fonction curative ou signalisation sociale ? http://primatologie.revues.org/644).
Toute la difficulté est de pouvoir associer un comportement de consommation d’un item particulier à un statut sanitaire (malade) et à son effet curatif. Cela est d’autant plus difficile que les animaux ne sont malades que ponctuellement. Les observations sont donc rares et souvent anecdotiques, notamment en milieu naturel. Les preuves sont donc peu nombreuses et comme le propose Hladik (référence dans l’article) il faudrait distinguer l’automédication préventive (ingestion en petites quantités de parties de plantes contenant des molécules bénéfiques sur l’état de santé) de l’automédication curative comme présenté, ci-dessus, avec l’exemple du chimpanzé. La faiblesse des preuves n’enlève rien à la pertinence du questionnement et aux observations des chercheurs. (A suivre…)
Suite des réponses en pointillés…
Pourquoi les jeunes observent-ils les adultes ? Pour apprendre, pour avoir « rapidement » une « maîtrise » de l’environnement et profiter de l’expérience du groupe. La transmission socialement facilitée du quoi, où et quand mangé fait écho aux prédetermination génétiques de l’individu (appétences pour le sucré, rejet de l’amer et de l’acide) et aux premières transmissions mère-foetus des falveurs.
La mère est un modèle logique puisque, chez les mammifères, elle est le support nourricier des premiers âges via le lait. C’est à son contact que le jeune réalise ses premières expériences. Chez les macaques du Japon, la contrainte sociale renforce cette situation. Les animaux entretiennent des relations de dominance marquées et agressives à l’intérieur du groupe et il est « dangereux » pour le jeune d’observer (à courte distance) des individus qui ne sont pas issus de la lignée maternelle. (A suivre)
(suite et fin)
La question de la relation entre la culture japonaise et l’éthologie est difficile et je doute d’être bien placé pour y répondre. J’ai le sentiment qu’au Japon les relations interindividuelles priment sur les individus eux mêmes. La langue japonaise et ses différents niveaux d’expression, fonction du statut de l’interlocuteur (âge, position sociale, profession), en rendent compte.
L’éthologie propose, dans une certaine mesure, une approche similaire. L’expression et la compréhension des comportements sont situationnelles. Le comportement prend sens dans l’interaction. Sa signification n’est pas seulement liée à un ou des attributs intrinsèques. L’écologue japonais Imanishi pense d’ailleurs que l’évolution des individus et des espèces dépend de cette interaction constante entre l’individu et l’environnement, les deux s’influençant mutuellement. Il critique à ce titre la théorie néodarwinienne et son réductionnisme génétique et le fait que l’environnement ne soit appréhendé que sous la forme de pressions de sélection unidirectionnelles qui s’imposent à l’individu ou l’espèce.
L’approche scientifique occidentale est une approche de l’objet et de ses attributs avant d’être une approche des interactions. C’est sans doute pourquoi l’éthologie, science de l’évolution parmi d’autres, reste mal intégrée à la théorie de l’évolution. Darwin s’y est essayé mais l’approche réductionniste a relégué le comportement à une « expression de… ». Quant à l’écologie comportementale, elle se démarque mal d’un certain réductionnisme et d’une démarche adaptationniste. Il est possible que dans un futur proche l’amoncellement des preuves des influences épigénétiques et plus largement comportementales sur l’expression des gènes change notre vision de l’éthologie.
Bonjour,
Cette suggestion de Laurent, d’une adéquation entre culture japonaise et éthologie, me paraît très intéressante appliquée plus précisément à la primatologie, et non pas à l’éthologie de manière générale.
Chez les animaux, vertébrés comme « invertébrés », de nombreux comportements (individuels) sont dirigés vers d’autres individus de l’espèce : partenaires sexuels, progéniture, congénères chez les espèces sociales… En occident comme ailleurs, il me semble que l’éthologie s’intéresse très largement aux interactions comportementales, surtout chez les espèces sociales (mammifères, oiseaux, fourmis..); et l’écologie comportementale tente de comprendre l’évolution de ces interactions/comportements, associée à celle des caractères physiques/anatomiques des organismes. [C’est par exemple ce qu’a fait Darwin dès la fin du 19e siècle, dans son livre »L’Ascendance de l’Homme et la sélection sexuelle »].
Bien qu’ignare en culture japonaise, je ne dirais pas que pour celle-ci les relations interindividuelles priment sur les individus, comme le suggère Laurent, mais plutôt que les relations interindividuelles y sont largement déterminées par les liens de parenté et le statut social des individus, plus que dans la plupart des sociétés occidentales. [Ces différences culturelles, entre sociétés « égalitaires » et « non égalitaires », peuvent être étudiées avec une approche d’anthropologie familiale telle que proposée par Emmanuel Todd (cf. par exemple « La diversité du Monde », Le Seuil, 1983, 1999.)]
Or cette importance majeure des liens de parenté dans la détermination du statut social, et du statut social dans les relations interindividuelles, caractérise diverses espèces de primates aux sociétés complexes, dont en particulier… les macaques du Japon, étudiés par des primatologues japonais depuis plus de 60 ans. Préparés par leur culture à privilégier les liens de parenté, les déterminants du statut social et l’importance de la hiérarchie, dans l’analyse/la compréhension des relations interindividuelles, Imanishi, Itani et Kawamura ont peut-être pu décrypter plus facilement que des occidentaux le comportement des macaques japonais et le fonctionnement de leurs sociétés matrilinéaires hiérarchisées.
L’éthologie « occidentale » étudie cependant les comportements sociaux (donc interactions sociales) et les sociétés animales depuis plus de cinquante ans, et c’est un jeune chercheur anglais travaillant sur le comportement social énigmatique des fourmis (dont les sociétés sont formées d’une multitude d’ouvrières stériles, assistant une seule femelle reproductrice), William Hamilton, qui a le premier en 1964 analysé l’évolution de comportements sociaux en fonction des relations génétiques entre individus, pour formaliser les notions de valeur sélective inclusive et de sélection de parentèle, fondant avec Edward Wilson la sociobiologie…
Anne
Merci Anne pour ce commentaire qui apporte de la profondeur à mon propos tout en le nuançant. Je n’aurais su dire mieux.