Pour la Saint Sylvestre, la Société Française d’Ecologie (SFE) vous propose le regard d’un paléontologue et d’une écologue, Gildas Merceron et Anne Teyssèdre, sur l’écologie et l’évolution des grands singes du Miocène.. et d’aujourd’hui.
Ce double regard est introduit par une vidéo, brève interview de Gildas Merceron sur le sujet, réalisée par Sophie Ben Sadoun pour le CNRS en 2010.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions à la suite de ces articles et vidéos. Les auteurs vous répondront et une synthèse des contributions sera ajoutée après chaque regard.
- Où sont passés les grands singes ? Interview de Gildas Merceron (vidéo)
- Regard sur les grands singes du Miocène… et d’aujourd’hui, par G. Merceron et A. Teyssèdre
- Glossaire et bibliographie
- Forum de discussion sur ce regard
Où sont passés les grands singes ?
Exposé de Gildas Merceron (vidéo)
Vidéo réalisée par Sophie Bensadoun, CNRS-Images, 2010
Vidéo extraite de la série « Un Monde Vivant – Histoires de biodiversité »,
de Sophie Bensadoun, CNRS-Images, 2010,
en ligne sur le site de la vidéothèque du CNRS
Regard sur les grands singes du Miocène…
et d’aujourd’hui
par Gildas Merceron1 et Anne Teyssèdre2
(1) : Chargé de recherche CNRS à l’iPHEP, UMR 7262, CNRS et Université de Poitiers
(2) : Ecologue et médiatrice scientifique (SFE),
chercheuse associée au Département d’Ecologie du Muséum National d’Histoire Naturelle
Regard R40, édité par Anne Teyssèdre
( Fichier PDF )
Mots clés : Grands singes, Hominoïdes, primates, communautés, diversité, Miocène,
paléontologie, évolution, écologie, dynamique, changements globaux,
habitats, homogénéisation biotique, Anthropocène.
———
Les paléontologues s’intéressent aux faunes du passé. Les écologues cherchent à comprendre le fonctionnement, la distribution et la dynamique des systèmes écologiques tels que populations, communautés et écosystèmes. La paléoécologie peut consister à analyser les interactions, l’évolution, la distribution et la dynamique d’espèces et communautés passées à l’aide des concepts, mécanismes et outils de l’écologie. Dans cet article, nous nous intéresserons à la diversité passée des primates hominoïdes ou grands singes (apes en anglais), principalement au cours du Miocène* moyen et supérieur, il y a entre 14 et 8 millions d’années (Ma) environ, et comparerons brièvement la dynamique de ces espèces à celle des grands singes actuels.
Grandeur et décadence des grands singes du Miocène
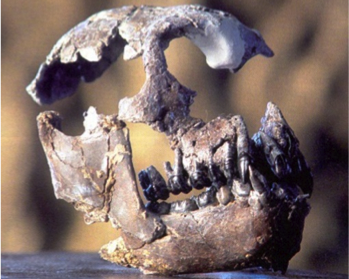
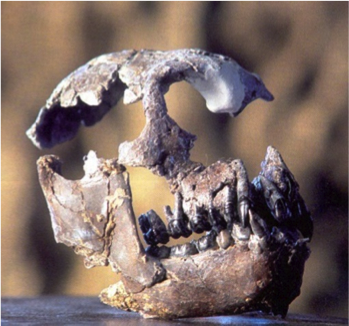
 Avec une première occurrence probable en Afrique il y a environ 25 Ma (à la fin de l’Oligocène ou au début du Miocène), la lignée buissonnante ou « superfamille » des hominoïdes rassemble plusieurs familles de primates catarhiniens*, dont deux sont encore représentées aujourd’hui : les hominidés – représentés aujourd’hui par l’Homme, les Chimpanzés commun et bonobo, le Gorille et l’Orang outan – et les hylobatidés, famille des actuels gibbons et siamangs (Nelson, 2003; Begun, 2007; et voir la Fig.1 ).
Avec une première occurrence probable en Afrique il y a environ 25 Ma (à la fin de l’Oligocène ou au début du Miocène), la lignée buissonnante ou « superfamille » des hominoïdes rassemble plusieurs familles de primates catarhiniens*, dont deux sont encore représentées aujourd’hui : les hominidés – représentés aujourd’hui par l’Homme, les Chimpanzés commun et bonobo, le Gorille et l’Orang outan – et les hylobatidés, famille des actuels gibbons et siamangs (Nelson, 2003; Begun, 2007; et voir la Fig.1 ).
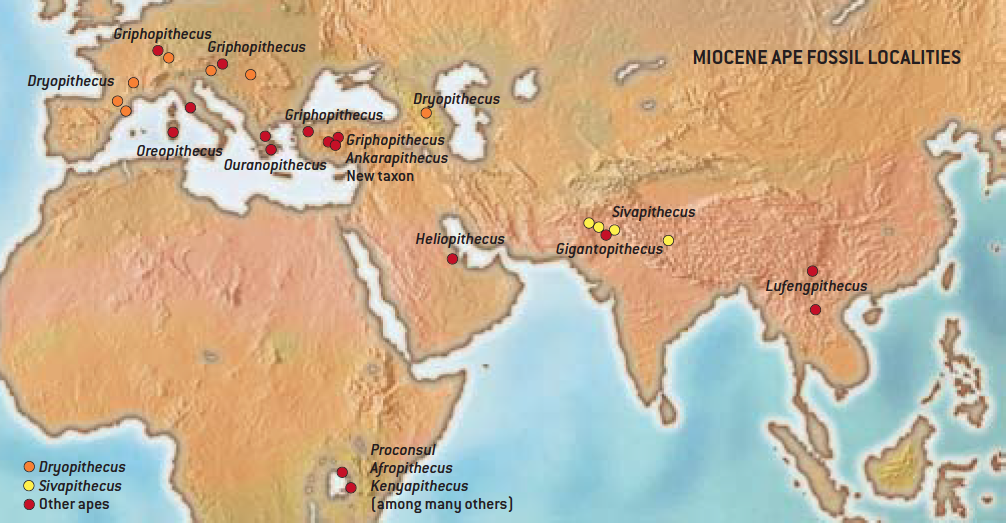
L’Eurasie a été au Miocène moyen le théâtre de la diversification florissante (radiation) de ces primates hominoïdes, antérieure à celles des hominidés en Afrique. Plus de dix genres de grands singes fossiles ont été reconnus pour cette période sur ce vaste continent, depuis la péninsule ibérique jusqu’en Asie du Sud Est (Nelson, 2003; Begun, 2007; Casanovas-Vilar et al., 2010; et voir la Fig.2 ).
Alors que l’évolution des hominoïdes fut probablement continue en Asie du Sud-Est, compte tenu des diversités fossiles et actuelles des hominoïdes dans cette région (Rowe, 1996; Chaimanee et al., 2003, 2004; Jaeger et al. 2011), une histoire évolutive différente marque le reste de l’Eurasie et tout particulièrement l’Europe. Les hominoïdes s’y éteignent graduellement, probablement d’Ouest en Est, et avec un pic important il y a 8,7 Ma c’est-à-dire à la limite entre deux étages géologiques du Miocène bien distincts par leur faune mammalienne (étages dits biochronologiques), le Vallésien* et le Turolien* (Bonis et al., 1992; Andrews et al., 1996; Casanovas-Vilar et al., 2010).
Tandis que les hominoïdes s’éteignent en Europe, une dispersion importante de singes colobinés, représentants d’un autre groupe de primates catarhiniens* originaire d’Afrique, les cercopithécoïdes* (old world monkeys en anglais), s’opère à travers tout le continent. Mais à l’inverse des hominoïdes, les colobinés sont très peu diversifiés puisqu’un seul genre, Mesopithecus, y est reconnu au Turolien (Andrews et al., 1996; Koufos, 2009).
Parallèlement, un autre groupe de primates catarhiniens aujourd’hui disparu connaît en Europe un sort comparable à celui des grands singes. Il s’agit des pliopithécoïdes*. Très diversifiés au Miocène moyen et supérieur (pas moins de 10 espèces sont reconnues en Europe), les pliopithécoïdes ont cohabité avec les grands singes en Europe de l’Ouest et centrale pendant plusieurs millions d’années (Begun, 2002). Ils disparaissant d’Eurasie vers la fin du Miocène.
L’enquête du paléontologue (GM)
Mon travail a visé à comprendre les conditions environnementales qui ont favorisé en Europe, au Miocène supérieur, cette baisse générale de la diversité des espèces de primates, la disparition des grands singes et la dispersion de ce petit singe colobiné sur l’ensemble du continent.
Différentes études ont montré que l’hétérogénéité de l’environnement, associée à des conditions climatiques stables dans le temps, était un facteur majeur pour le maintien d’une haute diversité d’espèces (ou diversité spécifique, Griffin et al., 2009). J’ai posé l’hypothèse que la chute de la diversité des primates européens était une réponse à l’homogénéisation des conditions environnementales à travers l’Europe.
La dynamique des environnements est ici décryptée avec une approche indépendante: C’est la reconstitution du régime alimentaire des mammifères herbivores fossiles qui est utilisée pour décrire les environnements. Pour mener cette recherche, je me suis tout particulièrement intéressé aux ruminants (notamment cervidés et bovidés) qui ont cohabité, soit avec les grands singes, soit avec le singe colobiné. Ces ruminants composent un modèle robuste car (i) ils dominent les communautés de grands herbivores depuis le Miocène inférieur, (ii) ils occupent une vaste gamme d’environnements, depuis la forêt équatoriale jusqu’à la toundra arctique, (iii) leur régime alimentaire de type végétarien reflète les conditions environnementales locales.
J’ai focalisé ma stratégie d’échantillonnage sur trois aires géographiques le long d’un axe NO-SE, depuis l’Allemagne jusqu’en Grèce. J’ai aussi strictement limité mon étude aux localités d’âge mammalien Vallésien* et Turolien* inférieur (entre 10 et 8 Ma), période au cours de laquelle la chute de diversité des primates a atteint son paroxysme. Ainsi, j’ai pu définir et comparer le régime alimentaire de six communautés de ruminants à cette époque charnière. Les plus anciens ruminants d’âge Vallésien ont co-évolué avec les derniers hominoïdes(1), alors que les ruminants turoliens ont poursuivi leur évolution après l’extinction des grands singes.
J’ai reconstitué l’alimentation de ces ruminants avec une approche indépendante de la taxonomie (systématique) et de l’anatomie, qui consiste à quantifier l’usure micrométrique de l’émail sur les facettes dentaires qui ont coupé la nourriture. Selon les dimensions et la densité de ces différentes usures dentaires, on peut caractériser le régime alimentaire (Merceron et al., 2005; Peigné et al., 2009; Boisserie et al., 2005). Par l’examen de sa dentition, on peut donc savoir si une espèce consommait des feuilles, au même titre qu’un chevreuil, ou si elle consommait des graminées, comme un gnou le fait aujourd’hui dans la savane africaine.
Les résultats montrent très clairement que la diversité des grands singes, avant 8,7 Ma, est associée à une diversité des paysages. En effet, les ruminants du Vallésien montrent des usures dentaires donc des régimes alimentaires très différents d’une région à l’autre. Au Nord de la Grèce, ils consommaient des graminées abrasives en grande quantité, tandis qu’en Europe occidentale et centrale l’étude de leur dentition renvoie un signal de brouteurs de feuillages et fruits. Par conséquent, les paysages fréquentés à l’époque par les grands singes étaient plus boisés en Allemagne et en Hongrie qu’en Grèce (Merceron et al., 2010).
Après 8,7 millions d’années, il apparait que les différences de régimes alimentaires des ruminants sont considérablement atténuées. En effet, la part de graminées dans les bols alimentaire et la proportion des ruminants consommateurs de graminées augmentent à l’Ouest et diminuent à l’Est. Les régimes alimentaires de ces herbivores étant beaucoup plus uniformes sur l’ensemble de l’Europe, c’est une homogénéisation des conditions environnementales qui est mise en évidence (Merceron et al., 2010).
La diversité et la relative stabilité des environnements en Europe au Miocène moyen a probablement favorisé le maintien d’une grande diversité d’espèces chez les primates hominoïdes (et pliopithécoïdes) de ce continent (Begun et al., 2006; Hamon et al., 2012). Il est fort probable que le changement climatique et environnemental qui s’est opéré au Miocène supérieur après 8,7 Ma a plutôt favorisé une certaine homogénéisation environnementale, et donc l’expansion d’une seule et unique espèce de singe.
Des travaux intégrant des analyses géochimiques des isotopes du carbone et de l’oxygène contenus dans l’émail des ruminants fossiles sont en cours d’étude. Les résultats complèteront notre connaissance des variations des conditions climatiques et des végétations alors que les grands singes s’éteignent dans le nord de la Grèce.
Le regard de l’écologue (AT)
Les recherches des quinze dernières années en écologie et biogéographie montrent que la transformation massive des habitats terrestres et aquatiques, qu’elle soit liée au changement d’usage des terres (agriculture, urbanisation..), à la pollution physico-chimique (engrais, pesticides..) ou au changement climatique, est un facteur majeur d’érosion de la biodiversité et de transformation des communautés (ex : Vitousek et al. 1997 ; Sala et al. 2000 ; Rosenzweig 2001 ; Bradshaw et al. 2009, et voir par exemple les regards 6, 16, 22, 30 et 37 sur cette plateforme).
Au plan théorique comme en pratique, les résultats de ces recherches indiquent plus précisément que le bouleversement massif des écosystèmes lié aux activités humaines induit tout à la fois le déclin d’espèces spécialistes, vulnérables au changement de leurs conditions de vie, et l’expansion d’espèces généralistes qui, moins exigeantes sur les conditions de vie locales, sont de ce fait plus compétitives dans les habitats perturbés ou transformés (ex : Mc Kinney et Lockwood 1999 ; Olden et Ronney, 2006 ; Clavel et al. 2010 ; et voir regard n°16). Tandis qu’à l’échelle locale voire régionale ces dynamiques opposées peuvent se traduire par une augmentation temporaire du nombre total d’espèces, et par une désorganisation des écosystèmes locaux (réseaux écologiques, cf. regard n°30), elles se soldent à plus vaste échelle et à moyen terme par une perte nette d’espèces et par l’homogénéisation structurale et fonctionnelle des communautés animales et végétales.
De l’échelle locale aux échelles régionale et supérieures, la modélisation prévoit en tout cas une baisse de l’indice de spécialisation moyen des espèces, et donc des communautés, avec la fragmentation et la transformation progressive des habitats (Teyssèdre et Robert 2013), que des chercheurs ont d’ores et déjà, pour certaines communautés, vérifiée sur le terrain (Devictor et al 2008 ; Le Viol et al. 2012). La dynamique actuelle des primates hominoïdes, entre autres taxons, correspond clairement à ce schéma : déclin des grands singes d’Afrique et d’Asie, spécialistes des forêts tropicales humides, expansion de notre espèce généraliste sur l’ensemble du Globe.
Peut-on utiliser les résultats de ces recherches en écologie pour mieux comprendre l’évolution des communautés de primates en Europe au Miocène, décrite dans cet article ?
Le déclin des hominoïdes et pliopithèques d’Europe, en réponse aux changements de l’environnement du Miocène supérieur, suggère que ces espèces étaient spécialistes de leurs habitats respectifs et qu’elles n’ont pu faire face à ces changements. Les données paléontologiques confirment-elles cette hypothèse écologique ?
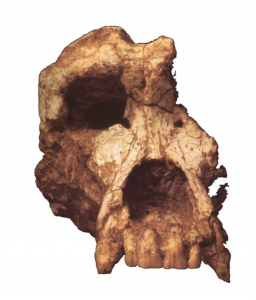
Les grands singes considérés dans cette étude ont été Dryopithecus ? en Allemagne (Franzen et al., 2003), Rudapithecus brancoi en Hongrie (Kordos and Begun, 2001), et Ouranopithecus macedoniensis en Grèce (Bonis et al., 1990). Selon Gildas, l’anatomie (post-crânienne et dentaire) et les micro-usures dentaires des deux premières espèces indiquent qu’elles avaient probablement un mode de vie forestier semblable à celui des chimpanzés ou des orangs outans actuels (Begun et al., 1990; Ungar, 1996; Kordos and Begun, 2002; Nargolwalla and Begun, 2005), et leur absence d’Europe de Sud-Est – où la faune fossile signale très clairement des milieux ouverts – suggère qu’elles étaient inféodées aux forêts. De même, l’anatomie et la distribution géographique des pliopithèques au Miocène indiquent qu’il s’agissait d’espèces arboricoles forestières.
Au nord de la Grèce, Ouranopithecus quant à lui avait une écologie surprenante pour un grand singe. Son mode de vie était très vraisemblablement similaire à celui d’un babouin consommant des objets coriaces (tubercules, noix) dans des environnements ouverts (Bonis and Melentis, 1977, 1978 ; Ungar, 1996; Merceron et al., 2005).
L’ensemble des données sur l’anatomie et la distribution des primates considérés dans cette étude, avant les changements environnementaux du Miocène supérieur, indique donc qu’il s’agissait pour la plupart d’espèces spécialistes de leur habitat.
L’expansion du colobiné Mesopithecus (au Miocène supérieur) dans l’ensemble de l’Europe, probablement depuis le nord de l’Afrique et à travers savanes, forêts et prairies, indique en revanche que ce singe était généraliste. Cette assertion est confirmée par les études du squelette post-crânien qui en fait un singe semi-terrestre, et par les analyses de micro-usures dentaires qui dépeignent une alimentation variée, – alors que la majorité des colobinés actuels sont folivores (Merceron et al., 2009a; 2009b; Youlatos and Koufos, 2010; Clavel et al., 2012).
Il est donc tentant de faire un parallèle entre les dynamiques des communautés de primates en Europe au Miocène supérieur et sur l’ensemble du Globe aujourd’hui. Aux deux époques, en réponse aux changements ou à la disparition de leur habitat, les espèces spécialistes des forêts se sont raréfiées (ou se raréfient actuellement) au profit d’une minorité d’espèces généralistes, capables de se nourrir et prospérer dans des habitats variés, ouverts (ex : prairies) ou « fermés » (forêts).
Tout comme le colobiné généraliste Mesopithecus a colonisé l’Europe au Miocène Supérieur, quelques espèces actuelles de cercopithèques au régime alimentaire et autres exigences écologiques très souples s’adaptent aux changements globaux en cours et colonisent de nouveaux habitats plus ou moins ouverts (dont des habitats agricoles et suburbains, voire urbains !), ignorant leurs cousins primates arboricoles menacés par la destruction des forêts. C’est le cas en particulier du Babouin Anubis en Afrique, du Macaque rhésus et du Langur sacré (un colobiné lui aussi) en Asie.
Le cas des hominoïdes est encore plus frappant : A l’exception de l’Homme et du Chimpanzé commun (Pan troglodytes), toutes les espèces actuelles d’hominoïdes sont inféodées aux forêts tropicales (d’Afrique ou d’Asie) et lourdement menacées par la destruction de leur habitat. Bien qu’omnivore et plus généraliste, le Chimpanzé commun est quant à lui menacé en Afrique non seulement par la destruction de ses habitats (forêt tropicale, bush, savane boisée), mais aussi par la chasse et les épidémies infectieuses (Ebola). Toutes ces espèces se raréfient actuellement au profit d’une unique espèce généraliste d’hominidé, en expansion sur l’ensemble des continents : Homo sapiens.
Epilogue – Quel futur pour les grands singes de l’Anthropocène ?
Bien que similaires et toutes deux liées à la transformation des habitats, ces dynamiques évolutives des communautés de primates il y a quelque 9 Ma en Europe et aujourd’hui sur l’ensemble du Globe diffèrent par un point important : la cause première de cette transformation. Au Miocène supérieur, Mesopithecus n’est en rien responsable des changements climatiques et environnementaux qui ont permis son expansion et favorisé l’extinction des hominoïdes et pliopithèques en Europe. L’espèce –opportuniste- n’a fait que profiter de ces changements.
En revanche, par leur capacité d’action sur l’environnement (ingénierie écologique, ‘progrès’ technologiques), les sociétés humaines –ou plus exactement les sociétés industrialisées- en expansion sont bien la cause principale du bouleversement actuel des écosystèmes, de la transformation massive des habitats et du déclin de nombreuses espèces spécialistes telles que leurs cousins hominoïdes… dont une fraction notable vit aujourd’hui en captivité (cf. photo ci-contre). Homo sapiens est bien l’artisan de la crise actuelle de biodiversité, dite à juste titre de « l’Anthropocène ».
Mais ne nous arrêtons pas à ce sombre constat. A la différence de Mesopithecus, notre espèce peut agir pour freiner la dynamique de transformation des écosystèmes dont elle dépend et le déclin des espèces qui en pâtissent. Les capacités d’ingénierie écologique et d’adaptation au changement démontrées par Homo sapiens depuis des millénaires, qui expliquent son expansion démographique et la dominance croissante des sociétés agricoles puis industrialisées sur terres et mers, s’appuient en effet sur des capacités d’analyse, de communication et d’organi-sation collective hors du commun. Ces capacités cognitives et collaboratives peuvent être appliquées à réduire les pressions des sociétés ‘modernes’ sur les écosystèmes, et ainsi permettre à une bonne partie des espèces spécialistes ou menacées de s’adapter aux changements -moins drastiques- de leurs conditions de vie.
Glossaire
- Anthropocène : Néologisme (construit du grec anthropos, Homme, et de la racine cène indiquant une communauté vivante) désignant la période de changements globaux actuels. Terme popularisé par le Prix Nobel de chimie Paul Crutzen et d’autres scientifiques dans les années 2000, pour souligner le rôle prépondérant de notre espèce dans ces changements, c.-à-d. l’ampleur de l’impact des activités humaines sur l’environnement depuis deux cent ans, voire depuis l’expansion de l’agriculture.
. - Catarhiniens : Distribués dans l’Ancien Monde (à l’exception de l’Homme, de distribution mondiale), les primates catarhiniens incluent les superfamilles des hominoïdes, des cercopithécoïdes et des pliopithècoïdes (groupe fossile). Ils diffèrent des singes sud-américains (platyrhiniens) par un tube tympanique ossifié et par une formule dentaire comportant uniquement deux prémolaires entre canine et molaires (contre trois chez les platyrhiniens).
. - Cercopithécoïdes: Primates catarhiniens, très diversifiés aujourd’hui en Asie et Afrique. Avec une seule famille actuelle (les cercopithécidés), deux sous-familles (les cercopithécinés et colobinés) représentées par plusieurs dizaines d’espèces chacune, les cercopithécoïdes sont les primates les plus diversifiés de l’Ancien Monde. Ils sont présents depuis les Hauts Plateaux éthiopiens (le Gélada) jusqu’aux cimes des forêts équatoriales (le Nasique en Asie). La première occurrence des cercopithécoïdes est africaine et est datée de 23 millions d’années environ. La morphologie occlusale des molaires propres aux cercopithécoïdes est déjà acquise à cette période. C’est seulement au cours du Pliocène et Pléistocène (c.-à-d. depuis 5 Ma) que les cercopithécidés connaissent une véritable radiation adaptative, aboutissant à la diversité actuelle.
. - Hominoïdes : Primates catarhiniens dont la première occurrence est africaine et datée d’environ 25 Ma, comprenant plusieurs familles dont deux actuelles : les hominidés (famille des humains, chimpanzés, gorilles et orangs outans) et les hylobatidés (famille des gibbons et siamangs). Au sein des catarhiniens, les hominoïdes diffèrent des cercopithécoïdes par l’absence de queue et par une morphologie occlusale des molaires plus primitive.
. - Miocène : Division stratigraphique de l’ère tertiaire, subdivisé en Miocène inférieur, moyen, et supérieur. Le Miocène s’étage entre 23,3 et 5,2 millions d’années.
. - Pliocène : Dernière division stratigraphique de l’ère tertiaire, le Pliocène s’étage entre 5,2 et 1,6 millions d’années.
. - Pliopithécoïdes : Primates catarhiniens, groupe-frère du clade regroupant les hominoïdes et les cercopithécoïdes, très diversifiés au Miocène sur toute l’Eurasie. En Europe, la famille des Pliopithécidés comprend deux sous-familles (les crouzéliinés et pliopithécinés), 5 genres et une dizaine d’espèces. Ces primates étaient vraisemblablement inféodés aux milieux forestiers car ils sont absents du Sud-Est de l’Europe au Miocène supérieur, où la faune fossile signale très clairement des milieux ouverts sans couvert arboré dense dans ces régions. Les pliopithécoïdes disparaissent d’Europe avec les grands singes, vers la fin du Miocène.
. - Turolien : Etage mammalien au sein du Miocène supérieur, défini par les assemblages de mammifères. Le Turolien est compris entre 8,7 et 5,2 millions d’années.
. - Vallésien : Etage mammalien au sein du Miocène supérieur, défini par les assemblages de mammifères. Le Vallésien est compris entre 11,9 et 8,7 millions d’années. Ces bornes sont toutefois sujettes à discussion.
.
Bibliographie
Andrews P., Harrison T. et al.,1996. Distribution and biochronology of European and southwest Asian Miocene catarrhines, in: Bernor, R.L., Fahlbusch, V., Mittman, H.W. (Eds.), The Evolution of Western Eurasian Neogene Mammal Faunas. Columbia University Press, New York, pp. 168-207.
Bradshaw CJA, Sodhi NS & Brook BW., 2009. Tropical turmoil – a biodiversity tragedy in progress. Front Ecol Environ 7:79-87.
Begun D. R., 2002. The Pliopithecoidea, in: Hartwig, W.C. (Ed.), The Primate Fossil Record. Cambridge University Press, Cambridge, pp. 221-240.
Begun D. R., 2007. Fossil record of Miocene hominoids. Handbook of Palaeoanthropology 2, 921-977.
Begun D. R., Moya-Sola & S. & Kohler M., 1990. New miocene hominoid specimens from Can Llobateres (Vallès Penedès, Spain) and their geological and paleoecological context. J. Hum. Evol. 19, 255-268.
Begun D. R., Nargolwalla M. C. & Hutchison, M. P., 2006. Primate diversity in the Pannonian basin: In situ evolution, disperals, or both? Beitr. Paläontol. 30, 1 – 12.
Boisserie J.-R., Zazzo et al., 2005. Diet of modern and late miocene hippopotamids: evidence from carbon isotope composition and micro-wear of tooth enamel. Palaeogeogr., Palaeoclimatol., Palaeoecol. 221, 153-174.
Bonis L. de., Bouvrain G. et al., 1990. New hominid skull material from the late Miocene of Macedonia in Northern Greece. Nature 345, 712-714.
Bonis L. de., Bouvrain et al., 1992. Diversity and paleoecology of Greek late Miocene mammalian faunas. Palaeogeogr., Palaeoclimatol., Palaeoecol. 91, 99-121.
Bonis L. de & Melentis J., 1977. Les Primates hominoïdes du Vallésien de Macédoine (Grèce). Etude de la machoire inférieure. Géobios 10, 849-885.
Bonis, L. de. & Melentis J., 1978. Les Primates hominoïdes du Miocène supérieur de Macédoine. Etude de la machoire supérieure. Annales de Paléontologie (Vertébrés). 64, 185-202.
Casanovas-Vilar I. et al., 2010. Updated chronology for the Miocene hominoid radiation in Western Eurasia. P. natl. Acad. Sci. USA 208, 5554-5559.
Chaimanee Y., Jolly D. et al., 2003. A Middle Miocene hominoid from Thailand and orangutan origins. Nature 422, 61-65.
Chaimanee Y., Suteethorn V. et al., 2004. A new orang-utan relative from the Late Miocene of Thailand. Nature 427, 439-441.
Clavel J, Julliard R & Devictor V. 2010. Worldwide decline of specialist species: Toward a global functional homogenization ? Front Ecol Environ 9: 222-28.
Clavel J., Merceron G. et al., 2012. On Mesopithecus habitat: insights from late Miocene fossil vertebrate localities of Bulgaria. J. Hum. Evol. in press.
Devictor V. & Robert A. 2008. Measuring community responses to large-scale disturbance in conservation biogeography. Diversity and Distributions 15: 122–30.
Franzen J.L., Fejfar O. et al., 2000. New discoveries at a classic locality, in: Reumer, J.W.F., Wessels, W. (Eds.), Distribution and migration of tertiary mammals in Eurasia. Deinsea, Rotterdam, pp. 217-234.
Griffin J.N., Jenkins S.R. et al, 2009. Spatial heterogeneity increases the importance of species richness for an ecosystem process. Oikos 118, 1335-1342.
Hamon N., Sepulchre P.et al., 2012. Growth of subtropical forests in Miocene Europe: The roles of carbon dioxide and Antarctic ice volume. Geology 40, 567-570.
Jaeger J.-J., Soe A.N. et al., 2011. First hominoid from the Late Miocene of the Irrawady Formation (Myanmar). PLoS ONE 6, 1-14.
Kordos L. & Begun D., 2001. A new cranium of Dryopithecus from Rudabánya, Hungary. J. Hum. Evol. 41, 689-700.
Kordos L. & Begun D.R., 2002. Rudabanya: a late miocene subtropical swamp deposit with evidence of the origin of the African apes and humans. Evolutionary Anthropology 11, 45-57.
Koufos G.D., 2009. The Neogene cercopithecids (Mammalia, Primates) of Greece. Geodiversitas 31, 817-850.
Le Viol I., Jiguet F. et al., 2012. More and more generalists : two decads of changes in the European avifauna. Biol Lett, in press.
Merceron G., Blondel C. et al., 2005. A new dental microwear analysis: application to extant Primates and Ouranopithecus macedoniensis (Late Miocene of Greece). Palaios 20, 551-561.
Merceron G., Kaiser T.M. et al., 2010. Ruminant diet and the Miocene extinction of European great apes. Proceedings of the Royal Society B 277, 3105-3112.
Merceron G., Koufos G.D. & Valentin X., 2009a. Feeding habits of the first European colobine, Mesopithecus (Mammalia, Primates): evidence from a comparative dental microwear analysis with modern cercopithecids. Geodiversitas 31, 865-878.
Merceron, Scott J. et al., 2009b. Folivory or fruit/seed predation for Mesopithecus, an earliest colobine from the Late Miocene of Eurasia? J. Hum. Evol. 57, 732-738.
McKinney M.L. & Lockwood J.L. 1999. Biotic homogenization: a few winners replacing many losers in the next mass extinction. Trends Ecol Evol 14: 450–53.
Nargolwalla M.C. & Begun D.R., 2005. Late Miocene hominid biogeography and extinction patterns.
Nelson S., 2003. The extinction of Sivapithecus: faunal and environmental changes in the Siwaliks of Pakistan. Brill Academic Press, Boston.
Peigné S., Goillot C. et al., 2009. Predormancy omnivory in European cave bears evidenced by a dental microwear analysis of Ursus spelaeus from Goyet, Belgium. P. natl. Acad. Sci. USA 106, 15390-15393.
Olden J.D. and Rooney T.P., 2006. On defining and quantifying biotic homogenization. Global Ecol Biogeogr 15: 113–20.
Rosenzweig M.L., 2001a. Loss of speciation rate impoverishes future diversity. PNAS 98: 5404-10.
Rowe N., 1996. The pictorial guide to the living primates. Pogonias Press, East Hampton, New York.
Sala O.E., van Vuuren D.P. et al., 2005. Biodiversity across scenarios. Pp 375-408 in Ecosystems and human wellbeing: Scenarios, Carpenter et al (eds). Washington, DC: Island Press.
Spassov N., Geraads D. et al., 2012. A hominid tooth from Bulgaria: The last pre-human hominid of continental Europe. J. Hum. Evol. 62, 138-145.
Teyssèdre A. & Robert A. Contrasted impacts of habitat reduction, conversion and alteration on neutral and non neutral living commmunities (article soumis, en révision).
Ungar P.S., 1996. Dental microwear of European Miocene catarrhines: evidence for diets and tooth use. J. Hum. Evol. 31, 335-366.
Vitousek P.M., Mooney H.A. et al., 1997. Human domination on Earth’s ecosystems. Science 277: 294-99.
Youlatos D. & Koufos G.D., 2010. Locomotor evolution of Mesopithecus (Primates: Colobinae) from Greece: evidence from selected astragalar characters. Primates 51, 23-35.
——
Pour en savoir plus (en français) :
de Bonis L., 1999. La Famille de l’Homme: des lémuriens à Homo sapiens. Belin, Pour la Science.
Clavel J., 2011. L’homogénéisation biotique, une réponse aux changements globaux. Regards et débats sur la biodiversité, SFE, Regard n°16 du 18 avril 2011.
Lavorel S., Barbault R. et J-C. Hourcade, 2012. Impacts et enjeux du changement climatique. Regards et débats sur la biodiversité, SFE, Regard n°30 du 3 avril 2012.
Masson-Delmotte V., 2011. Le climat de notre biosphère. Regards et débats sur la biodiversité, SFE, Regard n°10 du 26 janvier 2011.
Pour la Science, 2007. Sur la trace de nos ancêtres. Dossier Pour la Science n°57, oct.-déc. 2007.
Teyssèdre A., 2007. Quelle Nature voulons-nous ? Observatoires et conservation de la biodiversité. DVD + DVDrom, MNHN, 2007, distribution CNDP (http://www2.cndp.fr/produits/)
Teyssèdre A. et R. Barbault, 2009. Invasions d’espèces : Cause ou conséquence de la perturbation des écosystèmes ? Pour la Science n°376, février 2009, pp. 22-25.
Thompson J.D. et O. Ronce, 2010. Fragmentation des habitats et dynamique de la biodiversité. Regards et débats sur la biodiversité, SFE, Regard n°6 du 18 novembre 2010.




Cet article m’a beaucoup intéressé. J’aurais voulu y faire une foule de remarques. Pour aller au plus court, je m’en tiendrai à une question et une observation.
La question s’adresse à Gilles Merceron. Vos recherches sur l’usure dentaire comme témoin du régime alimentaire et du mode de vie sont très intéressantes, j’aurais aimé des précisions. Vous avez particulièrement étudié Dryopithecus fontani et Rudapithecus brancoi. Ce sont deux espèces apparentées, mais elles n’ont pas vécu à la même époque (D. fontani vivait vers 12 millions d’années, R. brancoi entre 10 et 9.6 millions). L’usure dentaire des deux espèces montre-t-elle des différences significatives dans leur régime alimentaire et leur mode de vie?
Ce qui fait l’intérêt de cette question, c’est que le Rudapithèque (aujourd’hui Hispanopithecus), dans la mangrove de Hongrie où il vivait, paraît davantage spécialisé que le Dryopithèque en un sens strictement arboricole. Si l’usure de ses dents montrait qu’il se nourrissait de feuilles plutôt que de fruits, cela confirmerait sa position comme jalon intermédiaire en direction de l’Oréopithèque, qui se nourrissait lui-même de feuilles et se suspendait aux branches presque aussi volontiers qu’un orang ou un gibbon.
Mon observation concerne la figure 2 du « Regard ». Cette carte nous montre la Méditerranée telle qu’elle est aujourd’hui. C’est une image trompeuse. A certains moments, vers 16 millions d’années, lors de la fameuse « transgression langhienne », le niveau des mers avait tellement augmenté qu’on communiquait directement de l’Atlantique à l’océan Indien et au Pacifique. Aucune communication terrestre n’était possible entre l’Europe et l’Afrique. Au contraire, à partir de 13 millions d’années jusqu’au Pliocène, la Méditerranée s’est peu à peu asséchée. A la fin, on aurait presque pu voyager à pied sec de l’Egypte aux Balkans en marchant sur une croûte salée! Il est certain que ces bouleversements climatiques ont modifié le biotope des Hominoïdes. Ils ont tantôt empêché et tantôt favorisé les échanges de faune et de flore entre l’Europe et les continents voisins.
D’où cette suggestion: Pourquoi un prochain article des « Regards » ne serait-il pas consacré à montrer les changements de la Méditerranée sur une série de cartes (vers 16 millions d’années, vers 14 millions, 12 millions, 10 millions etc.) ? Cela permettrait de comprendre ce qui s’est passé dans l’écologie de l’Europe (climat, faune et flore) beaucoup mieux qu’en se reportant inconsciemment à l’image archi-fausse de notre Grande Bleue telle que nous la voyons aujourd’hui!
Bonjour,
Plongé dans un dossier urgent, Gildas ne pourra répondre à votre question sur la comparaision des régimes alimentaires et la phylogénie de Dryopithecus et Rudapithecus que la semaine prochaine.
[Cependant, le régime alimentaire plus ou moins « folivore » (ou phyllophage) du « Rudapithèque » n’est sans doute pas un argument décisif pour ou contre la position éventuelle de cette espèce comme jalon intermédiaire en direction d’une espèce folivore et arboricole ayant vécu plusieurs millions d’années plus tard (l’Oréopithèque, selon votre hypothèse), car le régime alimentaire de singes arboricoles devrait pouvoir changer en quelques millions d’années (même beaucoup moins) et passer de frugivorie à folivorie dominante en réponse aux changements des conditions de vie. Par exemple, le premier hylobatidé qui a colonisé le Sud-Est asiatique il y a quelques millions d’années, ancêtre des gibbons et siamangs actuels, était probablement frugivore à l’instar de la plupart de ses descendants gibbons; mais l’un de ses descendants, le Siamang (Symphalangus Syndactylus), est un grand mangeur de feuilles. A des échelles de temps beaucoup plus courtes, de nombreuses espèces de mammifères et d’oiseaux ont modifié ou élargi leur régime alimentaire en réponse aux changements de leurs conditions de vie liées aux activités humaines (ou de leurs relations directes avec les humains). Les sangliers et chevreuils forestiers se nourrissent en partie dans les champs cultivés; les renards, chiens errants (récents descendants de loups strictement carnivores), surmulots, corneilles et goélands argentés en bonne partie de déchets alimentaires dans les poubelles…]
Quant à votre suggestion d’un « regard » sur l’évolution du niveau de la mer Méditerranée et des biotopes méditerranéens au Miocène supérieur, ou à d’autres époques, c’est une très bonne idée… Reste cependant à trouver un expert en la matière, paléoclimatologue ou paléoécologue, francophone si possible et volontaire pour rédiger un tel regard !
Bonjour,
Tout d’abord merci de l’intérêt que vous portez à ces recherches. Je vous apporte ci-dessous les réponses à vos questions et remarques. La première section concerne les réponses relatives aux grands singes , puis la seconde partie répond à votre remarque sur la Figure 2 relative à la Méditerranée.
En fait, il est vrai que les premières occurrences du genre Dryopithecus sont datées du Miocène moyen. Toutefois, le genre Dryopithecus est présent également au Miocène supérieur. Tous les primates et les faunes considérées dans l’étude présentée dans ce Regard sont calés biochronologiquement au Miocène supérieur, des âges confirmés par des datations absolues sur certains gisements en Europe de l’Ouest et Anatolie.
Les données fournies par les analyses de micro-usures dentaires signalent très clairement que les dryopithécinés d’Europe occidentale et centrale étaient des consommateurs de feuillages et fruits à la manière des chimpanzés ou des orangs outangs actuels. Il n’existe pas à ce jour de données suggérant des différences entre ces dryopithécinés européens. Ouranopithecus, le grand singe d’Europe du Sud Est avait un régime beaucoup plus coriace au vu des données des analyses des micro-usures dentaires sur les facettes coupantes et écrasantes des molaires. Les micro-usures dentaires soutiennent un régime alimentaire plus riche en feuillage pour Oreopithecus comparé aux dryopithécinés.
En fait, il n’y a aucun argument soutenant une vie plus arboricole de Rudapithecus (qui est un taxon reconnu en Hongrie) que Hispanopithecus (qui est un taxon reconnu en Espagne). Les données du squelette postcrânien font l’objet de débats mais toutes les études attestent d’un mode de vie arboricole pour les grands singes d’Europe centrale et occidentale. Seul Ouranopithecus en Grèce pourrait avoir eu un mode de vie plus terrestre. Mais le conditionnel est là encore à utiliser car il n’y a ce jour pas de matériel postcrânien mis au jour de ce grand singe. Seules les études sur la faune associée attestent de milieux ouverts suggérant un mode de vie plus terrestre pour ce grand singe au nord de la Grèce.
La Méditerranée a en effet connu des variations importantes du niveau marin. Les mouvements tectoniques contrôlant les connexions avec l’Atlantique en sont les principales raisons. Si elles sont assez bien calées dans le temps, il n’en est pas de même de notre connaissance des lignes de rivage. En effet, les amplitudes de variations du niveau marin ne sont qu’estimées. Certains gisements fossiles associant éléments continentaux et marins (comme le site de Küçükçekmeçe dans la banlieue stambouliote où lamantins et équidés ont été mis au jour) permettent ici et là d’identifier les zones littorales. Compte-tenu de ces variations avant, pendant et après l’extinction des grands singes en Europe, le choix d’une carte présentant la géographie actuelle pour y placer les gisements fossilifères à grands singes m’ait apparu comme la moins mauvaise des solutions, bien qu’inexacte.
J’espère que ces arguments répondent à vos interrogations.
Bien cordialement, Gildas MERCERON
Bonjour,
merci tout d’abord pour ce double point de vue, particulièrement intéressant sur les liens entre paléontologie et écologie.
Ma question porte sur la comparaison entre les deux crises de biodiversité, celle du Miocène supérieur et celle d’aujourd’hui.
Les paléontologues ou paléoécologues ont-ils pu « quantifier », dans une certaine mesure, les changements environnementaux qui ont eu lieu en Europe, au Vallésien ? Ces changements ont-ils été d’une ampleur comparable à ce qui se passe actuellement à l’échelle mondiale ? En d’autres termes, les pressions sur les primates spécialistes étaient-elles supérieures à l’époque, ou le sont-elles aujourd’hui, et peut-on s’attendre à une crise d’extinction comparable ?
Par ailleurs, qu’en est-il du reste de la biodiversité européenne au Miocène supérieur, et peut-on dire que les primates y aient été un bon indicateur de l’état de santé des écosystèmes ?
Bonjour et merci de l’intérêt que vous portez à ce regard. Voici quelques éléments de réponse.
Il est en fait difficile de quantifier si les pressions sur les primates actuels (spécialisés ou non à une niche écologique réduite) sont similaires ou non à celles au cours du Miocène supérieur. Les paléontologues détectent des changements de faunes, des acquisitions de caractères morphologiques attestant de pressions sélectives importantes interprétées comme des « adaptations » à de nouvelles niches écologiques. Il est toutefois possible de quantifier ces changements (Costeur and Legendre, 2008; Fortelius et al., 1996; Fortelius et al., 2003 ; Merceron et al., 2010), mais les retranscrire sous forme d’estimations de pression est plus délicat et nécessite surtout de prendre en compte les données des flores fossiles et tous les autres proxies environnementaux (enregistrements isotopiques dans les paleosols par exemple).
Le reste de la faune a également été affecté par cette homogénéisation des conditions environnementales. A l’échelle continentale les changements sont modestes à l’Est de l’Europe mais plus importants en Europe occidentale et centrale. Ainsi, la diversité des giraffidés, des équidés, et des bovidés y augmente alors que celle des cervidés décroit. Ces variations seules sont informatives mais sont aussi assujetties à la paléogéographie. Ainsi, l’augmentation de la diversité d’un taxon donné peut résulter de changements environnementaux ou paléogéographique favorisant la dispersion d’espèces ou encore par la conjonction des deux phénomènes. De plus, ces changements de faunes sont trop souvent interprétés par simple analogie actualiste parfois même erronée. Ainsi, les bovidés sont souvent associés à des milieux ouverts et les cervidés aux milieux boisés. Tout bon naturaliste sait que certains cervidés exploitent des milieux ouverts et que nombre d’espèces de bovidés comme les bosélaphinés et tragélaphinés fréquentent les habitats boisés.
Ce sont les approches indépendantes comme les analyses de micro-usures dentaires qui permettent de détecter indépendamment de la taxonomie les changements de végétations. Ainsi, sur le site de Rudabanya en Hongrie, le seul bovidé présent (Miotragocerus) apparait comme un brouteur de feuillages et fruits alors que le cervidé (Lucentia) était un mangeur mixte incluant plus de graminées que le bovidé.
Bonjour,
Pour compléter par des arguments sur la crise de biodiversité actuelle la réponse de Gildas à la question de Justine sur l’ampleur comparée des changements environnementaux et des extinctions, au Miocène supérieur et aujourd’hui, je dirais que :
– il est d’autant plus difficile de répondre à cette question que la crise actuelle de biodiversité n’en est qu’à ses débuts, et que sa dynamique future dépend de multiples facteurs peu prévisibles. L’ampleur des changements régionaux et globaux auxquels seront confrontés les communautés vivantes dans les décennies et siècles à venir dépendra en grande partie des réponses des sociétés aux changements environnementaux et déclin d’espèces (extinctions) en cours. De l’efficacité des politiques de limitation d’émission de gaz à effet de serre par exemple, ou des politiques et mesures agro-environnementales.
– Cependant, sans être experte en paléontologie, je dirais que les changements environnementaux du Miocène supérieur étaient plus circonscrits au plan géographique et surtout moins rapides que les changements actuels, et donc que les pressions de sélection sur les espèces spécialistes sont globalement plus fortes aujourd’hui qu’elles ne l’étaient au Miocène supérieur. [Les changements climatiques et environnementaux en Europe du Sud et Afrique du Nord au Miocène Supérieur, liés aux variations du niveau de la mer Méditerranée, elles mêmes dues aux déplacements relatifs des plaques tectoniques eurasiatique et africaine (ouvertures – fermetures successives du Détroit de Gibraltar, c.-à-dire de la connexion avec l’Océan Atlantique alimentant cette mer intérieure), se sont étalés sur des dizaines ou centaines de milliers d’années à chaque grand déplacement du niveau de la mer (et sur plusieurs millions d’années en tout, si l’on considère l’alternance des transgressions et régressions marines). En comparaison, les transformations des biotopes et changements climatiques liés à l’intensification des activités humaines ont un rythme beaucoup plus rapide et affectent l’ensemble de la biosphère.]
Reste à savoir combien de temps elles vont s’exercer avec une telle intensité…
Pour compléter la réponse d’Anne, j’ajouterai que comparer la chute de biodiversité actuelle et les extinctions des grands singes européens au Miocène est difficile car les intervalles de temps concernés ne sont pas de la même échelle.
Ainsi, les changements environnementaux que j’observe se sont déroulés sur des échelles de temps de l’ordre de 100 000 ans au minimum alors que l’homme impacte le milieu naturel depuis 10 000 ans au plus et cet impact s’est amplifié depuis 2 ou 3000 ans jusqu’à atteindre son paroxysme depuis le développement de l’ère industrielle il y a 150 ans.
J’ai trouvé très bien ce « double » regard, à l’interface de deux disciplines scientifiques. Je me suis demandée ce que pensait Gildas Merceron des hypothèses écologiques; j’ai l’impression que c’est assez nouveau pour les paléontologues de pouvoir pleinement utiliser les théories d’écologie contemporaine dans leur recherche et surtout d’y contribuer activement.
Merci pour votre commentaire. Tout d’abord, excusez moi d’avoir tardé à y répondre. En fait, votre commentaire me semblait plus une remarque qu’une question.
La paléontologie s’est toujours de près où de loin appuyée sur les connaissances acquises par les biologistes. Ainsi, Georges Cuvier s’appuyait sur la comparaison des éléments osseux de la sarigue actuelle pour décrire la sarigue de Montmartre et ainsi produisait un des exemples parmi les plus connus de l’anatomie comparée.
Pour ce qui concerne la prise en compte des études écologiques en paléontologie, je n’ai pas forcément le recul nécessaire que pourrait avoir un historien des sciences, toutefois j’ai le sentiment que très tôt ces approches ont été considérées, avec pour objectif notamment de reconstituer les environnements du Passé.
Dès les années 70, le développement des analyses factorielles (et des logiciels) a permis à nombre de collègues de faire des études statistiques sur des jeux de données fossiles. Ainsi la distribution spatiale et temporelle du nombre de genres de bovidés, giraffidés, équidés, suidés, et autres mammifères à travers l’Europe a permis de mettre en évidence deux ensembles fauniques considérés comme de véritables provinces biogéographiques dont les limites ont évolué au cours du Miocène.
Un autre exemple parmi tant d’autres est le développement des études paléo-écologiques via les « cénogrammes ». Il s’agit de représentations graphiques de la distribution des mammifères d’un lieu donné, en fonction de leur masse corporelle. Ainsi, cette distribution montre une lacune d’espèces de taille moyenne pour les milieux ouverts où abondent les taxons de petites et grandes tailles, alors que les milieux fermés et humides ne présentent pas ce hiatus. Là aussi ces études paléo-écologiques sont calibrées par des cas d’études sur l’actuel.
Je me suis aussi posée de nombreuses question de communication/transmission, suite à la lecture de cet article.
Je trouve que les sujets de paléontologie d’une manière générale sont difficiles à transmettre par écrit, c’est un peu comme recréer un monde de Science Fiction avec des noms compliqués et inconnus du grand public. Il faudrait relire Tolkien pour voir comment il s’en sort !
Mais c’est un style (la SF) que les médiateurs scientifiques ne se permettent pas.
A l’inverse, ces sujets sont faciles à mettre en images et en animations. Ainsi, ils emmènent le spectateur dans une « fiction » en remontant le temps. Cette fiction permet de développer un imaginaire au spectateur et d’adhérer au récit.
C’est vraiment un challenge pour le médiateur scientifique, qu’en penses-tu Anne (Teyssèdre) ?
Bonjour Joanne,
Je suis assez d’accord avec ton analyse : ce n’est pas évident de vulgariser les progrès des connaissances en paléontologie, et le recours à des vidéos peut être très utile dans ce domaine (comme dans bien d’autres aussi..).
Cependant, je pense qu’il est possible de vulgariser clairement et de façon vivante les recherches en paléontologie dans des ouvrages écrits, articles ou livres, en réduisant le nombre de termes peu connus des lecteurs – noms d’espèces ou de lignées, de périodes, autres indications temporelles.. – au minimum nécessaire pour comprendre l’ensemble, en explicitant si possible chacun de ces termes lors de sa première occurrence dans le texte, et en joignant au texte un glossaire rassemblant ces termes en guise d’aide à la lecture. Cela fait une sorte de pilule que le lecteur doit avaler au début du texte, pour bien comprendre la suite. J’espère que ce regard paléo-écologique est clair et compréhensible !
En tout cas, sans aller jusqu’à Tolkien et à la Science Fiction, certains scientifiques ont écrit des livres de vulgarisation en paléontologie qui me semblent très réussis. Celui que je préfère est certainement « La Vie est belle », de Stephen Jay Gould (1991, traduction de « Wonderful life », 1989). Même si les conclusions de l’auteur peuvent être rediscutées aujourd’hui, celui-ci parvient à plonger ses lecteurs pendant 360 pages – qui se lisent comme un roman – dans les mers du Cambrien il y a quelque 530 Ma, pour les familiariser avec nombre d’espèces sans descendants aujourd’hui – Anomalocaris, Wiwaxia, Sydneia… -, reconstituer leurs modes de vie et interactions, rechercher leurs parentés possibles avec la faune d’Ediacara qui les a précédées de quelques dizaines de millions d’années et avec les faunes ultérieures,… bref à explorer la diversification des animaux à cette époque lointaine et à comprendre l’intérêt de ces recherches.
Par ailleurs, je voudrais souligner qu’il ne s’agit pas seulement de vulgarisation scientifique en paléontologie dans cet article à deux auteurs, mais bien de médiation scientifique entre paléontologie et écologie, renvoyant à la crise actuelle de la biodiversité..
Bonjour,
Merci pour cet article très intéressant, qui explore l’impact des changements environnementaux sur l’évolution des grands singes et autres espèces, au Miocène comme aujourd’hui.
J’aimerais en savoir plus sur l’Anthropocène : est-ce seulement un surnom donné à la période actuelle, ou s’agit-il d’une période « officiellement » reconnue par les scientifiques (géologues et climatologues notamment ?)
J’ai aussi une question sur la photo des deux orangs outans en captivité qui illustre l’épilogue. Cette photo est impressionnante par le nombre de mains occupées à épouiller, toucher ou serrer d’autres mains du partenaire : six « mains » en tout, dont trois entrelacées, cela fait beaucoup pour deux individus ! Les orangs outans sont-ils aussi adroits de leurs pieds que de leurs mains ? Par ailleurs, ces attouchements semblent témoigner d’une grande intimité (ou « amitié ») entre les deux animaux. Est-ce bien le cas ?
Je vous remercie pour vos réponses,
Marthe
En réponse à Marthe.
Bonjour,
et merci de votre intérêt pour cet article.
Pour « Anthropocène » : Ce terme n’est pas une désignation officielle, mais seulement une expression parlante appliquée à la période actuelle de transformation massive des écosystèmes terrestres et marins par les activités humaines. Nous avons ajouté une définition de ce terme dans le glossaire ci-dessus. NB : Il existe un terme « officiel » pour désigner la période actuelle interglaciaire, qui suit la dernière Glaciation (Würm), et dont le début – il y a environ 12 000 ans – correspond à peu près à ceux de l’agriculture en Asie Mineure : c’est l’Holocène. Mais ce terme n’est pas par définition lié à l’expansion de l’Humanité ou à son impact croissant sur la biosphère.
Pour la photo de l’épilogue : Merci pour votre remarque et vos questions. Oui, les orangs-outans sont très habiles de leurs « pieds », aux pouces opposables, qu’ils utilisent comme leurs mains pour se déplacer de branche en branche dans les forêts ombrophiles de Sumatra et Bornéo (qui se raréfient, au détriment des orangs et gibbons qui les habitent). On les dit quadrumanes. Et oui, ces deux individus sont des intimes, qui expriment leur affection réciproque par des épouillages et autres attouchements.
Bien cordialement,
Anne