Structuration des communautés de Dendrobatidae (Amphibiens) en Guyane francaise
Elodie COURTOIS
Station d’écologie expérimentale du CNRS à Moulis
2, route du CNRS 09200 MOULIS
courtoiselodie (at) gmail.com
Résumé

Figure1: Présentation des 4 espèces utilisées dans cette étude. Sur ces photos, D. tinctorius et A. femoralis portent sur leur dos des têtards (un seul dans le cas de D. tinctorius et plusieurs pour A. femoralis) qui vont être déposés dans des pièces d’eau en forêt.
L’objectif de cette étude était d’étudier le patron de répartition de quatre espèces d’amphibiens de la famille des Dendrobatidae dans une forêt tropicale de Guyane Française. Cette étude a été menée sur le site Inselberg de la station de recherche du CNRS (Centre National de la Recherche Scientifique) qui se situe au sein de la réserve des Nouragues en Guyane Française. Au total, 49 transects de 50 mètres chacun ont été mis en place sur les deux unités géographiques distinctes du site d’étude (15 transects sur le petit plateau PP et 34 transects sur le grand plateau GP) qui se différencient par des substrats géologiques différents. Ces transects ont été parcourus 8 fois chacun durant le mois de février 2012. A chaque passage, le nombre d’observation visuelle de l’une des espèces (Dendrobates tinctorius) ainsi que le nombre de mâles chanteurs des 3 autres espèces (Allobates femoralis, Anomaloglossus baeobatrachus et Ameerega hahneli) étaient comptabilisés. Ces données ont permis d’estimer pour chaque espèce la probabilité de détection de l’espèce et sa probabilité d’occupation sur le site, donnant pour chaque espèce une estimation de sa représentativité sur le site d’étude. En général, la probabilité de détection de ces espèce est faible (inférieure à 50% pour les 4 espèces). A. femoralis semble être l’espèce la plus largement répandue avec une probabilité d’occupation proche de 1. A. baeobatrachus et A. hahneli sont présentent sur tous le site d’étude mais avec des probabilités d’occupations plus faible (0.439 et 0.215 respectivement). Finalement, D. tinctorius semble être présente quasi exclusivement sur l’une des zones géographiques du site (grand plateau). Ces résultats mettent en évidence une disparité dans les distributions de ces 4 espèces, un paramètre important à considérer pour la conservation de ces espèces. Les communautés de Dendrobatidae semblent différentes sur les 2 entités géographiques (PP et GP) avec une plus grande abondance totale de Dendrobatidae sur le petit plateau mais une plus grande diversité sur le grand plateau. Finalement, ces quatre espèces semblent coexister plus souvent qu’attendu au hasard. Ce dernier résultat pourrait indiquer que la coexistence de ces espèces est facilitée par une utilisation différentielle des micro-habitats, une hypothèse qui demande à être testée plus finement dans le futur.
Justifications

Figure2: Localisation de la réserve des Nouragues en Guyane Française au sein de laquelle se trouve la station de recherche des Nouragues du CNRS. Pour des informations plus précises sur cette station de recherche voir sur le site http://www.nouragues.cnrs.fr/.
Avec plus de 6000 espèces différentes décrites, les amphibiens représentent l’un des groupes de vertébrés les plus diversifiés dans le monde. C’est aussi l’un des groupes les plus menacés avec près de 30% des espèces menacées d’extinction dans le monde (Stuart et al. 2004). Comprendre comment les populations d’amphibiens se structurent dans le temps et l’espace est donc un enjeu majeur pour l’étude des ces espèces et leur conservation. L’intérêt de cette étude était d’étudier les facteurs de distribution des espèces de la famille des Dendrobatidae dans une forêt tropicale de Guyane Française.
Les amphibiens de la famille des Dendrobatidae sont répartis sur presque toutes les régions tropicales d’Amérique du Sud et les parties adjacentes d’Amérique centrale. La majorité des espèces de cette famille sont terrestres et diurnes. Cette famille se caractérise par une importante diversité spécifique et un comportement social et reproducteur complexe (Lötters et al. 2007). Les stratégies de reproduction impliquent un investissement important d’un des deux parents. Dans la majeure partie des cas, les œufs sont pondus en dehors de l’eau puis transportés par l’un des deux parents sur son dos jusqu’à un point d’eau lorsque les têtards ont éclos (comportement appelé phorésie) où ils se développeront jusqu’à la métamorphose (Lötters et al. 2007). Certains paramètres abiotiques et en particulier la disponibilité en dendrotelmes (petites réserves d’eau) peuvent donc avoir une forte influence sur la répartition des différentes espèces de Dendrobatidae. Ces espèces utilisant comme site de reproduction des micro-habitats spécifiques et limités, on peut alors s’attendre à ce qu’il existe une exclusion compétitive de ces espèces et qu’à une échelle fine, elles aient tendance à coexister moins souvent qu’attendu au hasard.
L’objectif de la présente étude est de caractériser le patron de répartition de quatre espèce de Dendrobatidae (voir Figure 1) présentent sur le site de la station Inselberg de la réserve des Nouragues. Le site d’étude comprend deux unités géographiques distinctes (le petit plateau et le grand plateau) qui se différencient par des substrats géologiques différents. Plus spécifiquement, cette étude cherche à répondre aux questions suivantes : (1) Comment se distribuent les espèces sur le site d’étude ? (2) Existe il des différences de composition entre les communautés du grand et du petit plateau ? (3) Quel est le patron de coexistence de ces espèces ?
Méthodes

Figure3: Localisation des 49 transects de 50 m (indiqués en noir) sur le site Inselberg de la station de recherche des Nouragues du CNRS. A gauche, le grand plateau (GP) situé sur un sol argileux avec un substrat de type volcanique et culminant à 140 m d’altitude environ et à droite le petit plateau (PP) situé sur un sol plus sableux avec un substrat granitique et culminant à 120m d’altitude.
Cette étude a été menée sur le site Inselberg de la station de recherche du CNRS qui se situe au sein de la réserve des Nouragues (Figure 2). Un ensemble de 49 transects de 50m a été mis en place sur les réseaux de layons existants sur le petit plateau (PP, 15 transects, Figure 3) et sur le grand plateau (GP, 34 transects, Figure 3). Le grand plateau se situe sur un sol argileux avec un substrat de type volcanique et le petit plateau (PP) se situe sur un sol plus sableux avec un substrat granitique. Les transects sont séparés par au moins 100 mètres de distance pour assurer leur indépendance. Les transects sont caractérisés par une altitude basse (60-80 m), moyenne (90-110 m) ou haute (120-160 m). Quatre espèces de la famille des Dendrobatidae ont été considérées (Dendrobates tinctorius, Allobates femoralis, Ameerega hahneli, et Anomaloglossus baeobatrachus, voir Figure 1). Ce sont toutes des espèces de litière et diurne. Pour trois espèces (A. femoralis, A. baeobatrachus, A. hahnelli) les mâles chantent de jour et possèdent un chant caractéristique et facilement identifiable.
Entre le 5 et le 12 février 2012 (saison des pluies), les transects ont été parcourus en 10 minutes une fois par jour pendant 8 jours consécutifs (8 passages sur chaque transect). Le long de ces transects ont été comptabilisées le nombre d’observation visuelle pour l’espèce D. tinctorius ainsi que le nombre de mâles chanteurs pour A. femoralis, A. baeobatrachus et A. hahneli, une étude préliminaire ayant mis en évidence le fait que les observations visuelles pour ces 3 dernières espèces sont extrêmement rare du fait de leur caractère beaucoup plus cryptique que D. tinctorius (Courtois et al., in prep.).
Afin d’étudier la répartition globale des espèces sur la zone d’étude, des estimations de probabilité d’occupation ont été réalisées en incorporant la probabilité de détection dans les estimations de présence (MacKenzie et al. 2002). Cette méthode permet, grâce à des passages répétés sur des sites, d’estimer la probabilité de détection d’une espèce et d’utiliser cette mesure pour estimer une probabilité d’occupation des sites par cette espèce sur la zone d’étude.

Figure 4 : Probabilité de détection (A) et d’occupation (B) moyennes estimées pour les 4 espèces de Dendrobatidae.
L’abondance relative des différentes espèces sur chaque transect a été calculée pour chaque espèce et sur chaque transect par le nombre d’individus par minute de prospection selon la formule d’Ernst et al. 2006.
La diversité des communautés a été définie en utilisant l’indice de Shannon basé sur une matrice d’abondance des espèces définie à partir des abondances relatives définie précédemment. L’indice de Shannon se calcule comme suit : où pi est l’abondance relative de l’espèce i et R la richesse spécifique, c’est-à-dire le nombre total d’espèce prises en compte (ici 4 espèces).Finalement, afin d’étudier la coexistence des espèces, une matrice de présence/absence a été construite en combinant les différents passages sur chaque transect. Cette matrice a été utilisée pour calculer un indice de co-occurrence (C-score) qui a été comparé à une distribution aléatoire (Gotelli 2000). Si la communauté est structurée par la compétition, c’est-à-dire que les espèces coexistent moins qu’attendu au hasard, alors la valeur observée du C-score doit être supérieure aux valeurs simulée.
Résultats et discussions
Au total, 468 observations distinctes ont été réalisées durant l’étude. Les détections audio ont données lieu à 419 observations (89.5%) dont 243 pour A. femoralis, 128 pour A. baeobatrachus et 48 pour A. hahneli. Les détections visuelles ont données lieu à 49 observations, toutes pour D. tinctorius.
RESULTAT 1 : Des probabilités d’occupation contrastées et des probabilités de détection globalement faible
Globalement, les probabilités de détection des 4 espèces étudiées sont faible et dans tous les cas inférieures à 50% (Figure 4). Cette probabilité de détection correspond à une détection visuelle pour D. tinctorius et à des détections audio pour les 3 autres espèces. Ces 4 espèces présentent des patrons de répartition spatiale contrastés. A. femoralis est l’espèce la plus largement répandue sur le site d’étude (probabilité d’occupation = 0.934, Figure 4). Elle est plus fréquente sur le petit plateau que sur le grand plateau (Table 1, probabilité d’occupation sur le PP de 1 contre 0.897 sur le GP). A. baeobatracchus présente une répartition moins dense sur la zone d’étude (probabilité d’occupation = 0.439, Figure 4) avec aucun effet du plateau sur sa répartition (Table 1). A. hahnelli est plus commune sur le grand plateau que sur le petit plateau (Table 1, probabilité d’occupation sur le GP de 0.279 contre 0.164 sur le PP, probabilité d’occupation moyenne = 0.215). Finalement, D. tinctorius semble être présente quasi exclusivement sur le grand plateau (Table 1, probabilité d’occupation=0.599 sur GP contre une probabilité d’occupation<0.001 sur le PP). Il est à noter que pour les 3 espèces détectées par le chant, la probabilité d’occupation de l’espèce peut être sous-estimée puisque les femelles (ou les mâles non chanteurs) peuvent occuper des sites différents qui ne seront donc pas pris en compte. Néanmoins, ce biais semble être réduit puisque des études spécifiques sur ces 3 espèces tendent à montrer que les femelles et les mâles non chanteurs se situent dans les mêmes habitats que les mâles chanteurs (Ringler et al. 2009, Courtois, obs. pers.).
RESULTAT 2 : Des communautés différentes sur le petit plateau et le grand plateau
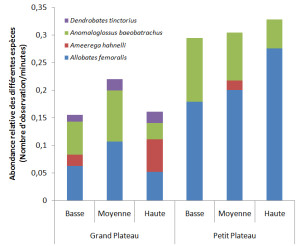
Figure5: Abondance relative des différentes espèces de Dendrobatidae en fonction du plateau et de la catégorie d’altitude. Ces abondances relatives correspondent au nombre moyen d’observation par minute de prospection pour chacune des espèces.
Le petit plateau présente une abondance totale de Dendrobatidae plus élevée que le grand plateau (Figure 5). Ceci est largement du au fait que l’abondance relative de l’espèce A. femoralis est plus élevée sur le petit plateau que sur le grand plateau (Figure 5). A l’inverse, la diversité des communautés est plus élevée sur le grand plateau que sur le petit plateau (Index de Shannon moyen GP = 0.53 contre 0.32 pour PP). En résumé, les deux plateaux différent en terme de composition spécifique et également en terme d’abondance totale. Une des questions majeures et de savoir quel facteur pourrait expliquer une plus forte abondance sur le petit plateau. Une des explications pourrait être une disponibilité plus forte en dendrotelmes, assurant un meilleur succès de reproduction (Ringler et al. 2009).
RESULTAT 3 : Une co-occurrence d’espèce plus fréquente qu’attendue au hasard
Contrairement à ce qui était attendu sous une hypothèse de compétition, les espèces ont tendance à coexister plus fréquemment qu’attendu au hasard (C-score observé = 92, moyenne des valeurs simulée = 151, pvalue=0.01). Ceci peut être due au fait que les dendrotelme sont localisés dans l’espace et génèrent un regroupement des espèces dans des micro-habitats favorables. De plus, ces coexistences sont probablement facilitées par le fait que les espèces n’utilisent pas exactement le même type de dendrotelmes. D. tinctorius par exemple est la seule espèce à pouvoir atteindre les dendrotelmes situés en haut des arbres (Courtois, obs. pers.). Cette ségrégation de niche demande à être étudiée plus finement.
Bibliographie
Courtois EA, Devillechabrolle J, Dewynter M, Pineau K, Gaucher P, Chave J. Optimising the sampling strategy for eight amphibians species in French Guiana, South America. submitted to Biodiversity and Conservation
Ernst R, Linsenmair KE, Rödel M-O (2006) Diversity erosion beyond the species level: Dramatic loss of functional diversity after selective logging in two tropical amphibian communities. Biological Conservation 133:143–155.
Gotelli NJ (2000) Null model analysis of species co-occurrence patterns. Ecology 81(9):2606–2621
Lötters S, Jungfer KH, Henkel WH, Schmidt W (2007) Poison Frogs: Biology, Species & Captive Husbandry, Chimaira. Frankfurt, Germany
MacKenzie DI, Nichols JD, Lachman GB, et al. (2002) Estimating site occupancy rates when detection probabilities are less than one. Ecology 83:2248–2255.
Ringler M, Ursprung E, Hödl W (2009) Site fidelity and patterns of short- and long-term movement in the brilliant-thighed poison frog Allobates femoralis (Aromobatidae). Behavioral Ecology and Sociobiology 63:1281–1293.
Stuart SN, Chanson JS, Cox NA, et al. (2004) Status and Trends of Amphibian Declines and Extinctions Worldwide. Science 306:1783–1786.


Commentaires récents