Réponse des communautés de bryophytes au microclimat et à la maturité des forêts
Fabien Spicher
UMR CNRS 7058 EDYSAN, Université de Picardie Jules Verne
Email: fabien.spicher@u-picardie.fr
(Version PDF)
Résumé
Les massifs forestiers sont caractérisés par une grande différence entre les conditions macroclimatiques qui prévalent en milieu ouvert et les conditions microclimatiques qui sont plus tamponnées sous la canopée. Dans le contexte du réchauffement climatique, ce pouvoir tampon de la canopée fait des massifs forestiers des refuges d’importance croissante pour la biodiversité. Ce pouvoir tampon varie en fonction de la hauteur et de la structure de la canopée et est donc directement modulé par la composition et la structure des peuplements, sur lesquels la gestion forestière a un rôle déterminant. Ainsi, la distribution des microclimats varie dans l’espace, depuis des zones de coupes aux variations amplifiées par rapport aux macroclimats, à des zones où les microclimats sous couvert sont d’autant plus tamponnés que la structure verticale de la canopée se complexifie. Ces variations spatiales déterminent la distribution de la biodiversité forestière, depuis les communautés composées d’espèces à large amplitude écologique des stades jeunes aux communautés d’espèces plus spécialistes et strictement inféodées aux stades matures des forêts anciennes, en raison de leur exigence pour un environnement forestier stable et tamponné.
L’objectif général de ce travail est de déterminer la réponse des communautés de bryophytes au microclimat forestier et au degré de maturité du peuplement dans un contexte de changement climatique.
Pour ce faire, nous nous sommes appuyés sur des données dendrométriques, microclimatiques et botaniques (bryophytes terricoles et saxicoles) déjà acquises au cours d’un précédent projet. A cela, nous avons ajouté une caractérisation du bois mort (protocole PSDRF) et un inventaire des communautés de bryophytes se développant sur le bois vivant et le bois mort au sol et sur pied au sein d’un réseau de 52 placettes situées dans deux massifs forestiers du Nord et du Centre de la France. Ces placettes ont été disposées le long d’un gradient d’âge et de microclimat au sein de chacun des massifs.
Au total, nous avons identifiés 81 espèces de bryophytes à partir d’un jeu de données composé de 5062 occurrences tous substrats confondus. Entre 5 et 32 espèces, dont six espèces très fréquentes (espèces présentes dans 80% des relevés), ont été observées par relevé. Les indices de diversité et la composition des communautés répondent à trois variables stationnelles (le degré d’exposition au Nord, l’indice d’humidité topographique et le pH du sol), une variable microclimatique et quatre variables dendrométriques (le volume de bois mort au sol de faible diamètre, le volume des grosses souches, la surface terrière et la somme des recouvrements de végétation). Il ressort que les peuplements les moins matures avec les microclimats les plus fluctuants présentent une diversité en bryophytes faible et composée majoritairement d’espèces ubiquistes. Le degré de maturité, associé à un microclimat plus tamponné, favorise un niveau de diversité bryophytique plus élevé.
Dans nos analyses préliminaires, peu de placettes ont présenté une maturité importante et il a été difficile de départager le rôle du microclimat des conditions de peuplements forestiers, malgré un échantillonnage tentant de départager ces deux facteurs. Ce jeu de données mériterait donc d’être augmenté et complété par d’autres placettes installées dans des contextes macroclimatiques différents et présentant un degré de maturité plus avancé.
Notre étude a rappelé l’importance d’étudier les communautés de bryophytes sur différents substrats, et plus particulièrement les bryophytes épiphytes et sapro-lignicoles (qui vivent sur les arbres vivants et morts), en plus des bryophytes humo-terricoles qui sont les plus traditionnellement étudiées. Elle a aussi souligné l’importance des conditions de l’habitat proximal, non seulement via des caractéristiques dendrométriques, notamment associées à la maturité (bois mort), mais aussi via l’effet microclimatique qui agissent collectivement sur la structuration de la biodiversité et des communautés de bryophytes.
Ces connaissances permettront d’appréhender l’impact de la gestion forestière sur les communautés de bryophytes forestières ainsi que leurs résiliences dans un contexte de changement climatique.
Justification
Le microclimat formé sous couvert forestier diffère largement du macroclimat en milieu ouvert en raison de l’important pouvoir tampon joué par la canopée1–5. Les peuplements forestiers apparaissent dès lors comme de potentielles zones refuges, fournissant des conditions sous couvert qui sont plus stables dans le contexte du réchauffement climatique. Ce pouvoir tampon varie en fonction de la hauteur et la structure de la canopée et est donc directement modulé par la composition et la structure des peuplements, sur lesquels la gestion forestière a un rôle déterminant 6–12.
Ces variations, couplées à la complexification de l’habitat physique en termes de bois mort au sol et sur pied ainsi que de la diversification des microhabitats sur les arbres vivants, façonnent la richesse et la composition de la biodiversité forestière. Ainsi, les communautés des stades jeunes présentent une richesse spécifique comparativement plus faibles que celle des stades plus âgés, en parallèle avec le turn-over de la composition des communautés qui passent d’espèces généralistes à large amplitude écologique à des espèces plus spécialistes des micro-habitats, mais également spécialistes d’un environnement forestier plus stable et tamponné qui caractérise les forêts matures13–16.
Si les plantes vasculaires ont jusqu’à présent fait l’objet d’une attention particulière pour caractériser les milieux forestiers, les bryophytes sont beaucoup moins souvent incluses dans les évaluations écologiques. Pourtant, les bryophytes constituent le deuxième groupe de plantes terrestres le plus diversifié après les spermatophytes (pas moins de 1300 espèces en France). Les bryophytes présentent également des caractéristiques écophysiologiques qui les rendent extrêmement sensibles aux variations environnementales et en font des bioindicateurs de choix17,18.
L’objectif général de ce projet est donc de déterminer, sur base d’observations biologiques, microclimatiques, dendrométriques et structurelles, la réponse des communautés de bryophytes au degré de maturité des peuplements forestiers.
Méthodes
Nous avons complété les observations d’un réseau de placettes installées dans le cadre du projet IMPRINT (19) (Figure 1). Parmi les 120 placettes initiales, 52 ont été sélectionnées au sein des massifs de Blois et de Mormal. Dans chaque massif, un sous-échantillonnage a été mené pour construire un jeu de placettes représentatives, disposées le long d’un gradient de maturité (déduit des inventaires dendrométriques passés) et d’un gradient microclimatique, obtenu à partir d’un paramètre de « pente » de la relation entre macroclimat et microclimat, paramètre qui capture le pouvoir tampon de la forêt (20).
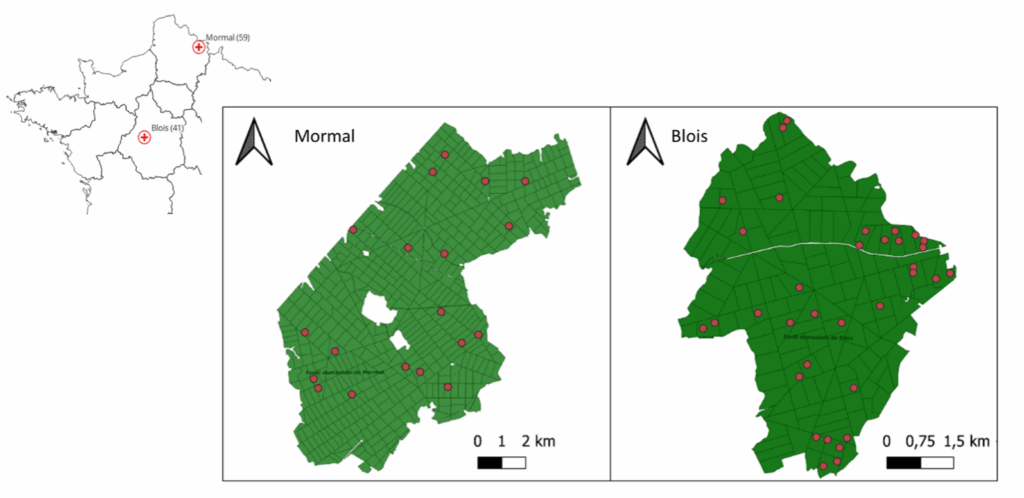
Figure 1: Localisation des 2 massifs forestiers étudiés et des 52 placettes inventoriées dans le cadre de cette bourse d’étude.
Sur les 52 placettes sélectionnées, un inventaire du bois mort au sol et sur pied a été réalisé selon le protocole PSDRF21 (Figure 2). L’inventaire des bryophytes a consisté en un inventaire en présence/absence par tige , souche ou bois mort sélectionnés sur les différents substrats décrits sur l’ensemble des « sous-placeaux » du protocole PSDRF22. L’inventaire a été mené jusque 2 m de hauteur et sur l’ensemble des pièces échantillonnées.
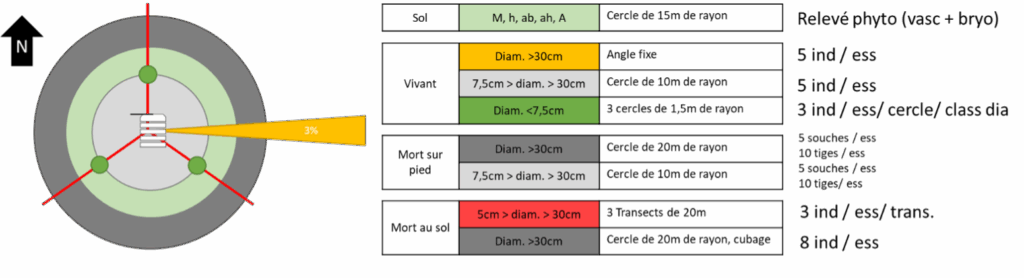
Figure 2 : Protocole d’inventaire du bois mort et vivant (PSDRF) et des bryophytes sur les 52 placettes du projet.
Les bryophytes épiphytes ont été inventoriées sur cinq arbres vivants et cinq perches et petits bois par essences. La description de la régénération a été réalisée, sur 3 individus, selon quatre classes. Un maximum de cinq souches et de dix tiges de bois morts debout par espèces ont fait l’objet d’un inventaire.
Parmi l’ensemble des bois mort au sol se trouvant dans un rayon de 20 m et d’un diamètre supérieur à 30 cm, 8 bois morts ont été inventoriés par placette. L’inventaire du bois mort au sol compris entre un diamètre de 5 et 30 cm a été réalisé selon 3 transects de 20 m chacun et un maximum de 3 bois mort par espèce et par transect a fait l’objet d’un inventaire complet des bryophytes présentes.
L’ensemble des bryophytes inventoriées par placette est subdivisé en 3 cortèges suivant le type de substrat : les épiphytes (sur bois vivant), les sapro-lignicoles (sur bois mort au sol ou sur pied) et les terricoles/saxicoles.
A partir de ces inventaires, la diversité et la composition en bryophytes ont été analysées selon les cortèges. La variation de diversité (richesse spécifique) a été analysée à l’aide de modèles linéaires généralisés (GLM, famille de distribution de Poisson) combinant plusieurs variables explicatives candidates qui décrivent le contexte stationnel (topographie, pH du sol, géologie, quantité de lumière estimée à partir de photographies hémisphériques), le peuplement (composition, caractéristiques dendrométriques, métriques lidar, volume de bois mort au sol et sur pied) et le microclimat (cf. «pente » ) (Tableau 1). Afin d’éviter la colinéarité entre les variables, les variables explicatives présentant une corrélation absolue > 0,7 ont été filtrées en supprimant l’une des deux variables de chaque paire trop corrélée. Sur les 36 variables initiales, seules 21 ont été conservées suivant cette procédure (Tableau 1). Les communautés ont également été analysées au niveau de leur composition à l’aide d’une analyse en coordonnées principales (PCoA) contraintes sur la base de matrices de Hellinger (présence/ absence) se basant sur la même liste de variables explicatives que pour la diversité spécifique. Pour chaque analyse, le modèle le plus parcimonieux a été retenu à l’aide de la fonction step23 ou ordistep24. La colinéarité entre les variables a été revérifiée sur la base du variance inflation factor (VIF < 5).
Résultats
Inventaire des bryophytes
Au total, 5062 occurrences d’espèces ont été relevées au cours des missions de terrain, sur différents substrats, en plus des occurrences terricoles : 1008 brins de régénération, 474 arbres d’un diamètre supérieur à 7,5 cm, 338 bois morts debout (tiges et souches), 211 bois morts au sol.
Sur les 52 placettes inventoriées, 81 espèces de bryophytes ont été identifiées, dont 66 mousses et 15 hépatiques (Tableau 1). Des confirmations microscopiques sont encore en cours pour certain individu. 26 espèces sont considérées comme spécialistes des milieux forestiers. Les inventaires menés sur le massif de Blois présentent un pool régional d’espèces (cf. gamma) plus important (62 espèces) que sur le massif de Mormal (54 espèces). Cependant, les placettes du massif de Mormal possèdent un pool d’espèces spécialistes du milieu forestier plus important (35.2% pour Mormal contre 25.8% pour Blois).
Facteurs structurant la biodiversité à l’échelle de la placette
A l’échelle d’une placette, la richesse spécifique locale (cf. alpha) varie de 5 à 32 espèces (moyenne : 21,2). Cette richesse se répartit de la façon suivante entre les différents substrats étudiés : épiphyte (38%), sapro-lignicole (34%) et terricole/saxicole (28%). La richesse spécifique moyenne par placette est plus élevée à Blois qu’à Mormal, aussi bien pour les espèces épiphytes que terricoles (Figure 3). En revanche, aucune différence significative n’a été observée pour les espèces sapro-lignicoles.
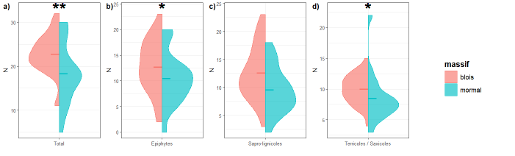
Figure 3 : Violin plot du nombre d’espèces totales par placette selon les différents massifs et cortèges étudiés. Les cortèges étudiés sont : a) la flore globale, b) la flore épiphyte, c) la flore sapro-lignicole et d) la flore terricole / saxicole. Les symboles donnent les différences significatives entre le massif de Blois et de Mormal pour les différents substrats étudiés ; absent : non significatif, « . » : tendance, « * » : significatif à 5% et « ** » significatif à 1%. La marque horizontale représente le nombre moyen d’espèce par placette et par massif.
Les inventaires réalisés nous montrent que la richesse spécifique totale, tout substrats confondus, d’une placette est corrélée positivement (r² > 0.5) à la richesse spécifique de chaque cortège (Figure 4). La richesse spécifique des communautés de bryophytes terricoles semble moins corrélée aux richesses spécifiques des communautés sapro-lignicoles et épiphytes.
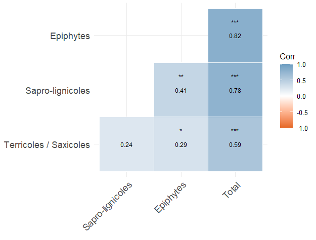
Figure 4 : Diagramme représentant les corrélations entre les richesses spécifiques pour chacun des substrats.
Indépendamment du substrat, la richesse spécifique d’une placette répond positivement à deux paramètres topographiques (la pente et l’indice d’humidité topographique), au volume des petites souches (Souche 7,5-30 cm V/ha) et à l’effet microclimatique (Tableau 2, Figure 5). Par contre, la réponse à ces différentes variables en fonction des substrats considérés apparait contrastée (Tableau 2).

Tableau 2 : Nombre d’espèces totales et forestières spécialistes inventoriées lors de l’étude et sur chaque massif.
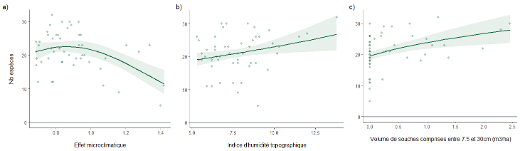
Figure 5 : Graphique représentant les prédictions de la richesse spécifique totale à l’échelle d’une placette en fonction de a) l’effet microclimatique (selon la méthode de la pente de de l’équilibre ; des valeurs supérieures à1 indique une amplification du microclimat par rapport au macroclimat), b) l’indice d’humidité topographique (TWI), c) le volume de souches comprises entre 7.5 net 30cm.
La richesse spécifique des bryophytes se développant sur bois vivant (cf. les épiphytes) augmente dans les peuplements présentant des conditions stationnelles pentues, humide (TWI) et tamponnée (effet microclimatique négatif). Une forte somme des recouvrements des différentes strates associée à un faible recouvrement de la strate arbustive haute est corrélée à une richesse spécifique élevée. La richesse spécifique en bryophyte se développant sur le bois mort (cf. les sapro-lignicoles), semble plus importante dans les positions topographiques favorisant la fraicheur (Northness), au sein de peuplements avec un fort recouvrement de semis (R_ha), à la canopée hétérogène (Rumple index) et présentant d’importantes quantité de bois mort au sol (BMS >30 cm et Souche 7,5-30 cm V/ha). La diversité spécifique des communautés de bryophytes se développant au sol (cf. les terricoles et saxicoles) est moins bien expliquées par le meilleur modèle retenu (R²Adj : 0.268). La diversité spécifique sur ce dernier substrat apparait plus importante au sein des peuplements jeunes et tamponnés avec un faible volume de bois mort au sol.
Facteurs structurant les communautés de bryophytes à l’échelle de la placette
Au total, 17 espèces sont présentes dans plus de 50% des 52 placettes dont six présentes dans plus de 80% des 52 placettes : Hypnum cupressiforme, Kindbergia praelonga , Brachythecium rutabulum, Polytrichum formosum, Lophocolea heterophylla et Dicranella heteromalla. Ces quelques éléments descriptifs illustrent la grande homogénéité des communautés à l’échelle de la placette dans les massifs étudiés.
L’analyse de la variation des communautés de bryophytes en réponse aux variables environnementales (PCoA) identifie systématiquement l’effet microclimatique et le massif forestier comme variable explicative (Tableau 3). Elle est combinée au volume de bois mort debout pour les communautés épiphytes et sapro-lignicoles et au degré d’exposition au Nord et le pH du sol pour les communautés terricoles.
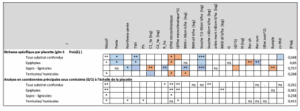
Tableau 3 : Table présentant les résultats de la modélisation de la richesse spécifique et de l’analyse en coordonnées principales sous contraintes pour l’ensembles des substrats présents sur les parcelles ainsi que pour les cortèges épiphytes, sapro-lignicoles et terricoles. Les case vide de contenu indique que la variable n’a pas été retenue pour ce modèle. « ns » signifie que la variable est retenue mais non significative, « . » une tendance existe (pvalue entre 0.05 et 0.1), « * » relation significative à 5%, « ** » relation significative à 1% et « *** » relation significative dont la pvalue est inférieure à 0.001. La couleur de la case indique le sens de la relation ; bleue : positive et saumon : négative. Le coefficient de détermination de chaque modèle est également présenté (R² Adj). [log] associé à une variable indique que celle-ci a été transformée.
Discussion
Une biodiversité associée au massif forestier
Pour cette bourse, deux massifs forestiers ont été étudiés, ce qui s’est montré très structurant dans la modélisation de la richesse spécifique et la composition des communautés de bryophytes. Ces différences régionales entre massifs peuvent refléter plusieurs effets qu’il n’est pas possible de distinguer avec seulement deux massifs. Tout d’abord, il peut s’agir d’un effet associé à des contextes macroclimatiques différents (17,25–27). Ensuite, l’histoire des peuplements et la gestion forestière peut affecter la distribution des bryophytes à l’échelle d’une parcelle ou d’un massif (28,29,13,30,16,31). Pour finir, et plus globalement, le pool régional d’espèces peut également être différent (32,33) et ce notamment, en réponse à des processus éco-évolutifs encore plus lointains.
Importance du microclimat et de l’environnement local
Les conditions microclimatiques sont importantes pour expliquer la richesse spécifique et les communautés de bryophytes. Notre étude met de nouveau en lumière la sensibilité des bryophytes au microclimat au sein des forêts tempérées (34,35). Les placettes tamponnées favorisent une richesse spécifique en bryophytes qui est plus importante. Ce constat est particulièrement vrai pour les bryophytes épiphytes (36,30,31) et terricoles (31,37,35,38). D’une façon surprenante, le microclimat n’est pas apparu comme une variable importante pour expliquer la richesse spécifique des communautés sapro-lignicoles. Toutefois, il est apparu comme une variable structurante des communautés ce qui est en accord avec de précédentes études suggérant un rôle important du macroclimat et du microclimat (25,39,40).
A l’échelle de la placette, conformément à la littérature scientifique, les variables topographiques (TWI, pente et northness) se sont montrées explicatives des variations observées de la richesse spécifique en bryophytes. Ces variables soulignent également l’importance de conditions locales fraîches et humides favorables à la diversité et la spécialisation des communautés de bryophytes (30,31,36–38).
Réponse à la maturité
Dans notre étude, nous avons décrit le stade de maturité des peuplements à l’aide de variables décrivant le peuplement forestier, la complexité verticale et la quantité de bois mort. Ces différents attributs ont été retenus lors de nos analyses et sont reconnus pour expliquer la richesse et la composition des communautés de bryophytes d’après différentes synthèses récentes (31,41). De plus, nos résultats ont montré le rôle des souches comme support de la biodiversité des bryophytes sapro-lignicoles en forêts gérées, confirmant des observations menées dans les pays scandinaves et d’Europe centrale (42–44).
Il apparaitrait intéressant de décrire de façon plus exhaustive la maturité forestière en synthétisant les informations sous la forme d’un indice (45) ou en ajoutant d’autres variables recueillies sur le terrain comme la diversité des stades de décomposition du bois et de l’écorce ainsi que la densité de très-très gros bois à l’hectare.
En guise de conclusion, il ressort de nos analyses que les peuplements les moins matures avec les microclimats les plus fluctuants présentent une diversité en bryophytes faible et composée majoritairement d’espèces ubiquistes. Le degré de maturité, associé à un microclimat plus tamponné, favorise un niveau de diversité bryophytique plus élevé. Ce jeu de données mériterait d’être augmenté et complété par d’autres placettes installées dans des contextes macroclimatiques différents et présentant un degré de maturité plus avancé. Ceci devrait permettre de préciser et conforter nos résultats tout en apportant des connaissances sur le lien entre la gestion forestière et la conservation du patrimoine biologique des bryophytes dans un contexte de changement climatique.
Références
- Geiger, R., Aron, R. H. & Todhunter, P. The Climate Near the Ground. (Vieweg+Teubner Verlag, Wiesbaden, 1995). doi:10.1007/978-3-322-86582-3.
- Bramer, I. et al. Chapter Three – Advances in Monitoring and Modelling Climate at Ecologically Relevant Scales. in Advances in Ecological Research (eds. Bohan, D. A., Dumbrell, A. J., Woodward, G. & Jackson, M.) vol. 58 101–161 (Academic Press, 2018).
- De Frenne, P. et al. Global buffering of temperatures under forest canopies. Nat. Ecol. Evol. 3, 744–749 (2019).
- De Frenne, P. et al. Temperature effects on forest herbs assessed by warming and transplant experiments along a latitudinal gradient. Glob. Change Biol. 17, 3240–3253 (2011).
- Ismaeel, A. et al. Patterns of tropical forest understory temperatures. Nat. Commun. 15, 549 (2024).
- Chen, J., Franklin, J. F. & Spies, T. A. Contrasting microclimates among clearcut, edge, and interior of old-growth Douglas-fir forest. Agric. For. Meteorol. 63, 219–237 (1993).
- Chen, J. et al. Microclimate in Forest Ecosystem and Landscape Ecology: Variations in local climate can be used to monitor and compare the effects of different management regimes. BioScience 49, 288–297 (1999).
- Xu, M., Chen, J. & Brookshire, B. L. Temperature and its variability in oak forests in the southeastern Missouri Ozarks. Clim. Res. 08, 209–223 (1997).
- Frey, S. J. K. et al. Spatial models reveal the microclimatic buffering capacity of old-growth forests. Sci. Adv. 2, e1501392 (2016).
- Kovács, B., Tinya, F. & Ódor, P. Stand structural drivers of microclimate in mature temperate mixed forests. Agric. For. Meteorol. 234–235, 11–21 (2017).
- Wolf, C. et al. Temporal consistency of undercanopy thermal refugia in old-growth forest. Agric. For. Meteorol. 307, 108520 (2021).
- Máliš, F. et al. Microclimate variation and recovery time in managed and old-growth temperate forests. Agric. For. Meteorol. 342, 109722 (2023).
- Brunet, J., Fritz, Ö. & Richnau, G. Biodiversity in European beech forests – a review with recommendations for sustainable forest management. Ecol. Bull. 77–94 (2010).
- Paillet, Y. et al. Biodiversity Differences between Managed and Unmanaged Forests: Meta-Analysis of Species Richness in Europe. Conserv. Biol. 24, 101–112 (2010).
- Nordén, B. et al. Effects of ecological continuity on species richness and composition in forests and woodlands: A review. Écoscience 21, 34–45 (2014).
- Mölder, A., Meyer, P. & Nagel, R.-V. Integrative management to sustain biodiversity and ecological continuity in Central European temperate oak (Quercus robur, Q. petraea) forests: An overview. For. Ecol. Manag. 437, 324–339 (2019).
- Glime, J. M. Bryophyte ecology. (2006).
- Vanderpoorten, A. & Goffinet, B. Introduction to Bryophytes. (Cambridge University Press, Cambridge, 2009). doi:10.1017/CBO9780511626838.
- Microclimat – Impacts des processus microclimatiques sur la redistribution de la biodiversité forestière en contexte de réchauffement macroclimatique. https://microclimat.cnrs.fr/.
- Gril, E. et al. Slope and equilibrium: A parsimonious and flexible approach to model microclimate. Methods Ecol. Evol. 14, 885–897 (2023).
- Cateau, E. et al. Tree inventory data from permanent plots in French forest reserves. Ecology 105, e4324 (2024).
- Gosselin, M. et al. Évaluation statistique d’un protocole de relevés bryologiques pour inventorier et suivre la biodiversité en forêt. Naturae 2021, 243–270 (2021).
- Fox, J. & Weisberg, S. An R Companion to Applied Regression, Third Edition. (Thousand Oaks CA, 2019).
- Oksanen, J. et al. Vegan: Community Ecology Package. (2019).
- Raabe, S. et al. Drivers of bryophyte diversity allow implications for forest management with a focus on climate change. For. Ecol. Manag. 260, 1956–1964 (2010).
- Dahlberg, C. J., Ehrlén, J., Christiansen, D. M., Meineri, E. & Hylander, K. Correlations between plant climate optima across different spatial scales. Environ. Exp. Bot. 170, 103899 (2020).
- Collart, F., Broennimann, O., Guisan, A. & Vanderpoorten, A. Ecological and biological indicators of the accuracy of species distribution models: lessons from European bryophytes. Ecography 2023, e06721 (2023).
- Vanderpoorten, A., Engels, P. & Sotiaux, A. Trends in diversity and abundance of obligate epiphytic bryophytes in a highly managed landscape. Ecography 27, 567–576 (2004).
- Bardat, J. & Aubert, M. Impact of forest management on the diversity of corticolous bryophyte assemblages in temperate forests. Biol. Conserv. 139, 47–66 (2007).
- Ódor, P., Király, I., Tinya, F., Bortignon, F. & Nascimbene, J. Patterns and drivers of species composition of epiphytic bryophytes and lichens in managed temperate forests. For. Ecol. Manag. 306, 256–265 (2013).
- Tinya, F. et al. Environmental drivers of forest biodiversity in temperate mixed forests – A multi-taxon approach. Sci. Total Environ. 795, 148720 (2021).
- Löbel, S., Snäll, T., Rydin, H. & Pugnaire, F. Species Richness Patterns and Metapopulation Processes: Evidence from Epiphyte Communities in Boreo-Nemoral Forests. Ecography 29, 169–182 (2006).
- Patiño, J. & Vanderpoorten, A. Bryophyte Biogeography. Crit. Rev. Plant Sci. 37, 175–209 (2018).
- Stewart, K. J. & Mallik, A. U. Bryophyte Responses to Microclimatic Edge Effects Across Riparian Buffers. Ecol. Appl. 16, 1474–1486 (2006).
- Gril, E. et al. The affinity of vascular plants and bryophytes to forest microclimate buffering. J. Ecol. 113, 22–38 (2025).
- Király, I., Nascimbene, J., Tinya, F. & Ódor, P. Factors influencing epiphytic bryophyte and lichen species richness at different spatial scales in managed temperate forests. Biodivers. Conserv. 22, 209–223 (2013).
- Man, M., Wild, J., Macek, M. & Kopecký, M. Can high-resolution topography and forest canopy structure substitute microclimate measurements? Bryophytes say no. Sci. Total Environ. 821, 153377 (2022).
- Růžičková, A., Man, M., Macek, M., Wild, J. & Kopecký, M. Temperature-driven vapor pressure deficit structures forest bryophyte communities across the landscapes. EGUsphere 1–22 (2025) doi:10.5194/egusphere-2025-1244.
- Táborská, M., Kovács, B., Németh, C. & Ódor, P. The relationship between epixylic bryophyte communities and microclimate. J. Veg. Sci. 31, 1168–1180 (2020).
- Gosselin, M. et al. Macroclimate modulates the positive dead-wood influence on bryophyte diversity in managed and unmanaged temperate lowland forests. J. Environ. Manage. 367, 121840 (2024).
- Zeller, L. et al. What does literature tell us about the relationship between forest structural attributes and species richness in temperate forests? – A review. Ecol. Indic. 153, 110383 (2023).
- Caruso, A. & Rudolphi, J. Influence of substrate age and quality on species diversity of lichens and bryophytes on stumps. The Bryologist 112, 520–531 (2009).
- Rudolphi, J. et al. Relative importance of thinned and clear-cut stands for bryophyte diversity on stumps. For. Ecol. Manag. 261, 1911–1918 (2011).
- Staniaszek-Kik, M., Żarnowiec, J. & Chmura, D. Cut stumps vs broken stumps: Does it make any difference in the maintenance of plant and lichen biodiversity in Central European mountain forests? For. Ecosyst. 11, 100206 (2024).
- Fuhr, M., Lalechère, E., Monnet, J.-M. & Bergès, L. Detecting overmature forests with airborne laser scanning (ALS). Remote Sens. Ecol. Conserv. 8, 731–743 (2022).
Utilisation de la bourse
J’ai pu utiliser la bourse pour les déplacements et les logements nécessaires à la réalisation des sessions de terrain. La bourse a été utilisée en complément d’une petite aide obtenue par l’unité EDYSAN. Le massif de l’Aigoual n’a pas pu faire l’objet d’un inventaire à la suite d’un problème de santé. Seul, les deux massifs de Blois et Mormal ont fait l’objet d’un inventaire. Le massif de l’Aigoual a été inventorié en été 2025, les données sont en cours de détermination et d’analyse. Les missions ont été réalisées du 14/10 au 18/10/2024 (Mormal) et du 12/11 au 20/11/2024 (Blois).



Commentaires récents