La Société Française d’Ecologie (SFE) vous propose en cette rentrée de septembre le regard de Katell Guizien, chercheuse CNRS à l’Observatoire Océanologique de Banyuls, sur la connectivité et la conservation de la biodiversité marine.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
Connectivité et conservation de la biodiversité marine
Katell Guizien
Chercheuse CNRS au Laboratoire d’Ecogéochimie des Environnements Benthiques (LECOB),
UMR8222 CNRS-UPMC, Observatoire Océanologique de Banyuls
——-
Mots clés : connectivité, habitats, populations, biodiversité marine, préservation de la biodiversité,
aires marines protégées, trame bleue marine, dispersion larvaire
——–
Introduction
En fixant un objectif de protection de 10 % des océans en 2020, le Plan Stratégique pour la Biodiversité 2011-2020 impose également d’étayer ces mesures de protection par une réflexion scientifique sur la représentativité écologique de zones protégées inter-connectées (COP 10, 2010). La feuille de route est claire : la connectivité, si chère à nous autres humains sur la toile virtuelle, devient un enjeu majeur en biologie de la conservation.
De nos jours, l’essentiel des mesures de conservation de la biodiversité sont basées sur le principe de régulation des activités humaines dans des zones naturelles géographiquement délimitées, dites protégées. Ainsi se pose tout d’abord la question de la taille minimale efficace de ces zones protégées pour assurer l’objectif de conservation, à savoir la persistance des espèces au fil des générations. L’objectif de conservation dans une zone géographique renvoie au concept écologique d’habitat qui décrit un ensemble d’éléments du paysage constituant le milieu et offrant les ressources suffisantes pour permettre la survie des espèces qui le peuplent. Certains auteurs estiment qu’un habitat (parce qu’il évolue) n’implique pas une viabilité à long terme pour les espèces locales, mais au moins une viabilité à court terme (Rosenberg et al., 1997). Ainsi, de nombreuses espèces qui nous sont familières présentent des comportements migratoires au cours de leur cycle de vie entre des zones géographiques différentes, leur permettant de maintenir les fonctions nécessaires à la survie de la population que sont la croissance et la reproduction.
Dans la pratique, la taille des zones protégées varie sur plusieurs ordres de grandeur de plusieurs centaines de km2 en milieu terrestre (530 km2 pour le Parc National de la Vanoise créé en 1963, 923 km2 pour le Parc National des Ecrins créé en 1973) à quelques km2 voire quelques centaines d’hectares en milieu marin (29 km2 pour la partie marine du Parc National de Port-Cros créé en 1963, 650 ha pour la Réserve Naturelle Marine de Cerbère-Banyuls créée en 1974). Ces différences de taille semblent davantage s’expliquer par des arguments pragmatiques de mise en œuvre de la régulation que par des fondements scientifiques (écologiques). En effet, si les nécessités de migration des animaux terrestres justifient de grands espaces, il est étonnant que le caractère fortement dispersif des courants en milieu marin ait été absent de la réflexion sur l’implantation des aires marines protégées (AMP).
La circulation marine : le moteur de la connectivité en milieu marin

Ponte de gorgone rouge (Paramuricea clavata ), Archipel de Riou, Marseille (© Anthony Leydet, www.zesea.com)
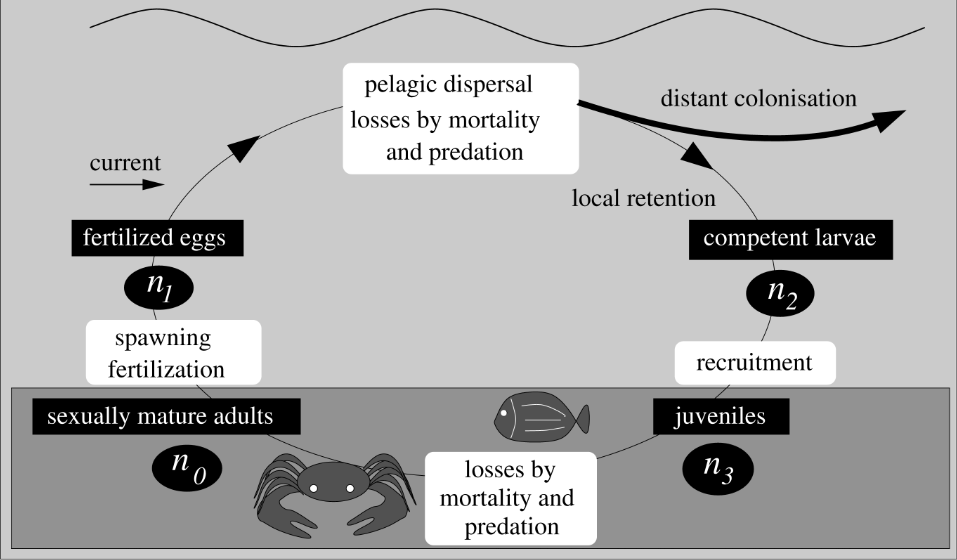
Figure 1 : Schéma du cycle de vie de la plupart des espèces marines (extrait de Guizien et al., 2012)
La dispersion de ces larves par les courants marins peut se distinguer de celle des particules passives par la capacité des premières à contrôler leur flottabilité ou leur chute, cette capacité étant très variable d’une espèce à l’autre et évoluant souvent avec l’âge et l’état physiologique. Les courants marins sont alors susceptibles de transporter les larves sur de grandes distances, mais peuvent également contribuer à leur piégeage dans des boucles de recirculation plus ou moins pérennes ou les évacuer vers des zones non propices à leur survie.
Par exemple, dans le Golfe du Lion, l’interaction des deux vents dominants, le Mistral à l’Est et la Tramontane à l’Ouest, avec le courant Liguro-Provençal-Catalan s’écoulant au large d’Est en Ouest (Figure 2), génère des boucles de recirculation suffisamment persistantes entre Aigues-Mortes et Agde pour favoriser la rétention de larves séjournant dans la colonne d’eau pendant plusieurs semaines au printemps (Guizien et al., 2012). A l’inverse, la plupart des larves issues des populations des fonds sableux du Roussillon seront transportées en dehors du Golfe du Lion, vers les côtes espagnoles.
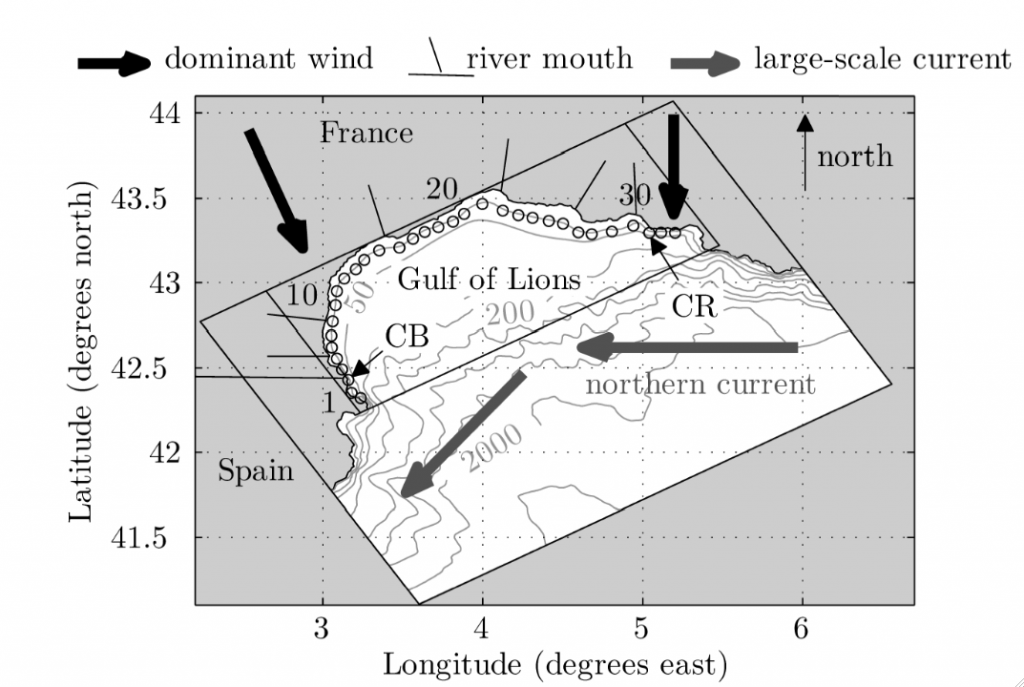
Figure 2 : Carte bathymétrique du Golfe du Lion, montrant le large plateau continental délimité par l’isobathe 200 m. Les directions des vents dominants et du courant Nord (ou Liguro-Provençal-Catalan) sont également indiquées. CB et CR figurent les localisations de deux aires marines protégées incluant des zones intégrales ou sanctuaires du Golfe du Lion.
La trame bleue marine : croiser habitat des adultes et dispersion larvaire
Cette phase dispersive peut donc avoir deux effets antagonistes sur la persistance des espèces : d’une part diminuer la persistance locale à un niveau parfois trop faible pour assurer le maintien d’une population (McLeod et al., 2009), mais aussi augmenter la persistance régionale par la distribution de l’espèce sur plusieurs sites, accroissant sa résilience aux perturbations locales et à la fragmentation de l’habitat (Foley et al., 2010). La définition d’aires marines protégées (AMP) isolées peut alors s’avérer inadaptée aux espèces dont le cycle de vie présente une phase dispersive. Ainsi, une tentative de dimensionnement d’AMP isolées basée sur le taux de rétention local dans l’AMP indique clairement que les AMP actuellement situées aux extrémités du Golfe du Lion n’ont pas la taille nécessaire pour assurer le maintien des populations d’espèces à stade larvaire dispersif (Guizien et al., 2012). Par contre, dans la zone centrale du Golfe du Lion, il serait possible d’assurer la persistance locale de nombreuses espèces dans des AMP d’environ 20 kms de rayon (Figure 3).
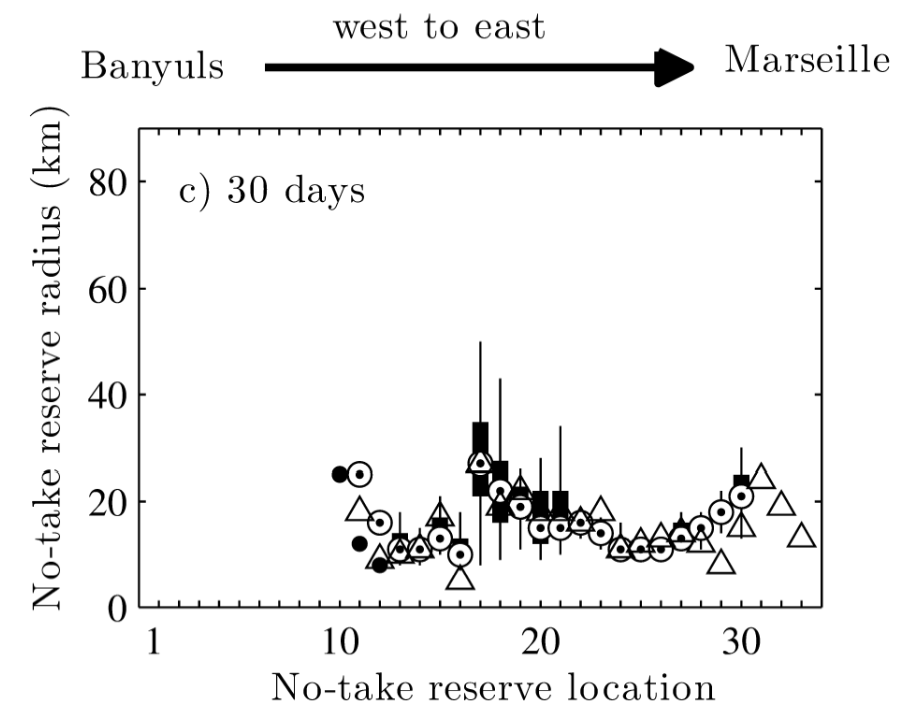
Figure 3 : Taille minimale d’une aire marine protégée isolée permettant la persistance d’une espèce avec un stade larvaire dispersif de 3 semaines et une ponte étalée sur 30 jours en fonction de sa localisation le long du Golfe du Lion. Les différents symboles correspondent à différents comportements de mobilité du stade larvaire dispersif (extrait de Guizien et al., 2012).
Il est donc primordial d’intégrer cette dimension dispersive dans l’évaluation des causes de la persistance régionale des espèces. En effet, il est possible que sur certains sites, des espèces soient favorisées par une rétention locale forte si l’habitat est de taille suffisante, ces sites pouvant alors assurer un rôle de réservoir régional pour ces espèces. Cependant, il est également possible que la taille restreinte des zones de protection soit insuffisante pour assurer la persistance locale. Ce dernier point invite donc directement l’action publique à s’interroger sur les causes du maintien des espèces dans et hors les zones de protection, en intégrant cette dimension dispersive. En effet, en cas d’absence de persistance locale, le maintien des espèces est dû à la connectivité des zones de protection avec d’autres sites dits sources, assurant la persistance régionale de ces espèces.
Ainsi, les populations des fonds sableux du Roussillon, bien que situé dans le Parc Naturel Marin du Golfe du Lion récemment créé, ne se maintiennent sans doute pas de façon isolée compte tenu du faible taux de rétention locale. Par contre, leur maintien et même leur recolonisation après des accidents démographiques sérieux sont permis par l’arrivée récurrente de larves issues de populations du Languedoc, où les mesures de protection sont réduites (Guizien et al., sous presse).

Fig. 4a : Fonds sablo-vaseux du Golfe du Lion, dominés par l’annélide polychète Ditrupa arietina (© M. Desmalades).
Actuellement, la réflexion sur la conservation de la biodiversité évolue vers la prise en compte de la connectivité entre différents habitats. Cette question scientifique est implémentée au niveau législatif en France dans les lois du Grenelle de l’environnement sur l’établissement de corridors écologiques, dite ‘trame verte et bleue’. En milieu marin, la prise en compte de la connectivité écologique est reprise sous le terme de la trame bleue marine visant à assurer une cohérence spatiale de la protection. A l’inverse de la trame verte et bleue (TVB), la trame bleue marine n’est pas à aménager, mais à identifier. Elle n’est pas bidimensionnelle (sur une surface) mais tridimensionnelle (dans un volume) et pose des difficultés de représentation. Mais surtout, l’estimation de la connectivité écologique fait débat au sein de la communauté scientifique, avec des approches méthodologiques différentes qui intègrent une ou plusieurs étapes du cycle de vie, et conduisent à des représentations parfois contradictoires de la connectivité (cf. encart).
A titre d’exemple, pour des espèces longévives, les connectivités démographique et génétiques entre populations distantes peuvent être bloquées par limitation de recrutement, lié au manque d’habitat disponible pour de nouveaux individus (migrants) issus des populations sources, alors que la connectivité hydrodynamique pourrait permettre une récupération populationnelle en cas d’accident démographique. Cependant, dans ce contexte, il est difficile de projeter la récupération effective des populations, en particulier dans leur diversité génétique. Pour cela, des expériences grandeur nature testant l’efficacité de la connectivité marine pour la résilience des populations restent à réaliser. De telles expériences renvoient aux questions éthiques de l’ingénierie écologique, et devrait être recoupées avec les expériences de mise en œuvre de la trame verte et bleue en milieu terrestre. Afin d’éviter des expérimentations inutiles, voire délétères, il me semble qu’une méthodologie préalable serait de tester des modèles théoriques de colonisation dans des simulations numériques appliquées.
Encart : Trois approches méthodologiques de la connectivité marine
La connectivité génétique est révélée dans le niveau de similarité génétique entre les populations d’un paysage. Cette similarité résulte d’un déséquilibre entre le taux de migration (tendant à homogénéiser la diversité génétique entre populations) et la dérive génétique amplifiant la dominance de certains allèles dans une population de taille finie ou la sélection naturelle conduisant toutes deux à diminuer la diversité génétique locale, et le taux de mutation tendant à augmenter la diversité génétique locale (Hamilton 2009). Il s’agit d’une connectivité réalisée intégrant le cycle de vie complet de l’espèce, et à long terme car intégrant l’histoire passée des populations.
La connectivité hydrodynamique consiste à estimer la proportion de propagules transférées d’un site à un autre. Elle repose sur la simulation numérique de la dispersion d’organismes planctoniques combinant des simulations de l’hydrodynamisme avec une description du comportement de motilité des organismes (Cowen and Sponaugle 2009). Il s’agit d’une connectivité potentielle, qui ne tient pas compte d’éventuelles limitations au cours des phases d’installation ou de recrutement. Il s’agit aussi d’une connectivité éphémère, qui ignore les limitations du succès reproductif dans la population locale à la génération suivante.
La connectivité démographique consiste à estimer le nombre de migrants s’installant dans une population. Elle repose sur le marquage d’individus ou l’identification de la filiation génétique (Levin 1990). Il s’agit également d’une connectivité éphémère mais intégrant davantage d’étapes du cycle de vie jusqu’au succès de l’installation du migrant.
Bibliographie
COP 10, 2010. Conférence des Parties de la Convention des Nations-Unies pour la Diversité Biologique, Nagoya-Japon, 2010. https://www.cbd.int/decision/cop/?id=12268
Cowen, R.K. & Sponaugle, S., 2009. Larval dispersal and marine population connectivity. Annual Review of Marine Science, 1, 443-466.
Foley M.M., et al., 2010. Guiding ecological principles for marine spatial planning. Marine Policy, doi:10.1016/j.marpol.2010.02.001
Guizien K., Belharet M., Guarini J.M., Marsaleix P., 2012. Using larval dispersal simulations for Marine Protected Area design: application to the Gulf of Lions (NW Mediterranean). Limnol. and Oceanogr. 57(4), 2012, 1099-1112 | DOI: 10.4319/lo.2012.57.4.1099.
Guizien K., Belharet M., Guarini J.M., Moritz C. (sous presse) Marine benthic metapopulations vulnerability: implications of spatially structured connectivity for conservation practice. Diversity and Distributions.
Hamilton M.B., 2009. Population genetics. Wiley-Blackwell. 407 p.
Levin LA, 1990. A review of methods for labeling and tracking marine invertebrate larvae. Ophelia 32:115–144.
McLeod E, Salm R, Green A, Almany J., 2009. Designing marine protected area networks to address the impacts of climate change. Front Ecol Environ. doi:10.1890/070211
Rosenberg D.K., Noon B.R. & Meslow E.C., 1997. Biological Corridors: Form, Function, and Efficacy. BioScience 47(10): 677-687.
Thorson G., 1946. Reproduction and larval development of Danish marine bottom invertebrates, with special reference to the planktonic larvae in the Sound (Oresund). Medr.Komm.Danm.Fisk. og Havunders. S. plankton IV(1):1-52.
Et ces trois « regards » en ligne sur cette plateforme :
Prévot-Julliard A-C., Clavel J. et P. Teillac-Deschamps, 2011. Les quatre R de la conservation. Regards et débats sur la biodiversité, SFE, Regard n°14, 22 mars 2011.
Robert A, 2011. Les petites populations – Processus démographiques, génétiques et vortex d’extinction. Regards et débats sur la biodiversité, SFE, Regard n°9, 10 janvier 2011.
Thompson J. et O. Ronce, 2010. Fragmentation des habitats et dynamique de la biodiversité. Regards et débats sur la biodiversité, SFE, Regard n°6, 18 novembre 2010.
—
Article édité et mis en ligne par Anne Teyssèdre.



Merci Katell pour ce « regard » très complet et didactique concernant la connectivité larvaire et la conservation. Dans ce cadre de conservation justement, une opinion répandue au niveau international est que si les habitats, notamment les habitats d’installation ou ceux des juvéniles, ne sont pas protégés/disponibles, se soucier de la connectivité larvaire ne sert à rien, car la limite des populations est finalement ailleurs. Une longue opposition a eu lieu en milieu corallien, entre « limitation par l’habitat » (via une mortalité densité dépendante des recrues) et « limitation par le recrutement », jusqu’au début des années 2000. Qu’en est-il sur nos côtes? Dispose-t-on de données sur la mortalité des juvéniles vs. l’afflux larvaire qui permettraient de trancher dans un sens ou dans un autre? Comment, finalement, justifier la recherche sur la connectivité, intéressante en elle-même, dans une perspective finalisée de conservation?
Merci Jean-Olivier pour cette question tout-à-fait pertinente: en effet, la phase d’installation est une limitation qui intervient après la dispersion, mais qui n’a de sens que si la dispersion a eu lieu. A l’échelle globale, protéger les habitats d’installation observés devrait à l’état stable suffire puisque si elles existent, c est que la dispersion larvaire et la phase d’installation ont été efficaces. Mais ce raisonnement ne s’applique qu’à l’échelle globale.
Le problème, c’est que dans le problème de la conservation des espèces, d’une part on a rarement une connaissance de la distribution spatiale de toutes les populations, et d’autre part il est peu probable que connaissant cette distribution spatiale, nous décidions de mettre l’ensemble des populations sous protection. En effet, la faille du raisonnement de protection des seuls habitats d’installation à l’échelle locale, c’est qu’en présence de dispersion larvaire, les populations d’origine des juvéniles s’installant dans des populations d’installation ne sont pas nécessairement les populations d’installation elle-même, et qu’il y a donc une risque de tarir l’installation, si les populations d’origine ont disparu. Et c’est là, tout l’enjeu de la connectivité vis-à-vis de la conservation, sans antagonisme avec la conservation des habitats d’installation. Il n’y a pas de primauté dans un cycle de vie, toutes les phases doivent se réaliser.
Par ailleurs, dans le contexte actuel du changement global, il est légitime de se demander comment évolueront ces patrons de connectivité (voir la réponse au commentaire suivant), afin d’évaluer si les échanges de larves abonderont de nouveaux habitats d’installation non encore identifiés.
Bonjour Katell,
et bravo pour ce regard marin ! J’ai moi aussi une (double) question: Que sait-on de l’impact du changement climatique en cours – impacts en particulier du changement de température de surface et de l’acidification, mais aussi de l’augmentation éventuelle des tempêtes, … (l’impact de l’augmentation du niveau de l’eau, le long du littoral, semble plus simple à prévoir) – sur la connectivité des populations marines (et donc sur le fonctionnement des communautés marines) ? Ces connaissances sont-elles prises en compte dans les nouveaux objectifs et méthodes de conservation de la biodiversité marine ? (Par la trame bleue marine ?)
Merci d’avance pour votre réponse, bien cordialement,
Anne
Bonjour Anne,
et merci pour votre question qui me permet de développer ma réponse à Jean-Olivier sur l’évolution des patrons de connectivité dans le contexte du changement global: en fait, l’intégration des effets de l’augmentation de la température ou l’acidification des océans dans la dispersion larvaire est encore très incertaine par manque d’information sur l’ensemble de paramètres de la dispersion pouvant être affecté par ces changements; si l’évolution de la circulation océanique peut être prédite dans les modèles de climat (même si elle est encore rarement prédite aux échelles spatiales pertinentes pour la dispersion larvaire), l’évolution des périodes de ponte et des survies larvaires est bien moins prévisible, car ces variables sont le résultat de l’intégration des variations globales de l’écosystème, via la nutrition des organismes. Pour faire court, l’espèce se reproduira si elle peut accumuler suffisamment de réserve dans le temps nécessaire au développement des gonades. Cette variable est certainement la plus délicate à projeter dans les scénarios d’évolution climatique, et limite fortement le transfert jusqu’à l’évolution de la pratique de la conservation.
Pour répondre à Anne T, voici un lien vers une étude qu’on a fait avec des collègues sur l’effet des changements climatiques sur la connectivité marine, j’espère que vous le trouverez utile….
http://onlinelibrary.wiley.com/doi/10.1111/ddi.12250/abstract
Pour résumer, on s’est intéressé principalement à la hausse de la température et aux changements hydrodynamiques, par modélisation; et on a découvert que la hausse de la température pourrait entrainer une diminution de la distance de dispersion larvaire, suite à une augmentation de la vitesse de croissance des larves.
Ca reste de la modélisation sans validation avec des observations de terrain (très difficiles à obtenir en ce cas) mais ça donne des tendences intéressantes.
Bonjour Katell et Marco,
et merci pour vos réponses. L’article de modélisation de Marco A. et al. sur l’impact du réchauffement climatique sur la connectivité marine, tout récent, est en effet très intéressant..
Bonjour,
Je me permets de mettre également mon grain de sel, dans ce débat bien qu’il soit par nature déjà à 27 psu…
La règle étant la controverse courtoise, mais la controverse quand même pour faire avancer les schmilblick, je vais essayer de prendre le contre-pied de ce que Katell Guizien a (fort bien) écrit, en la remerciant pour avoir pris cette initiative.
Je serai d’abord d’accord avec elle quand elle dit :
« Mais surtout, l’estimation de la connectivité écologique fait débat au sein de la communauté scientifique, avec des approches méthodologiques différentes qui intègrent une ou plusieurs étapes du cycle de vie, et conduisent à des représentations parfois contradictoires de la connectivité (cf. encart). ». Non seulement son estimation, mais son impact sur la persistance des peuplements aussi…
Mon contre-propos peut se résumer ainsi :
« la circulation marine, ni même la connectivité, ne sont pas les choses principales à prendre en compte pour le design d’aires marines protégées »
En fait si je caricature son propos, Katell nous propose un fonctionnement mécanistique de type source-puits majoritairement régit par la circulation marine dans lequel il faudrait s’assurer, pour chaque espèce, qu’on dispose de sources susceptibles de fonctionner comme émettrices mais aussi comme réceptrices pour assurer le maintien d’une espèce donnée. Sans bien sûr nier la réalité des phénomènes source-puits dans le sens démographique du terme, je propose qu’ils sont en assez fait marginaux et que l’essentiel du fonctionnement des écosystèmes marins ne peut pas se résumer à la dépendance de tels systèmes source-puits vis-à-vis de la courantologie. Je développerai cet argument dans le commentaire qui suit…
(Suite de mon commentaire de ce matin)
Il y a selon moi en gros 4 grandes catégories d’espèces dans le milieu marin :
-celles décrites par Katell qui sont fixées, qui émettent de nombreuses larves de petite taille en général dispersées passivement au moins au début de leur vie larvaire relativement longue dans la colonne d’eau –typiquement : un mollusque bivalve ou un annélide (type A);
-les espèces fixées ou très peu mobiles, avec cycle de vie raccourci et larves ou propagules se fixant ou vivant (au moins la majorité d’entre elles) assez près des parents – typiquement : coraux, macro-algues, de nombreuses ascidies, mais aussi petits poissons benthique à gros œufs collés (type B);
– les mêmes caractéristiques initiales de dispersion que le type A, mais les adultes sont (un peu, beaucoup, à la folie…) mobiles et les larves acquièrent un comportement actif dans la dernière phase de leur vie –typiquement : poissons (type C);
– les espèces qui ressemblent plus à beaucoup d’espèces terrestres, vivipares ou ovovivipares, qui ont des descendants qui s’affranchissent très vite des courants et peuvent se déplacer très tôt sur de grandes distances – typiquement : sélaciens, mammifères marins (type D).
Ces espèces n’ont bien évidemment pas la même dépendance les unes et les autres vis-à-vis de la circulation marine.
Pour celles du type D, la question de la connectivité ne se pose quasiment pas, c’est plutôt la qualité de l’habitat qui prime, où qu’il soit, pourvu que les jeunes stades et les adultes puissent survivre. Laissons-les donc de côté pour le moment.
Pour celles du type C non plus, elles émettent beaucoup de propagules dans le milieu, et nombre d’entre elles sauront trouver un habitat favorable à leur recrutement, même situé apparemment dans des directions opposées à la courantologie dominante. Le positionnement vertical dans la colonne d’eau permet par exemple à ces larves d’influer sur la direction de leur déplacement. Il existe de très nombreux papiers décrivant ce type d’adaptations comportementales, en milieu insulaire et récifal notamment. Mais il y a tout lieu de penser que ce soit également le cas pour la plupart des poissons benthiques ou démersaux de nos côtes. Pour les pélagiques, la notion d’AMP est plus floue, et leur nomadisme relatif est une condition essentielle de leur survie.
Pour celles du type B, l’auto-recrutement sera un mode prédominant d’entrée des juvéniles dans la population adulte, et si la zone favorable (appelons-la AMP si vous voulez) est suffisamment grande, (là je suis d’accord avec ce point soulevé par Katell, reste à savoir si on peut définir correctement ce suffisamment grand) alors il n’y aura pas de problèmes de connectivité démographique. De plus, comme les courbes de dispersion sont en général très asymétriques avec beaucoup de propagules bougeant très peu et quelques propagules bougeant très loin, les (re)colonisations et le flux génique à longue distance restent quand mêmes assez bien assurés sur le moyen terme.
Pour celles de type A, c’est probablement-là que les questions de source-puits (au sens démographique) soulevées par KG sont le plus pertinentes. Néanmoins, il n’y a probablement pas trop de soucis à se faire car ce type d’espèces marines typiques à très fortes fécondités présentent en général de très forts effectifs efficaces (merci à ceux qui auraient de bons exemples du contraire de nous les signaler…cas particulier de la grande nacre ?*) et on en général colonisé garce à leur phase dispersives tous les endroits favorables sur le moyen terme au bouclage de leur cycle vital. Il est donc probable qu’elles ne dépendent pas d’une AMP en particulier pour leur maintien dans le système. Pour ces espèces, il faudrait aussi tenir compte des populations qui continueront à exister, mêmes en dehors des AMPs, du fait de ces caractéristiques.
En résumé de mon propos, je proposerai que le critère principal de définition d’une AMP, si tant est qu’on puisse imaginer les positionner dans un espace vierge de contraintes socio-politico-économiques, ressort probablement plus des questions de qualité d’habitat pour la survie des adultes ET le recrutement des juvéniles tel que le rappel Jean-Olivier Irisson, plutôt que de celles de connectivité écologique.
En disant ceci, je ne dis pas que l’hydrodynamisme ne joue aucun rôle dans la distribution des espèces marines. Je dis juste en fait qu’il a été survendu pendant un siècle probablement du fait de l’influence de l’océanographie physique sur les biologistes marins. Et comme la définition d’AMP est un travail de pompiers qui doit prendre en compte toutes les contraintes humaines précitées ET en même temps tenter d’optimiser le maintien d’espèces ayant des cycles vitaux extrêmement variés revêtant parfois des aspects contradictoires, il me semble clair que la qualité/quantité des habitats et la nature des usages humains qui y sont autorisés restent la principale question.
Nous n’avons ici discuté principalement que des aspects écologiques et dynamiques. Au plan de la connectivité génétique, il me semble qu’il y aurait également beaucoup à dire, avec pas mal d’idées-bateaux pas toujours vérifiées qui sont souvent reprises en boucle alors qu’elles n’ont pas ou peu de support expérimental….
François Bonhomme, Station de biologie marine de Sète
* pour la grande nacre, c’est peut-être juste une espèce typique comme les autres, dont simplement les populations adultes ont été quasiment éradiquées par la pêche. Le déterminisme de son recrutement sporadique ici et là serait une question très intéressante à éclairer…
Bonjour Mr Bonhomme,
Voulez-vous dire que la « connectivité » est du system-washing? Est-ce que cela joue le jeu du green-washing en essayant de peindre vivant et non-vivant de la même couleur?
Amicalement,
Michel
Euh… je ne suis pas sûr d’avoir tout à fait bien compris la question…! Je pense qu’il n’y a aucun « washing » là-dedans, juste le fait que certaines communautés de chercheurs mettent l’accent sur ce sur quoi elles travaillent, ce qui au fond est bien normal. Dans le domaine marin, les forçages physiques ont toujours été mis en avant comme prépondérants, que ce soit les fronts océaniques, les courants et gyres (courants circulaires), les gradients de température, de salinité, etc… parce que les océanographes étaient d’abord des océano-graphes, produisant ce genre de données, et parce que peut-être la réponse du biologique là-dedans est longtemps restée une boîte noire, faute de moyens d’observation.
Tout ceci est en train de changer, avec de plus en plus de moyens d’investigation directs (marquages divers) et indirects (génétique, sclérologie, isotopes,…), mais il n’en reste pas moins vrai que les explications un peu mécaniques ont toujours le vent en poupe dans la mer.
Ensuite, chacun pense toujours que ce qu’il fait est extrêmement important, et il faut convaincre les petits camarades qui sont aux commandes des sources de financements que ça serait une bonne idée de mettre un peu le paquet dans cette direction plutôt qu’une autre. C’est de bonne guerre, personne n’échappe à cette concurrence thématique, et moi non plus d’ailleurs puisque j’ai réagi à la prise de position de Katell Guizien !
Merci François pour ce long complément qui vient rééquilibrer mon propos effectivement centré sur les espèces de type A. Comme je l’ai répondu à Jean-Olivier, pour ma part, il n’y a pas de hiérarchie entre installation et connectivité. Mais je pense que l’on aurait tort de limiter la réflexion sur l’implantation des AMP à la sélection d’habitat de bonne qualité sans se poser la question de leur localisation optimale dans une mer sous contraintes. Je suis d’accord qu’en l’absence de contraintes, la dispersion a permis par le passé de coloniser une grande partie de ces habitats puisque les espèces y sont, mais si un choix doit être fait, mettre en place une protection des zones géographiques sources devrait être privilégier, à qualité d’habitat égale s’entend.