La Société Française d’Ecologie (SFE) vous propose cette semaine le regard de Michel-Pierre Faucon, enseignant-chercheur à l’Institut Polytechnique LaSalle Beauvais, sur l’écologie et la biodiversité des sites métallifères.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions après cet article. Les auteurs vous répondront et une synthèse des contributions sera ajoutée après chaque article.
———
———
Trésor minéral et diversité végétale
par Michel-Pierre Faucon
Unité Hydrogéochimie Interactions Sol-Environnement (HydrISE),
Institut Polytechnique LaSalle Beauvais (IGAL-ISAB)
Regard R32, édité par Anne Teyssèdre
(Fichier PDF)
———
Mots clés : métaux, plantes, sols, adaptation, évolution, endémisme, bioaccumulation,
érosion de la biodiversité, phytoextraction, mécanismes, facteurs d’impact.
L’originalité botanique des sites métallifères
Les « métaux lourds » sont définis en général comme les éléments chimiques ayant une densité supérieure à 5 g/cm3. Hormis le fer (Fe) et le manganèse (Mn), tous sont rares dans la croûte terrestre et sont donc des éléments traces métalliques (ETM). Ils exercent leur action toxique sur les plantes même à des concentrations relativement faibles dans le sol.
Les sols riches en métaux, ou « métallifères », sont d’origine soit naturelle soit anthropique (c’est-à-dire que leur formation résulte d’activités humaines). Les premiers se développent sur des affleurements de roches métallifères. Considérés comme des anomalies géochimiques, ils sont exceptionnels à la surface de la planète. La teneur en ETM de ces sols peut être très élevée ; elle peut atteindre plusieurs grammes par kilogramme de sol, mais diminue rapidement lorsqu’on s’éloigne de l’affleurement.

Figure 1. Affleurements de roches de cuivre et de cobalt en République Démocratique du Congo, appelés « collines de cuivre » composées de végétations herbacées entourées de forêt claire (© P. Meerts).
Les affleurements naturels de roches métallifères les plus répandus à la surface de la terre sont des affleurements serpentiniques riches en nickel, en fer et en magnésium répartis sur les différents continents de la planète. On trouve aussi des affleurements de fer, de manganèse, de cuivre, de cobalt, d’or et d’autres minerais rares. Ils induisent très souvent des modifications de la végétation et donc des paysages. En effet, la toxicité des éléments traces métalliques opère une sélection très poussée, en éliminant de nombreuses espèces qui, toutes autres conditions égales, devraient croître en ces lieux. De manière très caractéristique la croissance des espèces ligneuses (arbres et arbustes) est inhibée, ce qui aboutit au développement de groupements végétaux purement herbacés ou faiblement arbustifs, particulièrement remarquables dans une région forestière.
Depuis un siècle, le développement des activités d’extraction et de transformation de minerais a dispersé des métaux toxiques et contaminé des surfaces bien plus vastes que celles occupées par les affleurements naturels. De nouveaux types d’habitats métallifères sont ainsi apparus.
Dans le cas des sites à serpentine, par exemple, le sol issu de l’altération de minéraux naturellement riches en métaux (Ni, Fe et Cr) porte une flore spécifique adaptée aux fortes teneurs métalliques. Nombreux scientifiques à travers le monde se sont intéressés à la flore serpentinique et se sont fédérés en créant The International Serpentine Ecology Society (http://ultramafic-ecology.org). De même au Katanga, en République Démocratique du Congo, les affleurements riches en cuivre (Cu) ou en cobalt (Co) présentent des formations végétales particulières au sein du paysage (Figure 1). Remarquons que les divers types d’habitats métallifères présentent une végétation hautement originale et unique. Les conditions écologiques extrêmes de ces différents types de sols métallifères ne permettent que l’installation d’espèces présentant des traits particuliers et entraînent la constitution de communautés végétales originales (http://copperflora.org/Eflora/).
Les végétations des affleurements métallifères possèdent un nombre important d’espèces endémiques, très vraisemblablement nées sur les sites métallifères par le jeu de l’isolement écologique et géographique.
Dans le cas des sites métallifères d’origine anthropique, dits « anthropogènes », une flore locale des habitats non métallifères a colonisé rapidement ces milieux nouvellement contaminés en acquérant des capacités de résistance aux ETM (Antonovics et al. 1971). Les végétations qui s’y développent sont d’origine récente. La colonisation végétale de ces habitats est alimentée en partie par les populations de plantes non tolérantes existant à proximité. Le crible sélectif très sévère qu’impose la toxicité des métaux peut entraîner une évolution rapide vers des niveaux de tolérance élevés. Ces habitats représentent donc un modèle intéressant pour étudier les processus évolutifs rapides d’adaptation à des facteurs écologiques très contraignants. Même si la flore des habitats métallifères anthropogènes provient d’habitats non métallifères, les espèces qui la composent s’assemblent en une végétation particulière par rapport aux habitats non métallifères locaux (Ernst 1974).
Dans d’autres régions minières de la planète, les sites métallifères anthropogènes peuvent être colonisés par des espèces tolérantes aux métaux provenant des affleurements métallifères naturels (primaires). Néanmoins, la végétation des habitats métallifères naturels se distingue des habitats anthropogènes. Elle est composée de communautés anciennes (dites primaires) pourvues d’espèces pérennes comprenant des « métallophytes absolus », plantes absentes des sols non métallifères et des « pseudométallophytes », plantes présentes aussi sur sols non métallifères.
_________________________________________________________________________________
Glossaire :
- Anthropique : lié aux activités humaines.
- Anthropogène : d’origine anthropique.
- Autofécondation : qui s’apparie à lui-même ; s’applique bien entendu seulement aux individus qui portent à la fois les organes sexuels mâles et femelle.
- Communauté : association de populations de différentes espèces en interaction, généralement définie sur la base de leurs interactions et/ou par le lieu où elles vivent.
- Ecotype : sous-population génétiquement différenciée restreinte à un habitat particulier.
- Edaphique : relatif au sol.
- Eléments tracs métalliques, ou ETM : Métaux ou ions métalliques présents en très faible concentration (traces) dans le milieu considéré.
- Katanga : province du sud est de la République Démocratique du Congo, frontalière à la Zambie, au Burundi et à la Tanzanie.
- Métallicoles : se dit de communautés et populations végétales qui se développent et se reproduisent sur des sols riches en métaux.
- Métallifère : se dit d’une roche ou d’un sol riche en métaux.
- Métallophyte : espèce végétale qui vit spécifiquement sur des sols riches en éléments traces métalliques.
- Population : ensemble d’individus appartenant à la même espèce, présents simultanément dans un même site géographique.
- Serpentine : roche rougeâtre ou verte riche en nickel.
- Spéciation écologique : Apparition de nouvelle(s) espèce(s) par différentiation écologique d’une espèce ancestrale.
- Taux d’endémisme : Proportion d’espèces confinées à une certaine région.
_________________________________________________________________________________
Les grandes stratégies de tolérance des plantes aux éléments traces métalliques
La tolérance aux ETM d’une plante est sa « capacité à survivre et se reproduire sur des sols toxiques ou défavorables à la plupart des organismes en raison d’une contamination métallique » (Turner 1969). Une grande diversité de comportements vis-à-vis des métaux existe dans la flore associée aux sites métallifères, dite flore métallicole. En comparant les concentrations en métal des parties aériennes et des parties racinaires on met en évidence deux grandes stratégies de tolérance des plantes aux ETM : l’exclusion des métaux des parties aériennes ou, au contraire, l’accumulation des métaux dans les feuilles (Baker & Walker 1990) (Figure 2).
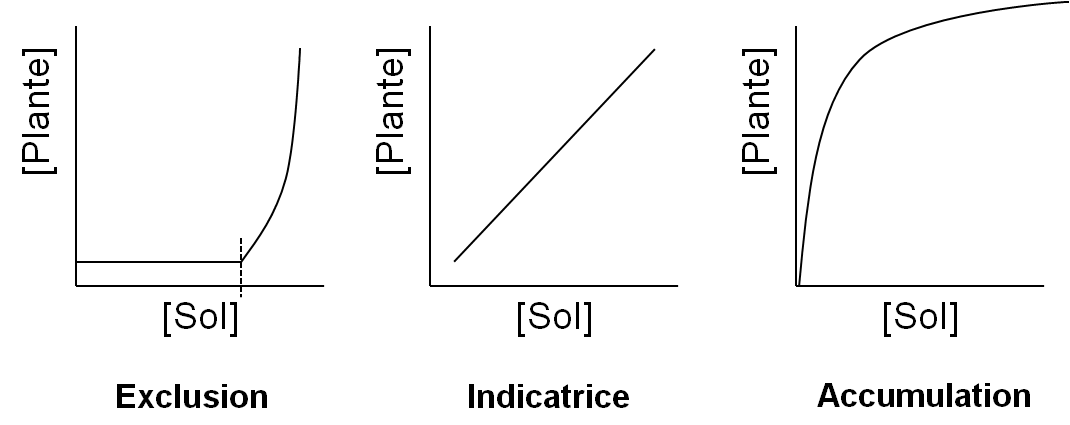
Figure 2 : Représentation schématique des stratégies rencontrées chez les plantes en réponse à une augmentation des concentrations en métal dans le sol. En abscisses et en ordonnées : concentrations en ETM respectivement dans le sol et dans la plante. D’après Baker, 1981.
L’accumulation d’ETM tels que le cuivre et le cobalt est observée chez les métallophytes se développant sur des sols riches en ces ETM et non lorsqu’elles sont cultivées sur des substrats artificiels contaminés. L’accumulation du cuivre et du cobalt est un phénomène complexe qui semblerait exister uniquement dans des conditions édaphiques (i.e. de sol) particulières. Pour comprendre ce phénomène, les chercheurs se mobilisent en examinant la biodisponibilité du cuivre et du cobalt dans le sol et les interactions entre ces deux ETM et les autres éléments chimiques du sol.
Endémisme et richesse floristique des sites métallifères
La flore des sols chimiquement mal balancés (métallifères, salins, gypseux, calcaires…) compte souvent des espèces endémiques*. Depuis plusieurs siècles, les botanistes sont fascinés par l’existence de paires d’espèces proches, associées à des sols aux conditions chimiques contrastées. L’adaptation des plantes aux ETM a été le modèle le plus étudié pour montrer une différenciation adaptative en réponse aux concentrations extrêmes en métal du sol. Les sites métallifères présentent très souvent un endémisme et une spécialisation écologique élevés.
L’endémisme des affleurements métallifères contribue à la biodiversité de certaines régions du monde. Les plantes endémiques des affleurements serpentiniques de Californie, correspondent à au moins 10% de la flore endémique de l’état de Californie. En Nouvelle Calédonie, elles représentent environ 60% de la flore indigène de l’île (Jaffré 1992).
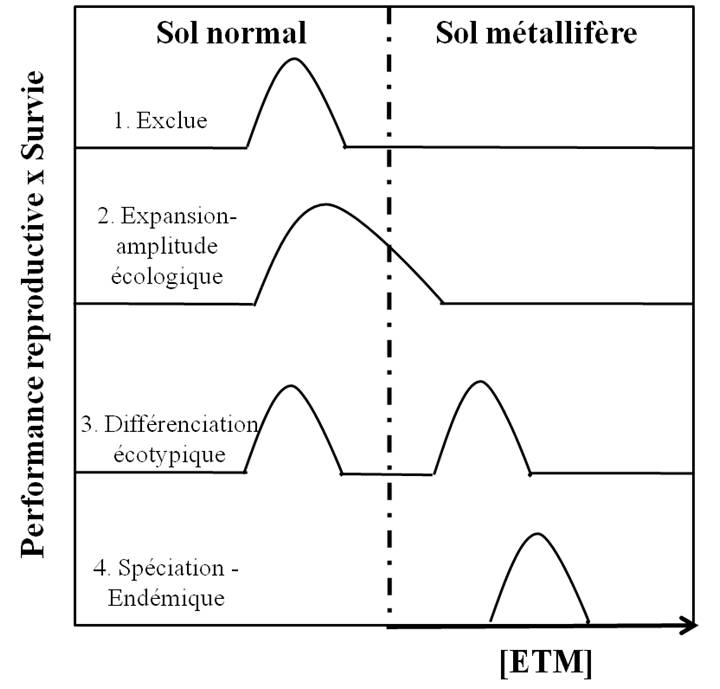
Figure 3. Scénario de spéciation d’une espèce sur sol métallifère (d’après Kruckeberg 1984). En abscisses : concentration en éléments traces métalliques (ETM)
La plupart des grands mécanismes évolutifs ont été invoqués pour expliquer cet endémisme (Figure 3). Les travaux de l’école de Bradshaw sur les mines de zinc et de cuivre en Grande-Bretagne ont mis en évidence les processus évolutifs associés à la colonisation des sols métallifères. Tout d’abord, il existe un flux de semences issues de populations non-métallicoles mais présentant une variation de la tolérance aux ETM ; ceci correspond à la deuxième étape de la Figure 3 (expansion – amplitude écologique).
Une sélection divergente (qui favorise les génotypes* extrêmes d’une population) ou une sélection orientée (qui favorise le développement d’un caractère au détriment d’un autre) séparent au fil du temps les populations en groupes génétiquement différents : les métallicoles et les non-métallicoles. L’intensité de la sélection par les ETM et la dominance des gènes de la tolérance expliquent que, même en présence de flux de gènes depuis les populations non métallicoles adjacentes, l’évolution vers une différenciation écologique (en deux « écotypes » distincts) se produit rapidement (Lefèbvre & Vernet 1990), ce qui correspond à la troisième étape de la Figure 3.
Cette sélection est très souvent accompagnée d’un isolement reproducteur. Les mécanismes d’isolement reproducteur observés entre les espèces ou les populations incluent une modification de la période de floraison, un changement du régime de reproduction vers l’autofécondation, une altération de la morphologie florale qui affecterait l’attraction et/ou la visite des pollinisateurs.
L’isolement reproducteur entre les deux écotypes peut être total au point qu’ils soient incapables d’échanger des gènes. Une fois que la divergence entre les espèces en formation et l’espèce ancestrale s’accentue, on se situe au cœur de la spéciation et à la formation d’une espèce endémique (quatrième étape de la Figure 3).
Une biodiversité menacée
De par son aptitude à tolérer et accumuler les ETM, la flore métallicole représente une ressource biologique remarquable, à la fois scientifiquement intéressante et précieuse pour de nombreuses applications biotechnologiques. Whiting et al. (2004) parlent même « d’el dorado » de matériel génétique qui pourrait être utilisé dans la décontamination et la restauration écologique de sites contaminés par les ETM.
Par exemple, parmi les plantes métallophytes endémiques des sols riches en cuivre et cobalt en République Démocratique du Congo, citons Faroa chalcophila (Gentianaceae), Crepidorhopalon perennis (Linderniaceae) et Vigna dolomitica (Fabaceae) (cf. photos ci-contre).
Cependant, en plus de contaminer les habitats non métallifères par les poussières métalliques des industries et ainsi d’éroder leur biodiversité, l’exploitation minière menace directement la biodiversité des affleurements qu’elle exploite par l’extraction de minerais en surface (Faucon 2008 ; Faucon et al 2011). Les espèces végétales des affleurements métallifères associées en communautés primaires sont détruites par le remaniement du substrat lors de l’extraction du minerai en surface et ne régénèrent pas dans les zones perturbées. En République Démocratique du Congo, 70 % des taxons (espèces ou genres) métallifères sont en danger critique d’extinction (Faucon et al 2010, Faucon et al 2012). Une situation d’urgence de conservation de la biodiversité des affleurements de roches de cuivre et de cobalt a été déclarée.
L’étude de l’impact de l’exploitation minière sur la biodiversité d’une région de Zambie constitue un bel exemple de conflit direct entre les intérêts économiques à court terme et la conservation de la biodiversité. Hormis les anciens pays industrialisés, peu de pays possèdent un règlement pour la protection et la conservation de la biodiversité des habitats métallifères. Certains ont établi un code minier pour la protection de l’environnement qui contraint les entreprises à réaliser une expertise environnementale évaluant la biodiversité du milieu ; cependant aucun mode de conservation et de gestion de la biodiversité n’est imposé. De plus, la mauvaise gouvernance de nombreux pays laisse libres les entreprises d’exploiter les gisements sans gestion préalablement établie. Seul un certain groupe d’entreprises minières intégrant l’ICMM (International Council on Mining and Metals) essaie de conserver la biodiversité des sites exploités. ICMM a réalisé le « Good Practice Guidance for Mining and Biodiversity » (http://www.icmm.com/), manifeste visant à limiter l’érosion de la biodiversité que provoque l’exploitation minière.
Néanmoins, l’activité minière crée aussi de nouveaux habitats. Il s’agit d’une contamination des sols par les déchets ou les poussières atmosphériques métalliques provenant des industries minières. Ces habitats offrent une large gamme de conditions écologiques et peuvent être colonisés par des espèces adaptées aux milieux ouverts et à la toxicité des métaux. Ils constitueraient une nouvelle opportunité pour l’évolution de certaines espèces des habitats primaires naturellement tolérantes aux métaux.
Bibliographie
- Antonovics J, Bradshaw AD, Turner RG (1971) Heavy metal tolerance in plants. Advances in Ecological Research 7:1–85.
- Baker AJM, Walker PL (1990) Ecophysiology of metal uptake by tolerant plants. In Shaw A.J. (Ed.), Heavy metal tolerance in plants : evolutionnary aspects, CRC Press, Boca Raton, USA : 155-177.
- Duvigneaud P, Denaeyer-De Smet S (1963) Cuivre et végétation au Katanga. Bull Soc Roy Bot Belg 96:92-231.
- Ernst WHO (1974) Schwermetallvegetation der Erde. Fischer Verlag, Stuttgart, 194 p.
- Faucon MP et al. (2012) Ecology and Hybridization Potential of two Sympatric Metallophytes, the Narrow Endemic Crepidorhopalon perennis (Linderniaceae) and its More Widespread Congener C. tenuis. Biotropica, in press. DOI: 10.1111/j.1744-7429.2011.00845.x
- Mahy G, Faucon M-P, Bizoux J-P (2011) Stratégies de conservation de la diversité végétale des sites métallifères: les enseignements de l’écologie des populations de Viola calaminaria. Parcs et Réserves 66: 19-23.
- Faucon MP et al. (2010) Copper endemism in the Congolese flora: A database of copper affinity and conservation value of cuprophytes. Plant Ecology and Evolution 143: 5-20.
- Faucon MP (2008) Conservation du patrimoine biologique du Katanga : Initiation d’un programme de conservation de la biodiversité des affleurements naturels de cuivre. EchoSud 18:6-7.
- Jaffré T (1992) Floristic and ecological diversity of the vegetation on ultramafic rocks in New Caledonia (Eds). by Baker AJM, Proctor J, Reeves RD. Proceedings of the First International Conference on Serpentine Ecology, University of California. Intercept, Hampshire, UK:101-108.
- Kruckeberg AR (1984) California serpentines: Flora, vegetation, geology, soils, and management problems: Berkeley, CA, University of California Press, 180 p.
- Lefèbvre C, Vernet P (1990) Microevolutionary processes on contaminated deposits. In : Heavy metal tolerance in plants : evolutionary aspects (ed. Shaw J.), CRC Press Inc, Boca Raton, 285-300.
- Macnair MR, Gardner M (1998) The evolution of edaphic endemics. In : Endless forms, species and speciation (eds. Howard DJ, Berlocher SH), Oxford University Press, New York 157-171.
- Macnair MR, Tilstone GH, Smith SE (2000) The genetics of metal tolerance and accumulation in higher plants. In : Phytoremediation of Contaminated Soil and Water (eds. Terry N., Banuelos G., Vangronsveld J.), CRC Press, Boca Raton, 235-250.
- Reeves RD, Baker AJM (2000) Metal-accumulating plants. In: Raskin I and Ensley BD (eds) Phytoremediation of toxic metals. Wiley, New York, pp 193-221.
- Tadros TM (1957) Evidence of the presence of an edapho-biotic factor in the problem of serpentine tolerance. Ecology 38:14-23.
- Turner RG (1969) Heavy metal tolerance in plants. In : Ecological Aspects of the Mineral Nutrition of Plants (ed. Rorison IH), Blackwell Scientific Publications, Oxford, 399-410.
- Whiting SN et al. (2004) Research Priorities for Conservation of
- Metallophyte Biodiversity and their Potential for Restoration and Site Remediation. Restoration Ecology 12:106-116.
—— Article édité par Anne Teyssèdre
——





Bonjour,
Vous écrivez : « De manière très caractéristique la croissance des espèces ligneuses (arbres et arbustes) est inhibée, ce qui aboutit au développement de groupements végétaux purement herbacés ou faiblement arbustifs, particulièrement remarquables dans une région forestière. »
Est-ce un cas général ou valable uniquement pour l’exemple mis dans la photo (figure 1) ?
Le cas échéant, existe-t-il une référence attestant de l’inhibition de la croissance des ligneux par les ETM ?
Merci d’avance,
VB
Bonjour,
effectivement les habitats métallifères très riches en métaux présentent très peu d’espèces ligneuses, à l’exception des habitats métallifères riches en nickel tels que les serpentines de Nouvelle Calédonie. Ces derniers sont colonisés par plusieurs espèces ligneuses, par exemple Pycnandra acuminata (Sapotacaea) qui possède un latex coloré par le nickel (Ni) avec une concentration en Ni d’environ 20 % de la matière sèche (cf. L’Huillier et al. 2010 et nombreuses publications de T. Jaffré). Ces espèces ligneuses tropicales sont très souvent associées à un champignon ou à des bactéries; dans cette situation c’est peut être le champignon ou les bactéries qui présentent une capacité à tolérer les métaux ?
Les habitats métallifères peuvent présenter des espèces ligneuses stressées s’exprimant par un port rabougri, par la présence de chlorose (i.e. jaunissement des feuilles),… c’est le cas de nombreux sites européens contaminés par les poussières métalliques des fonderies.
Face à la diversité des habitats métallifères, certains seront colonisés par des essences ligneuses dont la présence pourrait être expliquée par une faible concentration en métal disponible pour les racines des végétaux dans le sol. Certains sols métallifères peuvent présenter une teneur totale élevée en métaux et être peu phytotoxiques étant donné qu’une petite fraction de métaux dans le sol sera disponible pour les plantes.
Cette faible fréquence de ligneux sur les sols extrêmement contaminés par les métaux, et peut être même une faible capacité à tolérer les
métaux, pourraient être expliquées par leur long cycle de vie caractérisé par un âge à maturité sexuel plus élevé que de nombreuses espèces herbacées (inférieur à 1 an pour les espèces annuelles, de 1 à 2 ans pour les bisannuelles et en moyenne quelques années pour les pérennes). En effet, les essences ligneuses présenteraient en général une vitesse de reproduction (nombre de cycles reproductifs ou de générations de descendants sur une période donnée / 10 ans) plus faible que les espèces herbacées. Cette caractéristique reproductive limiterait la possibilité d’une sélection stabilisatrice face à la phytoxicité des métaux. Néanmoins, cette hypothèse qui peut paraître très spéculative reste à démontrer.
Michel-Pierre
Voici quelques références suite à cette discussion :
Godbold DL, Hüttermann A(1985) Effect of zinc, cadmium and mercury on root elongation of Picea abies (Karst.) seedlings, and the significance of these metals to forest die-back. Environ Pollut 38:375–381.
Hagemeyer J.Ecophysiology of plant growth under heavy metal stress.In: Prasad MNV, Hagemeyer J, editors. Heavy metal stress in plants.Fr om molecules to ecosystems Berlin: Springer-Verlag, 1999:157 –181.
Hermle, S., 2004. Reactions of a Young Forest Ecosystem to Heavy Metal Stress in the Soil. PhD thesis No. 15723, Swiss Federal Institute of Technology (ETH) Zurich, pp. 203.
Hermle, S., Gu¨nthardt-Goerg, M.S., Schulin, R., 2006. Effects of metalcontaminated soil on the performance of young trees growing in model ecosystems under field conditions. Environmental Pollution 144:703-714.
Bonjour,
et merci pour cet intéressant exposé. J’aimerais en savoir plus sur l’utilisation de plantes accumulatrices de métaux dans la décontamination des sols et eaux enrichis en ETM (éléments traces métalliques) par les activités humaines. Vous dites que cette méthode (de phytoremédiation) ne marche pas encore avec les sols artificiellement enrichis en Cuivre et en Cobalt, du fait probable d’interactions entre ces éléments métalliques et d’autres éléments chimiques des sols, à déterminer. Est-ce qu’elle est au point pour la décontamination de sols et eaux riches en autres éléments métalliques tels que le Fer, le Nickel ou le Mercure ? (Par ex : A-t-on caractérisé des mélanges d’espèces – ou de génotypes sélectionnés – de plantes accumulatrices de certains métaux, dont les graines peuvent être semées dans les sites contaminés par ces métaux ?)
Dans les cas où cette méthode d’ingénierie écologique fonctionne, quelles sont son efficacité, ses limites, voire les obstacles à sa prise en compte par les pays signataires de la Convention sur la Diversité Biologique (CBD) ?
Bien cordialement, Anne
Bonjour,
L’utilisation de ces plantes dans des procédés de phytoremediation de sols contaminés par les métaux est à l’origine d’un grand nombre d’études scientifiques.
Tout d’abord, quelques définitions afin d’éviter les confusions entre la capacité à accumuler des métaux dans la partie aérienne de la plante et la capacité à phytoremédier un sol riche en métaux. La phytoremédiation est définie comme un procédé qui a pour objectif d’éliminer, contenir ou rendre inoffensifs les contaminants environnementaux présents (dans ce regard, les métaux) dans les sols et les eaux. Elle comprend en partie la phytostabilisation et la phytoextraction.
La phytostabilisation correspond au procédé d’installation de plantes capables de réduire la mobilité et la dispersion des métaux dans l’environnement par ruissellement ou par les vents. Les métaux sont contenus dans le site contaminé par les métaux via l’installation d’un couvert végétal dense et permanent. Cette technique est généralement utilisée dans le traitement des sols sujets à une contamination de nature polymétallique et à des concentrations excessives des métaux dans le sol.
Dans ce procédé de phytostabilisation, on fait généralement recours aux amendements (calcaire et/ou matière organique et/ou oxydes de fer et de manganèse) afin de faciliter l’installation des plantes. Leur utilisation vise à réduire la biodisponibilité des métaux dans le sol. Le choix des plantes et des amendements est déterminant pour la réussite d’un projet de phytostabilisation. En plus d’être tolérantes aux métaux présents dans le site cible, les plantes utilisées en phytostabilisation ne doivent pas accumuler des concentrations élevées de métaux dans leurs parties aériennes car celles-ci peuvent être consommées par des animaux. Un premier essai qui s’est avéré fructueux a été réalisé sur des sols extrêmement contaminés en cuivre en République Démocratique du Congo.
L’objectif de la phytoextraction d’extraire les métaux du sol par leur accumulation dans les parties aériennes des plantes qui sont ensuite fauchées et incinérées. Les métaux récoltés après incinération des plantes peuvent ensuite être valorisés directement en industrie. C’est le cas des métaux hyperraccumulés par Thlaspi caerulescens en culture sur des sols contaminés européens, qui sont utilisés comme catalyseurs de réactions chimiques organiques (cf. projet ANR ECOTECH « GénieEcoChim »). Ce procédé est réalisé en général à partir de véritables hyperaccumulatrices de métaux (Figure 2 du « regard » ci-dessus), capables d’accumuler des teneurs en métaux très élevées dans les feuilles même en présence de faibles teneurs dans le sol.
Dès lors que des teneurs élevées en métaux sont observées dans la partie aérienne des plantes, ces dernières peuvent être exploitées dans la phytoextraction de sols riches en métaux. C’est le cas des plantes hyperaccumulatrices de cuivre et de cobalt dont le mécanisme de tolérance reste à préciser. Néanmoins, le procédé de phytoextraction de sols contaminés en métaux présenterait un faible rendement de dépollution étant donné la faible biomasse des hyperaccumulatrices qui peut être compensé par les teneurs élevées en métaux de ces plantes (par ex., > 10 000 mg de zinc kg-1de matière sèche). Une culture de Thlaspi caerulescens sur un sol extrêmement contaminé en zinc (Zn), installée depuis deux ans, permet d’extraire environ 0,3 à 1 % de la teneur totale en Zn du sol. Il faudrait plusieurs dizaines d’années pour assurer une phytoextraction des métaux des sols contaminés. Néanmoins, ce résultat varie selon les propriétés du sol et peut être amélioré au regard de futures innovations en phytechnologie (par ex., augmentation de la biomasse des hyperaccumulatrices, ….). Actuellement, la phytoextraction de sols contaminés par les métaux aurait un intérêt lorsqu’elle est associée à une valorisation économique des métaux extraits par les plantes.
Par rapport à la phytoextraction, la phytostabilisation est d’avantage utilisée afin de confiner la pollution et éviter le transfert de celle-ci vers les écosystèmes encore sains et/ou vers les zones occupées par les populations humaines. La pollution métallique des sols est généralement limitée spatialement aux alentours des industries métallurgiques, occupant rarement plusieurs centaines d’hectares. Dans cette situation environnementale, la finalité n’est pas de rendre obligatoirement ces sols fertiles mais de limiter les impacts environnementaux sur les terres et les populations humaines présentent à proximité du site pollué.
Il existe une diversité d’espèces végétales tolérantes aux métaux candidates pour la phytoremediation de sols contaminés. Parmi celles-ci, 500 sont capables d’hyperaccumuler des métaux (graphiques 2 et 3 de la figure 2 du regard), dont la majeure partie (environ 450) serait des hyperaccumulatrices de nickel. Les autres espèces hyperaccumulent le zinc, le cadmium, le plomb, le cuivre, le cobalt, le chromium, le thallium, le manganese, le cerium et le lanthanum. Cette capacité à tolérer et accumuler des métaux leur confère une valeur de conservation élevée (Whiting et al. 2004). Pour plus d’information, http://onlinelibrary.wiley.com/doi/10.1111/j.1061-2971.2004.00367.x/full
Bien à vous,
Michel-Pierre
Bonjour, et merci pour cette réponse détaillée !
Question subsidiaire : Est-ce que la phytostabilisation du sol par des plantes accumulatrices peut être utilisée pour le traitement de sols pollués par le Césium 137 et/ou d’autres éléments radioactifs (comme dans la région de Fukushima, après l’accident nucléaire de mars 2011), en complément de l’extraction de la couche superficielle du sol et/ou de son amendement par une solution acide ?
Anne
Bonjour,
c’est un plaisir de discuter sur ce sujet aussi vaste à travers ce débat.
Des études récentes ont été menées à ce sujet, mais d’avantage sur la phytoextraction des radiocésium. En effet, le césium et ses isotopes sont des éléments métalliques mobiles dans le sol et facilement transférables dans la chaîne alimentaire. L’absorption par les plantes est la voie majeure pour la migration du césium radioactif du sol à l’alimentation humaine. Le césium (Cs) est élément essentiel pour les végétaux. Il est absorbé via le même mécanisme d’absorption et de transport dans la plante que le potassium. Il est fort à penser qu’il existe peu de végétaux prélevant une faible concentration de Cs dans le sol et ainsi présentant une faible concentration de Cs dans leur partie aérienne. Dans cette situation écophysiologique et biogéochimique, il est difficile d’envisager des procédés de phytostabilisation de sols contaminés par des radio-césium ou plus particulièrement par le Cs 137.
Néanmoins, des procédés de phytoextraction pourraient être envisagés. Il a été montré que 3 % de Césium 137 d’un sol très contaminé ont été remobilisés dans la partie aérienne de l’amarante à racine rouge (Amaranthus retroflexus L., plante cultivée commune). Les auteurs de l’étude estiment qu’à partir de deux cultures d’amarante par an, la phytoextraction de Césium 137 semblerait faisable en moins de 15 ans (Lasat et al. 1998). Cette même plante pourrait phytoextraire un sol contaminé en strontium-90 en 7 ans (Fuhrmann et al. 2002).
Michel-Pierre
Bonsoir,
Nous sommes un groupe d’étudiantes en deuxième année de biologie.
Nous venons de lire vos commentaires très instructifs, et nous nous intéressons aux phénomènes d’une part de phytorémédiation et d’autre part à ceux d’hyperaccumulation dans les plantes du zinc par exemple.
Pensez vous que l’Anthyllis vulneraria ou bien alors le tabouret bleuâtre puissent s’adapter à une culture en laboratoire en hiver de manière à pouvoir étudier celle ci ?
Et savez vous quelles méthodes sont utilisées quant à la détection et à la quantification du zinc accumulé dans ces plantes?
Merci beaucoup d’avance pour votre réponse qui serait d’une grande aide!
Bonjour,
Ces deux espèces peuvent être cultivées dans des serres chauffées et éclairées. Néanmoins, dans les mises en culture en serre, l’effet de la saison se fait remarquer par une faible germination et croissance des plantes même si la température et l’intensité lumineuse sont contrôlées. En culture en serre sous climat tempéré, il préférable d’initier la culture (le semis) à la fin de l’hiver ou au début de printemps (début mars). SI vous souhaitez développer la culture pendant la période d’hiver, il est nécessaire de la réaliser dans un phytotron ou dans une chambre de culture où tous les paramètres (de culture) sont controlés.
Les concentrations en zinc dans la plante peuvent être analysées par différents spectromètres (spectro d’absorption atomique et émission à flamme, ICP OES, ICP MS) lorsque les minéralisations ont été effectuées par voie sèche (calcination à 500 °C dans des fours et dans des creusets en porcelaine) ou par voie humide (dans de l’acide nitrique et chlorhydrique) en chauffant (plaque chauffante ou TECATOR). Vous trouverez la description de ces méthodes par une simple recherche biblio.
Une autre méthode « Zincon » permet de colorer la solution riche en Zn et de mesurer la concentration en Zn au spectrophotomètre (see Mcnair and Smirnoff 1999, Frérot et al. 2010, http://onlinelibrary.wiley.com/doi/10.1111/j.1469-8137.2010.03295.x/full). Cette méthode est peu onéreuse et utilisée lorsque le nombre d’échantillons à analyser est très élevé.
Bonne continuation
Michel-Pierre Faucon
Bonjour,
J’aimerais savoir dans quels types de sols on rencontre les plantes cuprophytes (c.à.d. accumulatrices de cuivre, note de la modératrice).
Merci pour votre réponse.
Bonjour,
Contrairement à certaines espèces hyperaccumulatrices de zinc et de nickel, les espèces végétales accumulatrices de cuivre se retrouvent strictement sur des sols riches en cuivre (plusieurs milliers de mg Cu par kg de sol.).
L’origine des sols riches en cuivre peut être naturelle (associée à un affleurement de roches en cuivre comme la malachite) ou anthropique (contamination par des déchets miniers ou des poussières atmosphériques issues des fumées des fonderies,…).
Bien cordialement,
Michel-Pierre
Bonsoir,
j’aimerais bien savoir si on peut considérer les métaux lourds comme un gradient de perturbation et/ou un facteur écologique (qui régisse) sur la composition, la structure et le fonctionnement de la végétation métallifère d’une ancienne mine abandonnée sans procéder à des analyses poussées sur la fraction fine de sol. Autrement dit, peut-on se fier seulement aux analyses statistiques appropriées à partir de l’analyse des données du terrain (liste floristique, étude de la diversité fonctionnelle, connaissance de l’écologie des espèces, phytosociologie……etc) ?
je vous remercie d’avance,
bien cordialement
Bonjour,
Le gradient de concentration en métaux lourds dans le sol (des affleurements de roche riche en métaux ou sites miniers) constitue un gradient environnemental.
Selon la nature du gradient de concentrations en métaux lourds dans le sol, c’est-à-dire la nature des métaux lourds et la gamme de variation des concentrations de métaux dans le sol, un gradient de toxicité peut exister et influencer la composition en espèces végétales, la structure des communautés végétales et la variation de traits fonctionnels.
Des analyses statistiques multivariées permettent d’examiner les co-variations entre ce gradient environnemental et la variation floristique et l’association des espèces entre elles.
Je vous invite à lire : Séleck, M., Bizoux, J. P., Colinet, G., Faucon, M. P., Guillaume, A., Meerts, P., … & Mahy, G. (2013). Chemical soil factors influencing plant assemblages along copper-cobalt gradients: implications for conservation and restoration. Plant and soil, 373(1-2), 455-469.
https://www.researchgate.net/publication/250928912_Chemical_soil_factors_influencing_plant_assemblages_along_copper-cobalt_gradients_implications_for_conservation_and_restoration
Bien à vous,
Michel-Pierre