La Société Française d’Ecologie (SFE) vous propose ce regard de Philippe Grandcolas, Directeur de l’Institut de Systématique, Evolution et Biodiversité (ISYEB), sur la biodiversité.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
———-
Un regard de la systématique sur la biodiversité
par Philippe Grandcolas,
Directeur de l’Institut de Systématique, Evolution, Biodiversité (ISYEB), UMR 7205,
Muséum national d’Histoire naturelle, Sorbonne – Universités
Article édité par Anne Teyssèdre
——-
Mots clés : Systématique, phylogénie*, taxonomie, espèces nouvelles, évolution, extinctions,
bio-inspiration, accès aux et partage des ressources
——–
Il y a bien des manières d’apprécier la biodiversité, un concept multi-échelles et à finalités multiples (MacLaurin & Sterelny 2008). Chaque regard porté sur ce concept passe généralement par le prisme d’une discipline scientifique, d’un niveau d’étude ou d’une finalité particulière. Je voudrais pour ma part partager plusieurs réflexions d’ordre général sur la biodiversité qui sont inspirées par l’apport scientifique d’une discipline, la Systématique. L’origine de cette discipline est ancienne et elle reste souvent assimilée dans les esprits aux tâches de description et de classification telles qu’elles étaient pratiquées aux temps des grands naturalistes des XVIIIème et XIXème siècles.
Depuis plus d’un demi-siècle, la Systématique est un acteur majeur de la biologie de l’évolution, en particulier avec l’analyse phylogénétique* apparue à la suite des travaux du systématicien Willi Hennig dans les années 50-60 et qui a diffusé à l’ensemble de la Biologie (O’Hara, 1992). La Systématique se situe dans le domaine de la biologie comparative* : elle compare des organismes et leurs caractères et en tire des conclusions en termes de relations d’apparentement et d’évolution (phylogénies*, homologies*) ; elle établit des diagnoses (taxonomie*). Elle analyse la manière dont les particularités des organismes se sont mises en place et permet d’étudier l’origine de la biodiversité.
Mon but n’est pas de présenter des cas d’études en Systématique mais de mettre en exergue plusieurs points importants que la Systématique peut nous aider à saisir ou à valoriser concernant la biodiversité, et qui s’articulent de manière très intéressante avec ceux mis à jour par les approches écologiques. Cette présentation n’a évidemment pas pour but de promouvoir une discipline pour elle-même mais de provoquer réactions et réflexions par le contraste entre points de vue différents.
Les espèces: toutes différentes
Dans les années 1980, la création du concept de biodiversité et l’avènement de l’analyse phylogénétique* ont permis de réintroduire dans l’esprit de nombreux biologistes un bien très précieux : la notion de diversité en particulier entre les espèces, qui s’était estompée depuis l’essor de la Biologie Générale* au début du XXème siècle (Grandcolas, 2017). En effet, la Biologie Générale* et ce que l’on appelle encore aujourd’hui les Sciences du Vivant (avec des composantes aux doux noms de Biologie des Systèmes* ou de Biologie Intégrative*) sont apparues et se sont développées avec l’idée de rechercher et de définir de grands principes généraux communs à tous les organismes, comme par exemple les « lois de l’hérédité. » C’est aussi à ce moment que sont nés les organismes-modèles* censés représenter à eux seuls des pans entiers du vivant, comme l’arabette Arabidopsis thaliana pour les plantes ou la mouche du vinaigre Drosophila melanogaster pour les insectes.
A partir du moment où l’on se focalise sur les grands principes de constitution ou de fonctionnement supposés communs à tous les organismes, on s’adresse beaucoup moins à leurs différences et à leur diversité. La Biologie Générale contribue donc à l’étude de l’évolution des organismes parce qu’elle met à jour des mécanismes généraux de l’hérédité ou de fonctionnement des organismes. Par contre, elle n’étudie pas ainsi l’Histoire évolutive des différents groupes d’organismes en interaction avec l’environnement, qui est à l’origine de la biodiversité.
Cette « éclipse de l’Histoire » (au sens de l’Histoire évolutive), comme l’ont appelée le systématicien Dan Brooks et l’éthologue Deborah McLennan (1991), s’est donc achevée dans les années 1980 quand la communauté des biologistes a repris conscience de l’importance de la prise en compte des différences entre espèces. A cette époque, le terme de biodiversité a été forgé par Thomas Lovejoy, Walter G. Rosen et Edward Osborne Wilson (Wilson, 1988). L’étude du Vivant s’est ainsi réappropriée non seulement la variation intraspécifique (génétique des populations notamment) et les interactions interspécifiques (écologie) dont l’étude était bien développée depuis le début du XXe siècle mais aussi les différences entre les espèces dont l’étude était moins avancée notamment au plan évolutif.
L’analyse phylogénétique* a été formalisée à la même époque (Wiley, 1981 ; Darlu & Tassy, 1993) avec précisément pour but de retracer les relations de parenté entre espèces et l’origine de leurs différences, ce qui lui a permis de profiter de l’avènement de la biologie moléculaire et de son énorme apport de données pour étudier la biodiversité. De toutes ces manières, les différences entre les espèces sont redevenues un sujet d’analyse de premier plan pour l’ensemble de la communauté des scientifiques étudiant la biodiversité, au lieu que l’on continue à se focaliser sur des lois générales ou sur la variabilité génétique intraspécifique.
Cette prise de conscience que la diversité du Vivant doit être un sujet de préoccupation scientifique et sociétal autant que l’unicité de certains processus dans l’ensemble du Vivant s’est traduite de bien des manières, y compris dans les sciences de la biodiversité. Par exemple, les métriques de la biodiversité ont évolué, notamment grâce à la Systématique. On est passé de l’emploi assez universel de la richesse spécifique(1), une mesure classique en écologie qui traite toutes les espèces d’une communauté vivante (animale, végétale, microbienne..) comme identiques – un tribut à la Biologie Générale du début du XXe siècle(2) – à des métriques plus sophistiquées.
Ainsi Faith (1992) a proposé la diversité phylogénétique (phylogenetic diversity ou PD), une mesure qui prend en compte pour un ensemble d’individus la longueur totale des branches de l’arbre phylogénétique* qui les connectent : elle exprime ainsi la quantité de caractères communs et de différences qui les caractérisent.
(1) Richesse spécifique : Nombre d’espèces constituant une communauté écologique, elle-même définie comme un ensemble d’organismes similaires au plan écologique, partageant un même habitat ou ensemble d’habitats. Communauté d’araignées des prairies alpines par exemple, ou de passereaux d’une forêt (note de l’éditrice).
(2) Mais voir S.P. Hubbell, 2001 : « The Neutral Theory of Biodiversity and Biogeography » (Princeton, USA), modèle nul de dynamique et d’évolution des communautés écologiques permettant de contraster les effets du seul hasard (stochasticité démographique) et de la sélection naturelle dans les assemblages d’espèces, à différentes échelles spatiales (e. au sein de communautés locales, régionales, mondiales) (note de l’éditrice).
La diversité phylogénétique est corrélée à la richesse spécifique : plus on considère d’espèces, plus on augmente le nombre de branches qui relient des individus dans un arbre et donc la somme de leurs longueurs. La PD apporte beaucoup plus d’information qu’une simple somme cardinale. Elle a le grand avantage d’être une mesure potentiellement globale de la diversité génétique et phénotypique* et transcende ainsi les échelles géographiques, régionale ou locale (Veron et al., 2015 ; Pellens & Grandcolas, 2016).
On pourrait citer un autre exemple avec la « méthode comparative » dans sa première version des années 1980 qui se proposait de calculer des relations statistiques de causalité entre des traits ou des environnements. Cette méthode considérait les espèces comme équivalentes là encore et contrôlait simplement pour leur non-indépendance statistique en cas d’apparentement étroit : comparer vingt espèces de rongeurs par exemple, dont dix d’écureuils et dix de souris, revient statistiquement à comparer seulement deux groupes ! Cette méthode a ensuite évolué vers l’analyse phylogénétique* de l’évolution (avec les « comparative phylogenetic methods » modernes) qui compare de multiples histoires évolutives d’espèces considérées d’emblée comme différentes, histoires reconstruites en établissant des éventuelles homologies* (Brooks & McLennan, 1991).
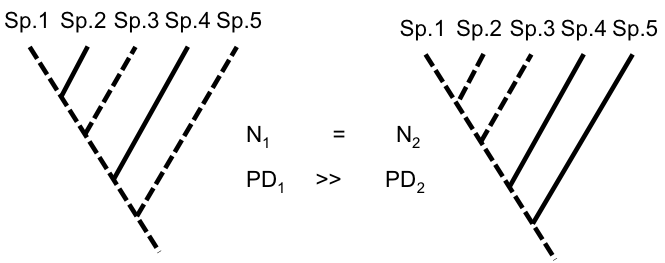
Figure 1. Arbre phylogénétique théorique regroupant 5 espèces, dans lequel on opère deux sélections arbitraires de 3 espèces (traits pointillés). La richesse spécifique (nombre d’espèces) des deux ensembles est la même (N=3) mais la diversité phylogénétique (PD, somme des branches de l’arbre de la racine aux espèces) de la sélection de gauche est beaucoup plus élevée (car la longueur de la branche menant à l’espèce sp.5, groupe-frère du reste de l’arbre, est beaucoup plus longue que celle menant à sp.2, groupe-frère de sp.1). Autrement dit, PD1 (sélection de gauche) incorpore plus d’histoire évolutive que PD2. (sélection de droite).
Et si on étudiait les autres 90%?
Cette prise de conscience salutaire de l’importance de la diversité du Vivant a certainement aidé aussi à prendre pleinement conscience de la catastrophe terrifiante que représente la crise actuelle de la biodiversité. Celle-ci est grave parce que les individus appartenant à différentes espèces représentent des valeurs, des fonctions et des services différents (cf. les regards n°1 et n°4 par exemple): réduire leur nombre et leur diversité équivaut à des pertes directes dans tous ces aspects.

Figure 2. Feuilles et rameau de Ginkgo biloba (Ginkgoales) (cliché P. Grandcolas).
La figure 2 ci-contre montre une espèce relicte (Grandcolas et al., 2014), Ginkgo biloba, seule survivante d’un groupe ancien (270 millions d’années) autrefois très riche en espèces (Haevermans & Haevermans, 2015). Découverte par la botanique occidentale au XVIIIe siècle en Chine, elle est bien connue aujourd’hui comme arbre d’ornement urbain. Personne ne met en doute son caractère unique et l’information qu’elle apporte sur l’évolution des plantes, mais bien peu se rendent compte que le raisonnement implicite à la valeur du Ginkgo est celui de la biologie comparative et de la diversité phylogénétique (cf. figure 1, position de sp.5). Ce raisonnement peut être généralisé à toutes les espèces, même si elles sont moins remarquables que le Ginkgo.
Néanmoins, il y a encore une frontière intellectuelle que la Systématique pourrait nous aider à franchir, je veux parler de comprendre l’importance des 90 % encore inconnus de la biodiversité actuelle. C’est en effet un paradoxe de lire les chiffres alarmants des extinctions malheureusement déjà effectives ou à venir dans quelques décennies (Barnovsky et al., 2011 ; Régnier et al., 2015), calculés d’après ce que nous connaissons (10%) et qui font l’impasse sur ce que nous nous ne connaissons pas (90%). Sans être particulièrement préoccupé du catalogage ou de l’inventaire du Vivant, il faut tout de même reconnaitre que l’échantillon étudié est très réduit. On peut donc se demander s’il est représentatif et ce en regard de beaucoup de questions posées, y compris celle cruciale de la crise d’extinction.
Ainsi, sait-on réellement ce qui va disparaître, et a fortiori quel est le rôle de cette biodiversité disparue avant d’être connue (Régnier et al., 2009) ? Peut-on se satisfaire de la possibilité d’une redondance fonctionnelle vraisemblable et essentielle au fonctionnement des écosystèmes sans savoir vraiment combien d’espèces sont concernées et réellement redondantes ? De ce point de vue, et sachant que les espèces rares peuvent assumer des rôles importants dans les écosystèmes (Mouillot et al., 2013), quelles conséquences graves les extinctions d’espèces rares encore inconnues vont-elles avoir ? Qu’est-ce que les 90% restants de la biodiversité nous apporteraient en termes de connaissances, notamment dans le domaine très actuel du biomimétisme ou de la bioinspiration (Benyus, 2016). Pour mémoire, seulement 76000 sur environ un million d’espèces connues sont aujourd’hui concernées par des brevetages de procédés (Oldham et al., 2013). Qu’en serait-il avec dix fois plus d’espèces connues ?
Face à ce paradoxe – extinction d’un ensemble en grande partie inconnu – la réponse la plus courante est souvent uniquement opérationnelle ou logistique : nous ne connaissons pas assez la biodiversité, qu’à cela ne tienne, utilisons tel ou tel outil ou procédure et d’ici 20 ans, nous aurons substantiellement augmenté notre connaissance (May, 2004 ; Daly, 2012). Cependant, sans pour autant négliger les grands programmes d’exploration de la biodiversité auxquels on ne peut que souscrire avec enthousiasme, il semble surtout important de se rendre compte que nous devrions tous nous saisir du problème de la biodiversité encore inconnue et ne pas le laisser aux seuls programmes d’exploration du Vivant (Systematics Agenda 2000, Barcode of Life, La Planète revisitée, et bientôt Planetary Biodiversity Mission). Un peu comme si la discipline génomique n’avait été bâtie et pratiquée que par les consortiums constitués pour le séquençage des premiers génomes complets.
Cela veut dire qu’il y a une exigence éthique à améliorer et à rendre disponibles les connaissances taxonomiques, exigence que devraient partager tous les scientifiques étudiant la biodiversité. Ne continuons pas à penser en termes de biologie générale, comme si la recherche de la connaissance ne devait se satisfaire que de la quête d’universaux (lois, processus, etc.) Nous devons comprendre que l’augmentation des connaissances sur les particuliers de la biodiversité est un sujet d’étude également primordial (cf. le regard n°23, de Bruno Corbara). A cet égard, les accords de Nagoya (Greiber et al., 2014) et leur implémentation réglementaire nationale sont souvent vus comme une contrainte par les scientifiques, alors qu’ils nous rappellent utilement nos obligations éthiques.
Les laboratoires étudiant la biodiversité doivent former ou héberger des scientifiques compétents en taxonomie, aujourd’hui en voie de disparition (Grandcolas et al., 2012) : il ne suffit pas de barcoder*, métabarcoder (cf. le regard n°50 de T. Decaens et al.), ou databaser, numériser, géolocaliser, etc. des spécimens ou des communautés d’organismes pour sauver une information spécifique à une étude ou utile à la société. Il faut aussi très souvent directement contribuer à la taxonomie, en décrivant ou en révisant des taxons. L’accès et le partage de l’information et de la connaissance dans ce domaine ne sont possibles qu’à travers un système taxonomique avec des spécimens de référence et des noms. Les formidables moyens moléculaires, numériques et informatiques en plein développement ne font que rendre l’établissement de ce lien encore plus crucial (Pellens et al., 2016).
Cet enjeu est notoire dans le cas des micro-organismes dont l’accessibilité est limitée par leur taille et notre capacité de perception. Ceux-ci (bactéries, virus, protistes, champignons, algues, etc.) se révèlent importants à tous égards, y compris par leur omniprésence au sein des autres organismes avec lesquels leur interactions (par exemple, mycorhizes, microbiome intestinal, etc.) sont primordiales (e.g. Selosse, 2017). Dans leur cas, les données moléculaires sont directement intégrées à une taxonomie traditionnelle bien vivante. Néanmoins, au delà des approches de métabarcoding*, la capacité à cultiver les espèces ou à conserver des souches sont des enjeux importants que les laboratoires de microbiologie ont bien compris.
La biodiversité évolue
La conception systématique et comparative de la biodiversité nous rappelle aussi qu’elle est issue d’un long processus évolutif, qu’elle peut être caractérisée phylogénétiquement, y compris au niveau spécifique, et qu’elle n’est pas donnée comme telle, dans une sorte d’abstraction « fixiste » ou plus exactement essentialiste que nous suggérerait notre brève échelle de perception humaine (Robert et al., 2017). Il faut aujourd’hui réconcilier les conceptions dites fonctionnalistes, « micro-évolutionnistes » et « macro-évolutionnistes ».
Il n’y a pas une biologie de l’évolution micro-évolutionniste utile et significative qui regarde les mécanismes populationnels auxquels nous sommes confrontés à notre échelle de temps (quelques années ou quelques décennies), et une autre biologie de l’évolution, macro-évolutionniste, pittoresque et « culturelle », qui traite des fossiles et construit des phylogénies* d’Ornithorynques, Ginkgos et autres Dodos à une échelle de temps – millions d’années – incompatible avec nos existences individuelles. On doit connaître l’origine et le contexte sélectif des caractères phénotypiques* pour pouvoir les étudier et comprendre le phénomène adaptatif au niveau populationnel.
Le grand développement du « tree-thinking » (c’est à dire l’utilisation des arbres phylogénétiques*) en biologie depuis les années 90 nous a ainsi appris qu’une absence de contextualisation macro-évolutive nous faisait souvent construire le modèle explicatif micro-évolutif à l’envers (Brooks & McLennan, 1991). Par exemple, chez certaines araignées, les modèles essayant d’expliquer le dimorphisme sexuel par le nanisme des mâles s’égaraient en ne considérant pas le gigantisme des femelles (Coddington et al., 1997). Ne pas lier les études micro et macro-évolutionnistes reviendrait à jeter toutes les montres qui n’ont pas de trotteuse parce que nous sommes frustrés de ne pas percevoir le mouvement des aiguilles des heures et des minutes en jetant un bref coup d’oeil au cadran. Et pourtant nous avons besoin de lire l’heure.
Cette échelle d’étude macro-évolutive – systématique et phylogénétique – de la biodiversité n’est pas seulement un fondement explicatif indispensable pour mener des études micro-évolutives, elle permet aussi d’évaluer et de percevoir le vivant dans toute sa diversité (cf. par exemple le regard n°40). Encore une fois, la diversité phylogénétique est non seulement une bonne métrique globale mais elle nous permet aussi de porter un regard éthique sur la biodiversité. Dans un arbre phylogénétique*, aucun organisme n’est supérieur à l’autre : Tous les organismes actuels ou fossiles, quoique bien différents, sont des feuilles d’un arbre dont la racine est une abstraction: il n’y a que des groupes-frères au sein d’un arbre (Gregory, 2008; Crisp & Cook, 2005; Grandcolas et al., 2014). Les arbres phylogénétiques* sont donc de bons médias pour expliquer que les raisonnements gradistes* ou anthropocentriques sont absurdes, aussi bien aux scientifiques qu’à tous les publics (Fortin et al., 2009 ; MacDonald & Wiley, 2012).
Les décennies-défi
Nous sommes donc à un moment crucial et paradoxal pour l’étude et la prise en compte de la Biodiversité. Elle n’a jamais été aussi bien connue mais sa plus grande partie reste pourtant encore à découvrir. L’ensemble de cette biodiversité – connue et inconnue – court des risques d’extinction majeure dans les prochaines décennies. Nos moyens pour l’étudier n’ont jamais été aussi puissants mais paradoxalement, l’afflux de données créé par ces moyens est en lui-même un défi pour le partage et l’accès aux connaissances.
Ce défi a également une composante géopolitique forte. La biodiversité est particulièrement importante aux basses latitudes, et l’accès et le partage doivent être non seulement une préoccupation éthique commune à l’ensemble de l’humanité mais aussi un souci de rééquilibrage des connaissances, des expertises et des moyens entre pouvoirs politiques Nord et Sud, afin de partager au mieux l’environnement qui nous est commun à tous.
—-
Glossaire
Barcoding : Méthode d’identification et de délimitation moléculaire des espèces; une petite séquence d’ADN (le plus souvent, Cytochrome oxydase sous-unité I) est utilisée comme marqueur (barcode) spécifique; par extension, le métabarcoding est une approche globale appliquée à un ensemble de fragments d’ADN prélevés ensemble dans un échantillon.
Biologie Comparative : Les approches de la Biologie qui comparent des individus ou des espèces et qui en tirent des conclusions sur l’Histoire évolutive du Vivant.
Biologie des Systèmes : Elle étudie le fonctionnement des systèmes vivants de la cellule au tissu en se focalisant sur des approches, cellulaires et moléculaires.
Biologie Générale : Les approches de la Biologie qui étudient les mécanismes chez un individu ou à une espèce et en tirent des conclusions sur le fonctionnement du Vivant en général.
Biologie Intégrative : Elle intègre les aspects physiologiques et biophysiques dans l’étude du fonctionnement des organismes.
Gradisme : Conception ancienne et fallacieuse, issue de la conception aristotélicienne d’échelle du Vivant; elle considère le vivant comme un gradation de complexité qui serait liée au processus évolutif; l’anthropocentrisme est souvent une forme de gradisme car elle met l’Homme au sommet du grade.
Homologie : hypothèse d’héritage d’un caractère similaire d’un ancêtre commun à plusieurs espèces; elle est validée par une analyse phylogénétique et s’oppose en particulier à la convergence évolutive.
Macro vs micro-évolution : Approches différentes de la biologie de l’évolution, qui mettent respectivement l’accent sur les niveaux d’étude phylogénétiques et populationnelles, avec des échelles de temps contrastées.
Métabarcoding : voir barcoding.
Organismes-modèles : organismes ayant fait l’objet d’un grand nombre études différentes de biologie générale, en particulier au laboratoire ; le haut degré de connaissance acquis et la facilité avec laquelle ils sont manipulés au plan expérimental (maintien en culture au laboratoire, rapidité de développement, etc.) fait qu’ils sont considérés comme des modèles d’étude explicatifs pour de grands pans du vivant.
Phénotype / caractères phénotypiques : Les caractères d’un organisme tels qu’ils résultent de l’interaction entre son génome (génotype) et l’environnement à la suite notamment de son développement.
Phylogénie, arbre ou analyse phylogénétique : Une phylogénie est un arbre de relations de parenté entre individus/espèces; par définition, la construction d’un arbre ne considère en effet pas les relations ancêtres-descendants mais les relations relatives d’apparentement. Deux individus / espèces / taxons sont considérés groupes-frères quand ils sont plus proches parents entre eux que d’un troisième. Les espèces peuvent elles-mêmes être définies phylogénétiquement.
Richesse spécifique : Nombre d’espèces dans une communauté d’organismes (locale, régionale ou mondiale).
Taxonomie : Partie de la Systématique qui a pour but de définir les diagnoses des taxons (descriptions, révisions, etc.) et de proposer une classification, en cohérence avec des règles de nomenclature.
—-
Bibliographie
Barnosky A.D., Matzke N., Tomiya S. et al., 2011. Has the Earth/’s sixth mass extinction already arrived? Nature 471, 51-57.
Benyus J.M., 2016. Biomimétisme: Quand la nature inspire des innovations durables. Rue de l’échiquier, Paris.
Brooks D.R. & D.A. McLennan, 1991. Phylogeny, ecology, and behavior: a research program in comparative biology. The University of Chicago Press, Chicago.
Coddington, J. A., Hormiga, G., Scharff, N. 1997. Giant female or dwarf male spiders? Nature 385, 687-688.
Crisp M.D., Cook L.G., 2005. Do early branching lineages signify ancestral traits? Trends in Ecology & Evolution 20, 122-128.
Daly M., Herendeen P.S., Guralnick R.P., Westneat M.W., McDade L. 2012. Systematics Agenda 2020: The Mission Evolves. Systematic Biology 61, 549-552.
Darlu P. & Tassy P. 1993. La reconstruction phylogénétique. Masson, Paris.
Faith D.P., 1992. Conservation evaluation and phylogenetic diversity. Biological Conservation 61, 1-10.
Fortin C., Lecointre G. & Bénéteau A., 2009. Guide critique de l’évolution. Belin, Paris.
Grandcolas P., Daubin V., Chave J., Kergoat G. J., Samadi, S., Vignes-Lebbe R. 2013. Systématique, Phylogénie. In: Thiébault S. & H. Hadi (Eds.), Prospective de l’Institut Ecologie Environnement du CNRS. Compte-Rendu des Journées des 24 et 25 Octobre 2012, Avignon. CNRS, Paris, pp. 75-78.
Grandcolas P., 2017. Loosing the connection between the observation and the specimen: a by-product of the digital era or a trend inherited from general biology? Bionomina, 12, 57-62.
Grandcolas P., Nattier R. &Trewick S. A., 2014. Relict species: a relict concept? Trends in Ecology & Evolution 29, 655-663.
Greiber T., Moreno S.P., Åhrén M. et al, 2014. Guide explicatif du Protocole de Nagoya sur l’accès et le partage des avantages. IUCN, Gland, Suisse.
Gregory T. R., 2008. Understanding Evolutionary Trees. Evolution: Education and Outreach 1, 121-137.
Haevermans T. & Haevermans A., 2015. L’herbier globe-trotter, 100 plantes extraordinaires du monde et le carnet botanique. Hachette, Paris.
MacDonald T. & Wiley E.O., 2012. Communicating Phylogeny: Evolutionary Tree Diagrams in Museums. Evolution: Education and Outreach 5, 14-28.
Maclaurin, J., Sterelny, K. 2008. What is biodiversity? University of Chicago Press, Chicago.
May, R. M. 2004. Tomorrow’s taxonomy: collecting new species in the field will remain the rate-limiting step. Philosophical Transactions of the Royal Society of London, B 359, 733-734.
Mouillot D., Bellwood D.R., Baraloto C. et al., 2013. Rare Species Support Vulnerable Functions in High-Diversity Ecosystems. PLoS Biology 11, e1001569.
Oldham, P., Hall, S., Forero, O. 2013. Biological Diversity in the Patent System. Plos ONE 8, e78737.
O’Hara, R. J. 1992. Telling the tree: narrative representation and the study of evolutionary history. Biology and Philosophy 7, 135-160.
Pellens, R., Grandcolas, P. (Eds.) 2016. Biodiversity Conservation and Phylogenetic Systematics: preserving our evolutionary heritage in an extinction crisis. Springer Open, 390 p.
Pellens, R., Faith, D. P., Grandcolas, P. 2016. The Future of Phylogenetic Systematics in Conservation Biology: Linking Biodiversity and Society. In: Pellens, R., Grandcolas, P. (Eds.), Biodiversity Conservation and Phylogenetic Systematics: preserving our evolutionary heritage in an extinction crisis. Springer Open, pp. 375-383.
Régnier, C., Achaz, G., Lambert, A., Cowie, R. H., Bouchet, P., Fontaine, B. 2015. Mass extinction in poorly known taxa. Proceedings of the National Academy of Sciences of the USA 112, 7761-7766.
Régnier, C., Fontaine, B., Bouchet, P. 2009. Not Knowing, Not Recording, Not Listing: Numerous Unnoticed Mollusk Extinctions. Conservation Biology 23, 1214-1221.
Robert A., Fontaine C., Veron S et al. 2017. Fixism and conservation science. Conservation Biology, sous presse.
Selosse, M. A. (2017). Jamais seul – Ces microbes qui construisent les plantes, les animaux et les civilisations. Acte Sud, Arles.
Veron, S., Davies, T. J., Cadotte, M. W., Clergeau, P., Pavoine, S. 2017. Predicting loss of evolutionary history: Where are we? Biological Review 92, 271-291.
Wiley, E. O. 1981. Phylogenetics. The theory and practice of phylogenetic systematics. Wiley-Liss, New York.
Wilson, E. O. (Ed.) 1988. Biodiversity. National Academies Press, Washington.
Regards cités
Barbault R., 2010. La biodiversité, concept écologique et affaire planétaire. Regards et débats sur la biodiversité, regard n°1, 10 septembre 2010.
Corbara B., 2011. En quête d’espèces : A quoi servent les expéditions scientifiques ? Regards et débats sur la biodiversité, regard n°23, 3 novembre 2011.
Decaens T, Rougerie R. et D. Porco, 2013. Le barcoding ADN. Regards et débats sur la biodiversité, regard n°50, 15 octobre 2013.
Merceron G. et A. Teyssèdre, 2012 : Regard vers les grands singes du Miocène… et d’aujourd’hui. Regards et débats sur la biodiversité, regard n°40, 31 décembre 2012.
Teyssèdre A., 2010. Les services écosystémiques, notion clé pour explorer et préserver les (socio)écosystèmes. Regards et débats sur la biodiversité, regard n°4, 25 octobre 2010.
—–
Article édité et mis en ligne par Anne Teyssèdre.
——

Bonjour
et merci pour ce regard de systématicien sur la biodiversité, qui souligne de nombreux apports de la systématique à la biologie des organismes, à la phylogénétique et plus largement à la compréhension du Vivant.
Une remarque cependant, renvoyant au constat d’incomplétude des connaissances sur les espèces actuelles et à la question de la représentativité de l’échantillon d’espèces connues. A mon avis, ce ‘regard’ sous-estime la puissance analytique et prédictive des sciences de l’évolution, dont la biologie évolutive et les multiples branches de l’écologie (de l’échelle des individus à celle des écosystèmes et de la biosphère) en particulier.
Si la biologie des organismes permet d’échantillonner le Vivant, de construire des arbres phylogénétiques retraçant l’évolution des espèces et d’explorer les relations écologiques entre espèces connues, la compréhension des mécanismes écologiques et évolutifs en jeu dans la transformation (interactive) des populations, espèces, communautés, réseaux écologiques et écosystèmes, jointe à l’exploration des pressions évolutives actuelles (changements globaux), ainsi que des effets directs et indirects des activités humaines sur ces systèmes écologiques complexes, permet non seulement:
– d’inférer avec un fort degré de certitude un certain nombre de connaissances sur les 90% d’espèces non encore décrites -surtout chez les macroorganismes tels qu’animaux et plantes- puisque, selon la théorie de l’évolution, celles-ci sont toutes plus ou moins apparentées aux 10% d’espèces décrites, et soumises aux mêmes changements globaux;
– mais aussi et surtout, dans une certaine mesure, de modéliser et anticiper les dynamiques de ces systèmes écologiques complexes.
(Suite de ce commentaire: voir ci-dessous.)
(Suite de mon commentaire ci-dessus.)
Par exemple, la connaissance des mécanismes de la sélection naturelle et la théorie de la niche écologique permettent d’anticiper une raréfaction générale (ou adaptation potentielle rapide, pour les espèces à fort taux de multiplication) des espèces spécialistes d’habitats ou conditions de vie en cours de changement, associée à une expansion d’espèces généralistes ou adaptées aux milieux anthropisés; dynamique qui doit se traduire à l’échelle des communautés d’organismes par une homogénéisation biotique fonctionnelle et à l’échelle planétaire par une érosion des espèces de marcro-organismes (e.g., McKinney et Lockwood 1998). Analyse et prédicat vérifiés par des mesures portant nécessairement sur les 10% d’espèces connues! (Cf. par ex. Clavel 2011, Teyssèdre et Robert 2015, et le regard n°16.)
D’un point de vue ‘biologie/écologie de la conservation’, mais aussi dans l’optique d’une ‘transition écologique’ des sociétés, la compréhension des grandes lignes de la dynamique actuelle des espèces et communautés écologiques, face aux actuels changements globaux, me semble nécessaire à l’argumentation des débats et prises de décision en matière de politiques environnementales et d’aménagement du territoire, et une condition à la préservation d’une bonne(?) fraction des espèces actuellement menacées, qu’elles soient connues ou inconnues.
Bref, il me semble que la biologie et l’écologique ‘générales’ – tout comme la systématique 🙂 – sont toujours d’actualité!
Bien cordialement,
Anne
Bonjour
Merci pour ce commentaire qui permet sans doute de clarifier ce que je présentais comme un apport de la Systématique : mesurer combien les espèces sont différentes et pourquoi l’on gagnerait énormément à découvrir plus que les 10% actuels déjà connus.
Bien évidemment, la plupart des analyses écologiques ou systématiques sur la biodiversité que l’on a déjà fait avec ses 10% connus resteront assez certainement valides. Néanmoins, c’est le rôle de la Science que de chercher constamment à les réfuter avec d’autres modèles ou d’autres données et la Systématique aide à cela.
Je soulignais aussi et surtout que découvrir et étudier plus d’espèces nous permettra de réaliser d’autres grandes avancées scientifiques ou sociétales. En effet, si toutes les espèces sont effectivement apparentées et possèdent donc un fond commun, elles acquièrent aussi de très nombreux caractères nouveaux et originaux au cours de l’évolution : c‘est notamment le phénomène de l’adaptation ! Un lot d’espèces donné n’a donc pas forcément les mêmes propriétés explicatives qu’un autre par rapport à telle ou telle question, et ce en regard de leurs caractères phénotypiques d’intérêt potentiellement différents.
Empiriquement, on se rend compte que c’est souvent la prise en compte d’une fraction récemment découverte de la biodiversité qui amène à la formulation de nouveaux modèles explicatifs. C’est le rôle heuristique de l’exploration de la biodiversité : d’autres espèces signifient d’autres caractères ou combinaisons de caractères, parmi lesquels certains peuvent être de remarquables variables explicatives différentes à introduire dans de nouveaux modèles.
On peut citer une multitude d’exemples en ce sens. Ainsi, il y a seulement quelques années, imaginait-on des communautés d’organismes et des réseaux trophiques fonctionnant sans apport d’énergie solaire aux algues ou aux végétaux ? Non bien sûr, et c’est la découverte de bactéries oxydant les composés soufrés des souffleurs sur les dorsales océaniques et permettant l’établissement de réseaux trophiques dans l’obscurité qui l’a permis.
Ou encore, regardons aujourd’hui combien le microbiome change complétement notre vision du fonctionnement des espèces ou des communautés. Si l’inventaire des communautés bactériennes en était resté à ce qu’il était il y a seulement 20 ans, aurait-on les mêmes modèles de fonctionnement écologique ?
Enfin, un dernier exemple, si les Insectes Hyménoptères n’avaient pas été décrits, avec leur détermisme du sexe haplo-diploïde, William Donald Hamilton n’aurait pas pu formuler en 1964 la théorie appelée ultérieurement de la sélection de parentèle. Un modèle original dont les propriétés explicatives se sont inspirées originellement d’un seul groupe d’Insectes.
Tous ces exemples montrent qu’il y a un lien indéfectible entre l’exploration de la diversité du vivant et la construction et le test de modèles explicatifs innovants. Connaitre 10% de la biodiversité ne suffit pas si nous voulons raffiner, renouveler, tester des explications relatifs à une multitude de phénomènes observés !
Il y aussi un autre enjeu qui est peut être moins perceptible si nous nous focalisons sur notre biodiversité ordinaire bien connue en milieu tempéré. La biodiversité encore inconnue est importante non seulement parce qu’elle nous inspire la découverte de nouveaux phénomènes biologiques mais aussi parce qu’elle s’invite dans nos écosystèmes favoris et qu’elle nous pose des problèmes que nous devons résoudre très rapidement (espèces invasives, vectrices, pathogènes, etc.) Mieux vaut connaître un peu cette biodiversité qui s’invite plutôt que d’en être victime dans l’ignorance la plus totale. Si d’obscurs rétrovirus – une fraction alors bien méprisée de la biodiversité – n’avaient pas fait l’objet d’études confidentielles mais innovantes avant 1980, aurait-on pu diagnostiquer l’épidémie HIV et lutter contre elle aussi rapidement ?
Enfin, pour ma part, je n’ai jamais demandé moins de biologie générale … mais plus de biologie comparative, pour un dialogue plus équilibré entre approches scientifiques complémentaires et pour le plus grand bien de la société.
Philippe Grandcolas
Bonjour,
Il me reste tout de même une frustration à la lecture de ce regard. J’aurais bien aimé qu’il sorte de l’entre-soi de la biologie. Il compare les êtres vivants entre eux, dit qu’on peut en tirer grands savoirs, mais il ne les compare pas avec l’inerte.
Personnellement, je pense que l’inerte suit, elle, un développement fixiste, quand le vivant se construit un développement évolutif. Je pense que cela est une différence de nature entre ces deux choses si fondamentales qu’elle en brise même l’idée de nature. Je ne crois donc pas en une continuité de nature entre inerte et vivant. Après tout, la biodiversité n’est rien d’autre qu’un seul objet se multipliant. Cela lui confère tout de go une nature si différente du reste des objets autour d’elle. Il y a ainsi pour moi avec l’apparition de la vie l’apparition du développement (de la multiplication) du vivant aux dépens de l’inerte (et non en harmonie avec).
Est-il possible de savoir ce que la comparaison inerte-vivant inspire à l’auteur de ce regard?
Respectueusement,
Michel
Bonjour
Merci pour votre commentaire. La focalisation sur la biologie était liée à la nature de la rubrique centrée sur la biodiversité. Mais je suis bien d’accord avec vous, il est intéressant d’élargir nos vues à l’ensemble de l’environnement.
La catégorisation ontologique Vivant versus Inerte que vous mentionnez a été l’objet de milliers de contributions ou de discussions, en particulier lorsque l’on tente de comprendre l’origine du Vivant (Malaterre, 2010 ; Maurel, 2017). Comme vous le mentionnez, la possibilité de transmettre des caractères modifiés à d’autres individus – l’évolution biologique – a souvent été considérée comme une caractéristique assez distinctive du Vivant.
Néanmoins, nous portons souvent un regard anthropocentrique sur le Vivant quand nous essayons de le caractériser. Nous considérons implicitement ce dont nous nous sentons proches, à savoir des organismes pluricellulaires bisexués. Si l’on considère les bactéries, les virus ou les viroïdes, le Vivant devient moins facile à circonscrire, avec notamment des modes bactériens de transmission génétique comme transduction, transformation ou conjugaison. Encore plus si l’on porte aussi notre regard sur les molécules organiques ou minérales complexes dans lesquelles certaines conformations physiques acquises peuvent être transmissibles.
Il est donc moins facile qu’on ne pourrait le penser au premier abord de proposer une caractérisation absolument non ambigüe pour Vivant versus Inerte. Doit on dire que le Vivant existe aux dépens de l’Inerte, comme vous le proposez ? Pour moi, les deux sont indissolublement liés dans les écosystèmes et les effets réciproques entre l’un et l’autre sont incessants et considérables. Pensons notamment en ces temps de changement climatique aux rétroactions biosphère – climat, trop souvent négligées et pourtant d’une importance cruciale.
Malaterre, C. (2010). Les origines de la vie: émergence ou explication réductive ? Paris: Hermann.
Maurel, M.C. (2017). Les origines de la vie. Paris : Le Pommier.
Bien cordialement,
Philippe Grandcolas
[Commentaire daté du 26 juillet ]
Bonjour,
Le manque étant si béant dans ce domaine, je pense que les prochaines grandes découvertes, celles qui seront civilisationnelles, nous attendent dans la compréhension de la biodiversité, et moins dans l’exploration spatiale ou technique.
Voilà donc un superbe regard qui affirme que cette véritable compréhension reste grosso modo complètement à faire, qu’elle changera notre éthique ou encore qu’il faudrait appuyer celle-ci aussi sinon plus sur d’autres biodiversités que celles de milieux tempérés ou baignés de lumière douce.
J’aime beaucoup aussi entendre répéter que la « biodiversité évolue » (moi qui pense qu’elle ne se conserve pas, je comprends ici avec mon biais, qu’elle se développe). J’aime aussi (croire) lire qu’elle est de nature historique, à savoir que la micro-évolution se comprend dans la macro-évolution. Tout cela me conforte dans ma pensée que l’homme n’a pas inventé la civilisation mais que ceci est chose naturelle… autrement dit que la biodiversité est civilisation.
Bravo donc pour ce regard!