La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce Regard de Michel Duru, Anthony Fardet et Jean-Pierre Sarthou, chercheurs en agronomie à l’INRAE, sur les microbiotes du sol et de nos intestins.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
——-
Faire des microbes du sol et de notre intestin
des alliés de la santé
Michel Duru (1), Anthony Fardet (2) et Jean-Pierre Sarthou (1)
(1)UMR 1248 AGIR, INRAE, Université Toulouse, INPT, 31326 Castanet Tolosan, France
(2) Unité de nutrition humaine, INRAE, Route de Theix, 63122 Saint-Genès-Champanelle, France
Regard R105, édité par Anne Teyssèdre
—-
Mots-clés : agriculture ; agroécologie ; alimentation ; écosystèmes ; intestin ; microbiotes ; interactions ; écologie fonctionnelle ; santé ; plantes ; rhizosphère ; relations Homme-Nature, services écosystémiques ; ‘une seule santé’.
—–
- (Introduction)
- Les microbes du sol et de l’intestin : de grands oubliés
- Microbiote du sol : facteur essentiel de la santé des plantes
- Microbiote intestinal: facteur essentiel de la santé humaine
- Vers un nouveau paradigme de santé globale
- Glossaire
- Remerciements
- Bibliographie
- Regards connexes
- Forum de discussion sur ce regard
——
Les microbes de notre intestin et du sol jouent un rôle essentiel pour notre santé et celle des plantes : ils fournissent des nutriments d’intérêt et protègent des agressions. Mais nous en sommes loin car les besoins des microorganismes ont été trop longtemps incompris par la science et ils restent dramatiquement oubliés dans les pratiques et les politiques, qu’elles soient agricoles, alimentaires ou sanitaires. Leur prise en compte est fondamentale pour faire face aux enjeux environnementaux et sanitaires. Dans cet article, à partir des similitudes de fonctionnement entre les microbes du sol et de l’intestin ainsi que leur interdépendance via notre alimentation, on tentera de tirer des enseignements pour la prévention de notre santé et celle des écosystèmes.
Les microbes du sol et de l’intestin : de grands oubliés
Nous confions de plus en plus l’entretien de notre santé et de celle des plantes à des produits chimiques (souvent de synthèse), en particulier des biocides : médicaments et pesticides. Si, en France, nous vivons plus longtemps, nous vivons de fait moins longtemps en bonne santé car le nombre de maladies chroniques (obésité, diabète, maladies cardiovasculaires…) augmente, y compris chez les moins de 45 ans. Le niveau d’utilisation des pesticides n’a pas baissé depuis 10 ans malgré des politiques dédiées, les fuites d’azote du sol dans l’eau (nitrates) et dans l’air (protoxyde d’azote, ammoniac) peinent à baisser et de nombreux sols déstockent du carbone (CGDD 2019).
Ces stratégies curatives basées sur l’utilisation de quelques principes bioactifs ne sont pas durables, car réductionnistes et/ou partielles face à la complexité des systèmes considérés. D’une part elles génèrent des externalités négatives sur l’environnement, par le développement i) de résistances chez des bactéries, dans le cas des humains, ou ii) de champignons parasites et insectes phytophages, dans celui des plantes. D’autre part, en affectant les microorganismes au sein des microbiotes* associés aux humains et aux plantes, elles réduisent leur rôle bénéfique respectif sur la santé. Ces microbiotes ne jouent plus alors leur rôle préventif contre les maladies et les ravageurs. Ainsi l’intestin humain et la rhizosphère*, qui entretiennent des interactions complexes avec leur hôte respectif (cf. Encart 1 et Fig. 1 ci-dessous), ne peuvent plus pleinement exercer leurs fonctions, notamment assurer une meilleure résistance aux maladies et une meilleure absorption des nutriments.
Encart 1. Comparaison des microbiotes du sol et de l’intestin
Le microbiote* du sol proche des racines (la rhizosphère) a des effets sur la santé des plantes, et contrôle les flux de gaz ou de particules dans l’hydrosphère et l’atmosphère ; le microbiote intestinal localisé dans le tube digestif, a des effets sur de nombreux organes humains (Hacquart et al 2016).
La rhizosphère* et le mucus de l’intestin correspondent chacun à un compartiment très riche en bactéries, qui sépare pour l’un le sol de l’endosphère (i.e., l’intérieur des racines) et pour l’autre le contenu de l’intestin (ou bol alimentaire) de l’épithélium intestinal. Si, dans ce deuxième cas, le cortège microbien se situe à l’intérieur de l’organe (intestin), dans le premier, il est majoritairement localisé à l’extérieur des racines. Néanmoins, les principes de fonctionnement sont similaires puisque les ressources énergétiques produites par l’hôte (l’intestin ou la racine) sont utilisées par les microorganismes qui se chargent, pour la plupart, d’aider cet hôte à absorber ou excréter d’autres substances.
Chez les humains, les microorganismes de l’intestin sont impliqués dans la récolte et le stockage de l’énergie ainsi que dans les interactions avec le système immunitaire. Le nombre de cellules microbiennes peuplant l’intestin d’un humain est similaire à celui de ses propres cellules, soit environ 4.1013 (Sender et al 2016). Le microbiote intestinal, qui communique avec le cerveau par l’émission de neurotransmetteurs via le nerf vague, est souvent qualifié pour cette raison de second cerveau (Calvani et al 2018). Chez les plantes, les microorganismes ont des effets importants sur la germination des graines, la vigueur des plantules, la nutrition, la croissance des plantes et le développement de leur système immunitaire. La diversité des microbes associés aux racines des plantes est là aussi considérable, de l’ordre de dizaines de milliers d’espèces et entre 108 et 1010 microorganismes par gramme de sol de la rhizosphère. Cette communauté microbienne complexe est d’ailleurs appelée deuxième génome de la plante (Berendsen et al 2012).
Il est maintenant montré que la richesse de ces microbiotes est un indicateur de santé aussi bien pour les plantes (Saleem et al 2019) que pour les humains (García-Montero et al 2021). Dans les deux cas, les déséquilibres causés par des changements d’abondance des espèces microbiennes peuvent provoquer des maladies et une prolifération d’espèces pathogènes (Adam et al 2016).
Dans les deux parties suivantes, nous examinerons successivement les microbiotes du système sol-plante (Fig.1 partie gauche) et de l’intestin (Fig.1 partie droite) pour leurs fonctions (Fig.1 partie supérieure) et pour les facteurs qui les conditionnent (Fig.1 partie inférieure). En dernière partie, nous identifierons les similitudes dans leur fonctionnement puis les relations qui existent entre eux au travers de l’alimentation et de notre contact avec la terre.
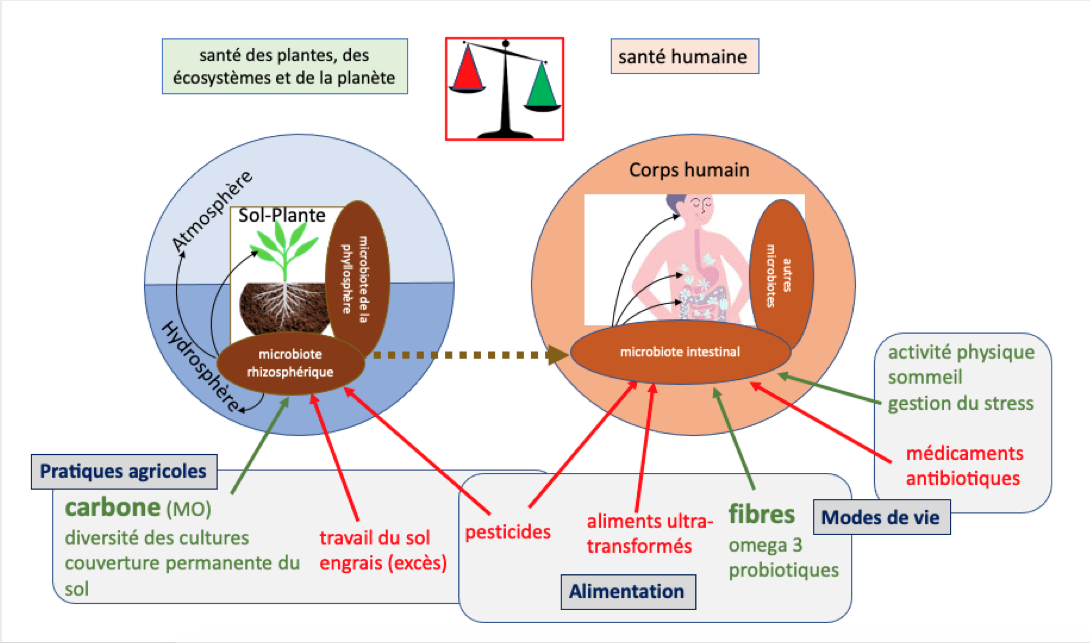
Figure 1 : Schéma des microbiotes du sol (partie gauche) et de l’intestin (partie droite), de leur relation aux autres organes et microbiotes (partie centrale), de leurs effets sur la santé des plantes et des habitats (en haut à gauche) et sur la santé humaine (en haut à droite) (Source : auteurs).
Microbiote du sol : facteur essentiel de la santé des plantes
Rôle bénéfique des microorganismes de la rhizosphère
Le sol est le support d’une grande diversité d’habitats et d’organismes. Il agit comme un accumulateur, un transformateur et un milieu de transfert pour l’eau, le carbone, les radicaux azotés, phosphorés, soufrés, les sels minéraux, ions métalliques… Les microorganismes jouent un rôle clef dans les cycles biogéochimiques des principaux éléments du vivant (C, H, O, N, P, S, ..), qui se déroulent largement au niveau de la rhizosphère.
Les organismes du sol utilisent comme principales ressources énergétiques les exsudats racinaires (environ 20% du carbone issu de la photosynthèse sont exsudés sous forme de sucres liquides) et les résidus de culture. Ces exsudats représentent un « carburant » rapidement et facilement assimilé par de nombreux organismes, qui stimule le développement et la prolifération de ces derniers tout autour de la racine. En retour, les microorganismes stimulent l’exsudation, permettant le développement de véritables chaînes alimentaires avec, comme premiers acteurs, les bactéries (plus rapides à se multiplier) puis les champignons (Jacoby et al 2017). Viennent ensuite les consommateurs de ce premier niveau alimentaire comme les protozoaires, puis les consommateurs secondaires comme les collemboles et acariens, et ainsi de suite.
Rôle de la rhizosphère pour la nutrition des plantes et les cycles biogéochimiques
Les microorganismes participent à la nutrition des plantes. Les mycorhizes par exemple, des champignons filamenteux, permettent de capter l’eau, l’azote, et autres nutriments en explorant le sol au-delà des racines. Ils contribuent à la solubilisation du phosphore, facilitant ainsi son absorption par la plante et à la synthèse de substances de croissance. Dans le cas des légumineuses, des bactéries symbiotiques du genre Rhizobium permettent la fixation de l’azote de l’air à proximité immédiate des racines ; mais il existe aussi une fixation libre de l’azote par des bactéries du sol, du genre Azotobacter entre autres.
Les microorganismes participent aussi à la régulation de la qualité de l’eau, à la rétention et disponibilité des nutriments ainsi qu’à la stabilité structurale du sol (Adhikari et Hartemink 2016). Ils influent aussi sur les budgets globaux de gaz à effet de serre : réduction du changement climatique par stockage du carbone, ou amplification par émission, dans certains cas, de N2O (Paustian et al 2016).
In fine, la biodiversité et les cycles biogéochimiques auxquels ils participent sont des facteurs clefs pour la fourniture de services écosystémiques par les sols (Smith et al 2015).
Rôle de la rhizosphère pour la santé du sol et des plantes
Les microorganismes du sol sont efficaces pour dégrader et détoxifier les composés organiques et inorganiques, appliqués délibérément (pesticides) ou non. Par exemple, certaines souches de Pseudomonas sont capables de dégrader des insecticides neurotoxiques organophosphorés ou carbamates ; des bactéries Rhizobium peuvent dégrader le glyphosate ; des champignons de la pourriture blanche comme Pleurotus ostreatus peuvent dégrader un nombre important de composés organiques récalcitrants.
La diversité des microbes associés aux racines est également cruciale pour la santé des plantes. Les plantes peuvent façonner le microbiome de la rhizosphère. Lors d’une attaque d’agents pathogènes ou d’invertébrés ravageurs, elles peuvent aussi recruter des microorganismes protecteurs spécifiques (Berendsen et al 2012).
Les pratiques qui favorisent la santé des sols doivent généralement leurs effets bénéfiques sur les maladies transmises par le sol au fait qu’elles augmentent l’activité et la diversité de la biomasse microbienne du sol, entraînant un meilleur contrôle biologique des agents pathogènes (Nielsen et al 2015).
Les conditions de pH et d’oxydo-réduction (Eh) des sols influencent l’apparition du phénomène de « suppressivité* » de certains d’entre eux. En agriculture de conservation des sols, la porosité biologique et la complexation de la matière organique avec les argiles créent ainsi des niches à conditions de pH-Eh variées, autorisant l’installation de communautés diversifiées comprenant des espèces antagonistes des pathogènes (Husson et Sarthou 2022).
Microbiote intestinal : facteur essentiel de la santé humaine
Un rôle clé pour le contrôle des inflammations
La plupart des maladies chroniques résultent d’interactions entre hérédité génétique et exposition à l’environnement, notamment via l’alimentation mais aussi l’épigénétique*. Une analyse de 28 maladies chroniques chez des jumeaux monozygotes a révélé que les risques de maladies attribuables à la génétique variaient de 3 à 49 % (médiane de 19 %) (Karlsson et al 2021), pour lesquels le microbiote intestinal joue un rôle clef par ses liens étroits avec le métabolisme et le système immunitaire (Sonnenburg et al 2019).
Une réduction de la diversité du microbiote intestinal est associée au développement des inflammations et à l’augmentation de la porosité de la paroi intestinale (Tasmin et al 2017). La biodiversité intestinale contribue entre autres à réduire les risques de maladies métaboliques (obésité, diabète de type 2, maladies cardiovasculaires), immunologiques (maladies inflammatoires de l’intestin…) et neurologiques, mais aussi à réguler la transmission et la prévalence de plusieurs maladies infectieuses (Sandifer et al 2015).
Idéalement, un état d’équilibre stable du microbiote intestinal sert la santé, si évidemment on lui évite les perturbations qui peuvent le propulser dans un état stable alternatif, un état de pré-maladie, ouvrant la porte au développement de maladies chroniques (Cani et al 2017). Le microbiote fournit aussi une protection antibiotique via ses métabolites, permettant le contrôle des bactéries pathogènes (van de Guchte et al 2018). Les microbes intestinaux possèdent de nombreuses enzymes capables de fermenter des glucides complexes et de générer des métabolites anti-inflammatoires tels que les acides gras à chaîne courte (acétate, butyrate et propionate). Les microbes intestinaux sont également déterminants pour la synthèse de plusieurs vitamines du groupe B et de la vitamine K.
Alimentation et santé : quels facteurs sont-il favorables au microbiote?
Facteurs favorables
Les fibres alimentaires, les oméga 3*, les probiotiques* et les antioxydants* sont les nutriments majeurs qui influencent la diversité et le bon fonctionnement du microbiote (Rinninella et al 2019), (Fig. 1 partie supérieure droite).
Les fibres, dites encore prébiotiques*, sont des composés clés d’origine végétale (complexes glucidiques) qui préservent l’écologie intestinale. Elles interagissent directement avec les microbes intestinaux et conduisent à la production de métabolites clés tels que les acides gras à chaîne courte qui jouent un rôle important tout au long de la vie en protégeant l’organisme contre la détérioration métabolique et en contrôlant l’état inflammatoire.
Les acides gras oméga 3* favorisent aussi la production d’acides gras à chaîne courte, la diversité du microbiote et le maintien de l’intégrité de la paroi intestinale en interagissant avec les cellules immunitaires de l’hôte (Costantini et al 2017). Le non contrôle de l’inflammation par une insuffisance d’oméga-3 peut conduire à des changements neuro-comportementaux (Simopoulos 2020).
Les probiotiques*, présents par exemple dans les aliments fermentés, pourraient avoir un effet bénéfique sur le système immunitaire, les lésions hépatiques, les maladies inflammatoires de l’intestin et le cancer colorectal. Des effets sur la réduction de l’obésité ont pu aussi être montrés par expérimentation, chez des mammifères (souris domestique) et chez l’Homme (Barathikannan et al 2019).
Les antioxydants* tels que les polyphénols, les caroténoïdes et les composés soufrés font partie des constituants susceptibles d’influencer positivement la diversité et le fonctionnement du microbiote. Ils pourraient faire partie d’une stratégie nutritionnelle pour améliorer la santé de patients atteints du syndrome métabolique (Amiot et al 2016).
Facteurs défavorables au microbiote
La composition du microbiote intestinal et l’intégrité de la paroi intestinale peuvent être altérées par certains acides gras, contaminants et additifs (Fig. 1 partie supérieure droite).
Certains acides gras saturés lorsqu’en excès (Marrone et Coccurello 2020), de même qu’un rapport d’acides gras oméga 6/oméga 3 trop élevé (Kaliannan et al 2015), perturbent le fonctionnement de l’écosystème microbien. Les contaminants environnementaux modifient aussi la composition et/ou l’activité métabolique des bactéries gastro-intestinales.
Les pesticides ont une relation dualiste avec le microbiote (Yuan et al 2019). Ils peuvent en perturber la composition et la fonctionnalité mais dans l’autre sens la communauté bactérienne favorise la croissance des souches bactériennes les plus impliquées dans les mécanismes de détoxification de ces composés chimiques (Giambo et al 2021). Or les études épidémiologiques et l’expérimentation montrent un effet sur le microbiote de doses infimes de pesticides, parfois en dessous des limites maximales de résidus (Mostafalou et Abdollahi 2013).
De même, les émulsifiants alimentaires modifient la composition du microbiote et induisent une inflammation chronique de bas grade, conduisant à des dérèglements métaboliques (Holder et al 2019). La consommation d’édulcorants artificiels génère aussi une dysbiose* et des anomalies métaboliques (Suez et al 2015). Des études épidémiologiques montrent une relation entre niveau de consommation d’aliments ultra-transformés qui contiennent ces types d’additifs et la présence de symptômes dépressifs (Adjibade et al 2018) et de désordres gastro-intestinaux (Schnabel et al 2018).
Enfin, certaines nanoparticules présentes dans les aliments et les emballages à effet anti-bactérien pourraient affecter la composition du microbiote, comme cela a été montré pour le dioxyde de titane (Mercier-Bonin et al 2016).
Vers un nouveau paradigme de santé globale
Promouvoir un microbiote diversifié suppose un changement de paradigme tant en agriculture que dans notre alimentation. En effet, il importe de subvenir spécifiquement aux besoins particuliers de ces microorganismes afin d’en faire des alliés pour la santé. Si les humains ont besoin de protéines, lipides et glucides, leur microbiote a, lui, d’abord besoin de fibres, d’oméga-3 et d’antioxydants (Duru 2021). De même, couvrir les besoins des plantes en minéraux, azote et phosphore ne peut pas dispenser de la nécessité d’apporter au sol le carbone qui en nourrira les microbes.
Vers une agriculture régénératrice
La santé du sol étant le pilier d’une agriculture régénératrice, il convient de le « nourrir » par des apports de biomasse riche en carbone et autres éléments minéraux afin de créer les conditions pour une gestion écologique de la nutrition et de la santé des plantes (cf. encart 2)[1]. Une telle agriculture ne peut être réduite au modèle des agricultures biologique ou conventionnelle car le premier facteur limitant de l’activité microbienne est le carbone organique, et non la fertilisation minérale, capable d’augmenter la productivité des plantes. Les approches culturales centrées sur les plantes ont assimilé les déficits en éléments nutritifs des plantes à ceux d’écosystèmes entiers, ignorant ainsi le rôle important des organismes hétérotrophes* responsables de la décomposition des résidus organiques dans le stockage du carbone des écosystèmes, sous forme d’humus riche en éléments nutritifs variés.
Pour intégrer véritablement les cycles du carbone et des éléments nutritifs aux pratiques culturales, il faut donc tenir compte du fait que la productivité secondaire des communautés hétérotrophes est intrinsèquement limitée en carbone (Soong et al 2020). En conséquence, la gestion écologique consiste à conserver ou même à améliorer les pools de nutriments auxquels les plantes peuvent accéder (matière organique et biomasse microbienne) tout en favorisant leur rétention et leur cycle interne. Par ailleurs, la diversité des productions sur un territoire et la réduction de l’utilisation des pesticides sont clefs pour la santé humaine et celle des agroécosystèmes (e.g. Regard R99 de Mony et al.), et sont ainsi des conditions incontournables pour la mise en place d’une agriculture régénératrice.
Encart 2. Le changement de paradigme agricole en pratique
Sur la base de 250 analyses de sol en France, il a été montré que si 32% étaient dans un état satisfaisant, jusqu’à 10% étaient dépréciés en termes d’abondance de microorganismes, le reste ayant un niveau correct mais à surveiller[2].
Une gestion écologique requiert une teneur minimale des sols en matières organiques, elle-même fonction de la teneur en argiles (Johannes et al 2017) ainsi qu’une plage optimale du couple pH-potentiel rédox (Eh) pour la santé des plantes (Husson et al. 2021). Les pratiques de gestion qui favorisent l’abondance et la diversité des communautés microbiennes et de leurs activités sont la culture (dite interculture) de plantes nourricières ou régénératrices des sols (telles que féverole, trèfle, etc…) entre deux cultures de rente ou entre rangs de cultures pérennes[3], la diversité des cultures et les apports de matières organiques. Les facteurs défavorables aux microorganismes sont le travail du sol, notamment pour les mycorhizes, mais aussi les pesticides et les engrais de synthèse (du moins lorsqu’en excès). C’est une des raisons pour lesquelles il faut prioriser les légumineuses pour la fourniture d’azote (voir Regard RO6).
Vers une alimentation préventive
La composition de la diète d’un régime alimentaire recommandé doit prendre en compte non seulement les propriétés nutritionnelles, technologiques, sensorielles et sanitaires des aliments mais aussi la disponibilité des nutriments nécessaires à notre microbiote intestinal. C’est bien d’un changement de paradigme dont il s’agit puisque le microbiote ayant des besoins nutritionnels spécifiques il s’agit de le « nourrir » en répondant à ces besoins (notamment par des apports de fibres, voir plus haut) et d’éviter les facteurs le perturbant (Ercolini et Fogliano 2018). Cela suppose d’agir très en amont de l’alimentation, de l’agriculture à la distribution des produits alimentaires en passant par la transformation des matières premières, pour améliorer l’offre en produits de qualité, mais aussi par l’éducation et la formation pour aider aux choix alimentaires et à la composition des menus. Une telle orientation, préventive pour la santé, nécessite une approche plus holistique de l’alimentation humaine, compte tenu des effets différés d’un état de dysbiose* précocement induit tout au long de la vie (cf. encart 3 ci-dessous).
Encart 3. Le changement de paradigme alimentaire en pratique
Sur la base de plusieurs centaines d’analyses de fèces, il a été montré qu’un quart des personnes en bonne santé, auxquelles il faut ajouter une bonne partie des 11 millions de personnes ayant une affection de longue durée (maladies cardiovasculaires, cancers…., dont 25% pour le seul diabète), ont un microbiote intestinal appauvri et présentent de ce fait un risque élevé de maladies chroniques[4].
Considérer les seuls apports nutritionnels conseillés [à savoir : limiter les aliments et boissons sucrés, salés et gras ; diminuer de 20% les aliments ultra-transformés ; augmenter fruits et légumes, céréales complètes, légumes secs et fruits à coque, ainsi que pain complet, poissons gras, produits bio] est une avancée, mais sans doute encore insuffisante. En effet, il n’est pas encore fixé de limite haute pour les produits ultra-transformés et pour l’ensemble des viandes, et il n’est pas signalé que l’exposition aux résidus de pesticides peut faire problème même si les limites maximales de résidus ne sont pas dépassées.
L’approche de la santé par le microbiote intestinal soutient un régime alimentaire de type « 3V » (Fardet et Rock 2020), soit (Figure 2) :
– régime ‘vrai’ : limiter les aliments ultra-transformés à 15% des calories, au lieu de 34% actuellement en France,
– régime ‘végétalisé : limiter la consommation de viande à 15% des calories au lieu de 36% actuellement, et en privilégiant des produits issus de systèmes herbagers ou d’élevage complémentés en lin ce qui augmente significativement l’apport en oméga 3 (Duru 2019),
– régime varié : diversifier les fruits, légumes, céréales complètes, légumineuses et fruits à coque qui sont une source importante d’apports en fibres diversifiées et en anti-oxydants, en priorisant ceux issus d’une agriculture agroécologique (bio ou autre) de façon à réduire l’exposition aux pesticides.
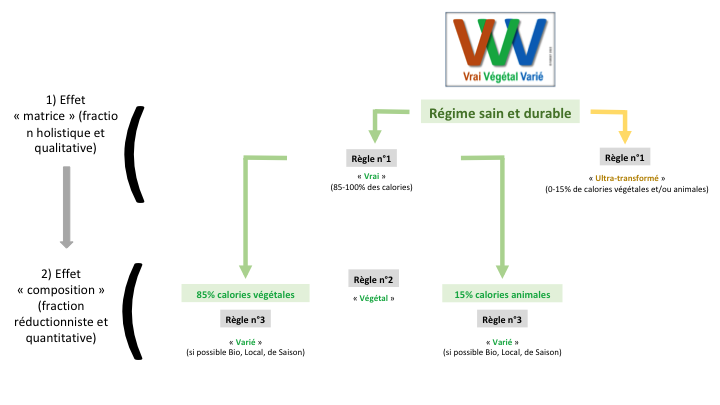
Figure 2
Ce type d’alimentation est à promouvoir à tous les âges de la vie, mais tout particulièrement dès les 1000 premiers jours (de la conception aux deux ans de l’enfant) car c’est durant cette période que se développe le microbiote intestinal et que sa sensibilité aux carences ou aux perturbations est la plus grande (Sommer et al 2017).
Pour une approche holistique restaurant le lien entre santé des écosystèmes et santé humaine
Les rôles interconnectés des microbes dans la santé humaine, animale et végétale devraient être considérés dans le contexte plus large des écosystèmes microbiens qui sont remis en cause par les activités agricoles et industrielles ainsi que par l’urbanisation (Flandroy et al 2018 ; Regard RO9). Agissant directement et indirectement sur la santé des plantes, des animaux, des humains et de l’environnement, les microbiomes du sol sont donc incontournables pour promouvoir les approches « une seule santé » (Banerjee et Heijden, 2022).
Étant donné que des mécanismes similaires stimulent la colonisation microbienne et son bon fonctionnement, dans l’intestin et la rhizosphère, il nous semble légitime de considérer (comme le font Blum et al, 2019) les deux microbiotes comme deux super-organismes qui en outre, et par contact étroit, peuvent se développer en échangeant leurs microorganismes.
Notre alimentation et notre environnement servent de vecteurs de rencontres et d’interactions entre microbiomes. Ils offrent des opportunités d’amélioration par l’acquisition de types microbiens fonctionnellement bénéfiques. C’est pourquoi la biodiversité des sols est de plus en plus reconnue comme clef pour la santé humaine (Wall et al 2015). Le microbiote du sol influe sur la qualité des produits et leur aptitude à la conservation après récolte (Blum et al 2019). Il a ainsi été montré que les pommes issues de l’agriculture biologique présentent une diversité bactérienne significativement plus élevée que celles issues de l’agriculture conventionnelle (Wassermann et al 2019).
De même, le rôle de la biodiversité microbienne du tube digestif est aujourd’hui invoqué dans le développement de maladies comme l’asthme et les allergies. Il est fait l’hypothèse que le contact réduit avec les environnements naturels est associé à un microbiote intestinal moins capable d’éduquer le système immunitaire. Ainsi, le contact avec des bactéries bénéfiques, particulièrement tôt dans la vie, semble être déterminant pour le développement normal des réponses immunitaires. Il a par exemple été montré chez la souris que le contact avec la terre modifie son microbiote intestinal en renforçant la place des bactéroïdes, et que cela permet de réduire le risque d’allergies (Ottman et al. 2019). Les changements dans notre mode de vie et notre alimentation, la destruction des milieux naturels, et l’urbanisation, réduisent notre exposition naturelle à ces bactéries bénéfiques et sont donc susceptibles d’impacter notre physiologie (Ruokolainen et al 2017). En conséquence, grandir dans des environnements riches en microbes, tels que les fermes traditionnelles, peut avoir des effets protecteurs sur la santé des enfants. C’est pourquoi certains chercheurs proposent de « réensauvager » le milieu urbain pour augmenter la diversité microbienne et renforcer le système immunitaire (Mills et Ross 2021).
Tenir compte des rôles des microbiotes pour la santé du vivant suppose d’articuler les approches holistique et réductionniste, la seconde permettant d’approfondir les différents mécanismes de l’ensemble. L’approche holistique est quant à elle nécessaire pour éviter des écueils, tels que : ne pas considérer les besoins spécifiques des microbiotes alors qu’ils assurent un rôle essentiel pour la santé, penser qu’une maladie dépend d’un nutriment ou d’un aliment particulier, et ne pas prendre en compte les coévolutions entre l’hôte et ses microbes. C’est pour ces raisons que des collectifs interdisciplinaires doivent être constitués à la fois dans l’élaboration des politiques publiques et de recherche.
[1] Voir aussi https://www.sfecologie.org/regard/ro9-janv-2020-duru-sarthou-therond/
[2] https://www.youtube.com/watch?v=gyrme0m21Kw
[3] https://dicoagroecologie.fr/encyclopedie/culture-intermediaire/
[4] Dusko Ehrlich dans https://www.arte.tv/fr/videos/080499-000-A/microbiote-les-fabuleux-pouvoirs-du-ventre/
Glossaire
Antioxydant : molécules capables d’interagir sans danger avec les radicaux libres pro-oxydants, avant que les molécules vitales ne soient endommagées.
Dysbiose : déséquilibre de la biodiversité de notre flore intestinale, qui se traduit souvent par une baisse importante du nombre total de bactéries, doublée d’une augmentation des bactéries pathogènes
Epigénétique : changement dans l’activité des gènes n’impliquant pas de modification de la séquence d’ADN et pouvant être transmis lors des divisions cellulaires ; étude de ces changements. Les modifications épigénétiques sont réversibles. https://www.inserm.fr/dossier/epigenetique
Hétérotrophe : organisme qui se nourrit (notamment) de substances organiques, synthétisées par d’autres espèces.
Microbiote : communauté locale d’espèces microbiennes, peuplant un même habitat
Microbiome : ensemble des gènes présents dans un microbiote.
Oméga 3 : famille d’acides gras poly-insaturés à longue chaine qui regroupe des acides gras indispensables, nécessaires au développement et au bon fonctionnement du corps humain, mais que notre corps ne sait pas fabriquer.
Prébiotiques : fibres alimentaires présentes dans les aliments végétaux.
Probiotiques : micro-organismes vivants (bactéries ou levures) présents dans ou ajoutés à certains produits alimentaires.
Rhizosphère : zone d’influence de la racine sur le sol.
Suppressivité : un sol suppressif, ou sol résistant, est un sol dans lequel une maladie fongique ou bactérienne est inhibée ou limitée dans son incidence (phénomène de suppressivité), malgré la présence de facteurs favorables : agents pathogènes, plantes hôtes sensibles et conditions climatiques ou environnementales propices au développement des maladies.
Remerciements
Nous remercions Anne Teyssèdre pour ses lectures attentives et ses nombreuses suggestions, qui ont permis l’amélioration des versions successives de ce texte.
——
Bibliographie
Adam, E., Groenenboom, A. E., Kurm, V., Rajewska, M., Schmidt, R., Tyc, O., … Salles, J. F. (2016). Controlling the microbiome: Microhabitat adjustments for successful biocontrol strategies in soil and human gut. Frontiers in Microbiology, 7(JUL), 1–6.
Adhikari, K., Hartemink, A. E. (2016). Linking soils to ecosystem services – A global review. Geoderma, 262, 101–111. http://doi.org/10.1016/j.geoderma.2015.08.009
Adjibade, M., Lemogne, C., Julia, C., Hercberg, S., Galan, P., Assmann, K. E., Kesse-Guyot, E. (2018). Prospective association between adherence to dietary recommendations and incident depressive symptoms in the French NutriNet-Santé cohort. British Journal of Nutrition, 120(03), 290–300. http://doi.org/10.1017/s0007114518000910
Amiot, M. J., Riva, C., Vinet, A. (2016). Effects of dietary polyphenols on metabolic syndrome features in humans: A systematic review. Obesity Reviews, 17(7), 573–586. http://doi.org/10.1111/obr.12409
Barathikannan, K., Chelliah, R., Rubab, M., Daliri, E. B. M., Elahi, F., Kim, D. H., … Oh, D. H. (2019). Gut microbiome modulation based on probiotic application for anti-obesity: A review on efficacy and validation. Microorganisms, 7(10). http://doi.org/10.3390/microorganisms7100456
Banerjee, S., Heijden, M. G. A. (2022). Soil microbiomes and one health. Nature Reviews Microbiology, 1-15.http://doi.org/10.1038/s41579-022-00779-w
Berendsen, R. L., Pieterse, C. M. J., Bakker, P. A. H. M. (2012). The rhizosphere microbiome and plant health. Trends in Plant Science, 17(8), 478–486. http://doi.org/10.1016/j.tplants.2012.04.001
Blum, W. E. H., Zechmeister-boltenstern, S., & Keiblinger, K. M. (2019). Does Soil Contribute to the Human Gut Microbiome ? Microorganisms.
Calvani, R., Picca, A., Lo Monaco, M. R., Landi, F., Bernabei, R., & Marzetti, E. (2018). Of Microbes and Minds: A Narrative Review on the Second Brain Aging. Frontiers in Medicine, 5(March), 1–11. http://doi.org/10.3389/fmed.2018.00053
Cani PD. (2017). Gut microbiota — at the intersection of eve- rything? Nat Rev Gastroenterol Hepatol 14(6): 321—2, http://dx.doi.org/10.1038/nrgastro.2017.5.
CGDD. (2019). Commissariat général au développement durable, 2019. Rapport de synthèse, L’environnement en France, La Documentation Fraçaise (ed.).
Costantini, L., Molinari, R., Farinon, B., & Merendino, N. (2017). Impact of omega-3 fatty acids on the gut microbiota. International Journal of Molecular Sciences, 18(12). http://doi.org/10.3390/ijms18122645
Duru, M. (2019). Agri-food choices for health: the case of fatty acids. OCL – Oleagineux Corps Gras Lipides.
Duru, M. (2021). Microbiote intestinal et santé : une nécessaire refonte de notre système agri-alimentaire. Cahiers de Nutrition et de Diététique.
Flandroy, L., Poutahidis, T., Berg, G., Clarke, G., Dao, M. C., Decaestecker, E., … Rook, G. (2018). The impact of human activities and lifestyles on the interlinked microbiota and health of humans and of ecosystems. Science of the Total Environment, 627, 1018–1038. http://doi.org/10.1016/j.scitotenv.2018.01.28
García-Montero C, Fraile-Martínez O, Gómez-Lahoz AM, et al (2021). Nutritional Components in Western Diet Versus Mediterranean Diet at the Gut Microbiota–Immune System Interplay. Implications for Health and Disease. Nutrients 13 (2):699
Giambò, F., Teodoro, M., Costa, C., & Fenga, C. (2021). Toxicology and microbiota: How do pesticides influence gut microbiota? a review. International Journal of Environmental Research and Public Health, 18(11). http://doi.org/10.3390/ijerph18115510
Hacquard, S., Garrido-Oter, R., González, A., Spaepen, S., Ackermann, G., Lebeis, S., … Schulze-Lefert, P. (2015). Microbiota and host nutrition across plant and animal kingdoms. Cell Host and Microbe, 17(5), 603–616. http://doi.org/10.1016/j.chom.2015.04.009
Holder, M. K., Peters, N. V., Whylings, J., Fields, C. T., Gewirtz, A. T., Chassaing, B., de Vries, G. J. (2019). Dietary emulsifiers consumption alters anxiety-like and social-related behaviors in mice in a sex-dependent manner. Scientific Reports, 9(1), 1–14. http://doi.org/10.1038/s41598-018-36890-3
Husson, O. Sarthou J.P. (2022). Potentiels hydrogène et redox, et fonctionnement des systèmes cultivés en agriculture de conservation des sols, in Agriculture de Conservation des Sols, Ed. QUAE (sous-presse).
Jacoby, R., Peukert, M., Succurro, A., Koprivova, A., & Kopriva, S. (2017). The Role of Soil Microorganisms in Plant Mineral Nutrition—Current Knowledge and Future Directions. Frontiers in Plant Science, 8(September), 1–19. http://doi.org/10.3389/fpls.2017.01617
Kaliannan, K., Li, X. Y., Wang, B., Pan, Q., Chen, C. Y., Hao, L., … Kang, J. X. (2019). Multi-omic analysis in transgenic mice implicates omega-6/omega-3 fatty acid imbalance as a risk factor for chronic disease. Communications Biology, 2(1). http://doi.org/10.1038/s42003-019-0521-4
Karlsson, O., Rocklöv, J., Lehoux, A. P., Bergquist, J., Rutgersson, A., Blunt, M. J., Birnbaum, L. S. (2020). The human exposome and health in the Anthropocene. International Journal Of Epidemiology, 1–12. http://doi.org/10.1093/ije/dyaa231
Marrone, M. C., & Coccurello, R. (2020). Dietary fatty acids and microbiota-brain communication in neuropsychiatric diseases. Biomolecules, 10(1). http://doi.org/10.3390/biom10010012
Mercier-Bonin M, Despax B, Raynaud P, Houdeau E, Thomas M. (2016). Exposition orale et devenir dans l’intestin des nanoparticules alimentaires: exemple de l’argent et du dioxyde de titane. Cahiers de Nutrition et de Diététique ;51(4):195—203.
Mills, S., & Ross, R. P. (2021). Colliding and interacting microbiomes and microbial communities‐consequences for human health. Environmental Microbiology.
Mostafalou, S., & Abdollahi, M. (2013). Pesticides and human chronic diseases: Evidences, mechanisms, and perspectives. Toxicology and Applied Pharmacology, 268(2), 157–177. http://doi.org/10.1016/j.taap.2013.01.025
Nielsen, U. N., Wall, D. H., & Six, J. (2015). Soil Biodiversity and the Environment. Annual Review of Environment and Resources, 40(1), 63–90.
Ottman, N., Ruokolainen, L., Suomalainen, A., Sinkko, H., Karisola, P., Lehtimäki, J., … Fyhrquist, N. (2019). Soil exposure modifies the gut microbiota and supports immune tolerance in a mouse model. Journal of Allergy and Clinical Immunology, 143(3), 1198–1206.e12. http://doi.org/10.1016/j.jaci.2018.06.024
Paustian, K., Lehmann, J., Ogle, S., Reay, D., Robertson, G. P., Smith, P. (2016). Climate-smart soils. Nature, 532(7597), 49–57. http://doi.org/10.1038/nature17174
Rinninella E, Cintoni M, Raoul P, Lopetuso LR, Scaldaferri F, Pulcini G, et et al. (2019)Food components and dietary habits: Keys for a healthy gut microbiota composition. Nutrients 2019; 11(10).
Ruokolainen, L., Lehtimäki, J., Karkman, A., Haahtela, T., Hertzen, L. von, Fyhrquist, N. (2017). Holistic View on Health: Two Protective Layers of Biodiversity. Annales Zoologici Fennici, 54(1-4), 39–49. http://doi.org/10.5735/086.054.0106
Saleem, M., Hu, J., & Jousset, A. (2019). More Than the Sum of Its Parts: Microbiome Biodiversity as a Driver of Plant Growth and Soil Health. Annual Review of Ecology, Evolution, and Systematics, 50(1), 1–24. http://doi.org/10.1146/annurev-ecolsys-110617-062605
Sandifer, P. a., Sutton-Grier, A. E., Ward, B. P. (2015). Exploring connections among nature, biodiversity, ecosystem services, and human health and well-being: Opportunities to enhance health and biodiversity conservation. Ecosystem Services, 12, 1–15. http://doi.org/10.1016/j.ecoser.2014.12.007
Schnabel L, Buscail C, Sabate JM, Bouchoucha M, Kesse-Guyot E, Allès B, et al. (2018). Association between ultra-processed food consumption and functional gastrointestinal disorders: results from the French NutriNet-Santé cohort. Official journal ofthe American College of Gastroenterology|:1217—28, http://dx.doi.org/10.1038/s41395-018-0137-1.
Sender, R., Fuchs, S., & Milo, R. (2016). Revised estimates for the number of human and bacteria cells in the body. PLoS biology, 14(8), e1002533.
Simopoulos A (2020). Omega-6 and omega-3 fatty acids: Endocannabinoids, genetics and obesity. Ocl, 27, 7. http://doi.org/10.1051/ocl/2019046
Smith, P., Cotrufo, M. F., Rumpel, C., Paustian, K., Kuikman, P. J., Elliott, J. A., … Scholes, M. C. (2015). Biogeochemical cycles and biodiversity as key drivers of. Soil, 1, 665–685. http://doi.org/10.5194/soil-1-665-2015
Sommer, F., Anderson, J. M., Bharti, R., Raes, J., & Rosenstiel, P. (2017). The resilience of the intestinal microbiota influences health and disease. Nature Reviews Microbiology, 15(10), 630–638. http://doi.org/10.1038/nrmicro.2017.58
Soong, J. L., Fuchslueger, L., Marañon-Jimenez, S., Torn, M. S., Janssens, I. A., Penuelas, J., Richter, A. (2020). Microbial carbon limitation: The need for integrating microorganisms into our understanding of ecosystem carbon cycling. Global Change Biology, 26(4), 1953–1961. http://doi.org/10.1111/gcb.14962
Suez, J., Korem, T., Zeevi, D., Zilberman-Schapira, G., Thaiss, C. A., Maza, O., … Elinav, E. (2014). Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature, 514(7521), 181–186. http://doi.org/10.1038/nature13793
Tasnim, N., Abulizi, N., Pither, J., Hart, M. M., Gibson, D. L. (2017). Linking the gut microbial ecosystem with the environment: Does gut health depend on where we live? Frontiers in Microbiology, 8(OCT), 1–8.
van de Guchte, M., Blottière, H. M., Doré, J. (2018). Humans as holobionts: implications for prevention and therapy. Microbiome, 6(1), 81. http://doi.org/10.1186/s40168-018-0466-8
Wall, D. H., Nielsen, U. N., & Six, J. (2015). Perspective Soil biodiversity and human health. Nature, 528, 69–76.
Wassermann, B., Müller, H., Berg, G. (2019). An Apple a Day: Which Bacteria Do We Eat With Organic and Conventional Apples? Frontiers in Microbiology, 10(July), 1–13. http://doi.org/10.3389/fmicb.2019.01629
Yuan, X., Pan, Z., Jin, C., Ni, Y., Fu, Z., Jin, Y. (2019). Gut microbiota: An underestimated and unintended recipient for pesticide-induced toxicity. Chemosphere, 227, 425–434. http://doi.org/10.1016/j.chemosphere.2019.04.088
Regards connexes :
Regards sur l’agriculture : https://sfecologie.org/tag/agriculture/
Regards sur les sols : https://sfecologie.org/tag/sols/
Sur le fonctionnement des écosystèmes : https://sfecologie.org/tag/fonctionnement/
Sur écologie, biodiversité et santé : https://sfecologie.org/tag/sante/
Sur les relations Homme-Nature : https://sfecologie.org/tag/relation-homme-nature/
Sur la préservation de la biodiversité : https://sfecologie.org/tag/preservation-biodiversite/
Sur les services écosystémiques : https://sfecologie.org/tag/services-ecosystemiques/
—–
Regard édité et mis en ligne par Anne Teyssèdre.
——-

Un parallèle fort instructif entre santé du sol et santé du corps humain, montrant dans les deux cas l’importance de prendre en compte l’intégralité des interactions entre organismes, loin des approches réductionnistes malheureusement encore couramment prônées (et couronnées) dans les sciences de la vie. Un plaidoyer aussi contre la malbouffe qui a conduit aux mêmes effets pervers tant dans notre alimentation que dans les pratiques agricoles qui lui sont associées.
Merci pour cet article passionnant qui contribue à expliciter les continuités vivantes entre microbiotes végétaux et microbiotes animaux, d’une part, et entre microbiotes du sol et microbiotes d’entités vivantes terrestres présentant un haut niveau d’organisation, d’autre part.
Pour autant, le terme holobionte n’apparaît pas dans le texte, et n’est présent que dans une référence bibliographique.
Serait-ce donc un terme que les auteurs préfèrent éviter, alors qu’il est pourtant utilisé à l’INRAE, par exemple dans le programme transversal HOLOFLUX : « Holobiontes et flux microbiens au sein des systèmes agri-alimentaires » ? Auraient-ils des réticences à utiliser ce vocable ? Si oui, j’aimerais en connaître les raisons épistémologiques car je pressens qu’elles sont parfaitement fondées et que l’évitement de ce terme est voulu.
Mais qu’en est-il ?
Votre remarque est tout à fait justifiée. C’est peut-être une lacune de n’avoir pas introduit le concept d’holobionte dans cet article. Plus précisément, c’était peut-être une erreur de ne pas augmenter le nombre de concepts introduits et de privilégier l’analyse des relations entre microbiomes et pratiques agricoles et alimentaires.
Bonjour,
Merci pour cet article faisant un parallèle intéressant et instructif entre les communautés microbiennes de la rhizosphère et celle de l’intestin humain. Le commentaire ci-dessous ne s’adresse qu’à un point de terminologie qu’il me semble important de régler afin de ne pas entretenir de confusion. Nous avons intérêt à ce que les mots recouvrent des réalités aussi précises et non ambigues que possible et partagées par tous. Et donc je pense qu’il faudrait arrêter d’employer de manière incorrecte le terme de microbiote:
Dans les néologismes forgés et utilisés depuis le XIXe siècle, les termes en …ote désignent des objets biologiques individualisés (zygote, mastigote, symbiote, progénote, …) tandis que le suffixe …ome s’applique à des ensembles d’objets possédant certaines caractéristiques communes (génome, biome, transcriptome,…). L’ensemble des microbes (ou microorganismes) présents à un emplacement donné (par exemple dans la rhizosphère des plantes) constitue un microbiome (voir d’ailleurs le titre de la revue éponyme internationale « Microbiome » qui s’intéresse à tous les aspects de la biologie des communautés de microorganismes et pas seulement à leurs génomes) et non un microbiote. Un microbiote serait un individu parmi d’autres constituants d’un microbiome, donc un microbe. Puisque le mot existe déjà pas besoin donc d’en inventer un autre…
On peut d’ailleurs penser que cette volonté « d’individualiser » le microbiome en utilisant le terme microbiote correspond à une tentative de créer un nouveau paradigme: celui de l’autonomie réelle ou supposée d’une entité réagissant presque comme si c’était un organisme à part entière, donc un « …ote », tel que cela transparait par exemple dans l’image à laquelle vous faites référence du « deuxième cerveau » chez les vertébrés. Or nous savons que toutes les communautés microbiennes contiennent en général une grande diversité de microbes, avec des lignées plus ou moins ubiquistes et d’autres plus ou moins spécifiques, et que nombre de ces lignées sortent ou rentrent dans le microbiome au gré de fluctuations environnementales (au sens large) comme vous le décrivez justement dans ce regard. Les microbiomes sont donc des ensembles flous qui ne justifient probablement pas qu’on leur attribue plus d’autonomie qu’ils n’en ont…
Bonjour,
Merci pour cette précision et recommandation. Effectivement le terme « microbiome » est plus rigoureux. Nous aurions dû l’utiliser dans cet article, mais le premier auteur que je suis s’est laissé embarqué par la facilité de la communication auprès du « grand public ». Parler de microbiome suppose un petit temps d’explication supplémentaire. Mais cela aurait effectivement été souhaitable et possible pour les lecteurs de la revue Regards !
Bonjour,
Désolée de répondre si tard (mais en 2022!) à cet échange sur la pertinence ou non du terme ‘microbiote’ (versus ‘microbiome’) dans ce Regard, mais bien que ce point de terminologie ne me semble pas très important, j’aimerais signaler que je ne suis pas trop d’accord avec la critique de François.
Je reconnais avec François que le terme ou radical ‘biote’ s’applique à des organismes (au sens biologique d’êtres vivants), et non pas à des écosystèmes par exemple, mais pas nécessairement en unique exemplaire: il peut aussi renvoyer à une communauté écologique ou un réseau d’organismes, en interaction dans un habitat. Selon cette définition, le terme microbiote renvoie à une communauté ou un réseau de microorganismes (bactéries, champignons, protistes..) en interaction, dans le tube digestif d’un animal par exemple (microbiote intestinal), ou dans le sol en relation notamment avec les racines de plantes (« microbiote du sol »). Et bien que les microorganismes membres de ces réseaux coévoluent avec leur ‘hôte’ ou leurs partenaires écologiques (ex: plantes) au fil du temps, leur comportement n’est pas pour autant univoque (voir par exemple le Regard R85).
Le terme ‘biome’ en revanche se réfère à l’écosystème dominant d’une région (géographique ou non) caractérisée par ses paramètres physiques : température, pH, humidité, teneurs et flux d’éléments chimiques, … Pour les grands biomes terrestres, ce peut être la forêt tropicale, la taïga, la savane ou la toundra, qui comportent des communautés de plantes/arbres, d’animaux et de microorganismes en interaction dans leur habitat + les caractéristiques physiques de leur biotope. De même, un microbiome renvoie -sauf erreur de ma part- à l’écosystème formé par une communauté de microorganismes (= microbiote) ET son habitat, dont les enzymes/sucs digestifs et toutes les composantes du « bol alimentaire » en voie de digestion. Le microbiome intestinal désigne donc (à mon avis) l’écosystème endo-intestinal -ou l’ensemble des écosystèmes du tube digestif- d’un individu, comprenant microbiote intestinal + habitat physique et biochimique intestinal (et donc conditions de vie locales pour les microorganismes).
Bon réveillon à tous, et à vos microbiotes intestinaux !
Anne
Merci Anne pour cette réponse précise et bien documentée à laquelle je souscris, sachant que ce n’est pas un point fondamental par rapport au message principal de l’article sur lequel il importerait de poursuivre les échanges !