La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce Regard d’Anne Teyssèdre, écologue et médiatrice scientifique interdisciplinaire, sur les impacts de l’agriculture sur la biodiversité et le fonctionnement des (socio)écosystèmes.
Une version légèrement différente de ce Regard paraîtra bientôt dans la section ‘Vivant’ de l’Encyclopédie de l’Environnement, à cette adresse web.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
Quels impacts de l’agriculture sur la biodiversité
et le fonctionnement des écosystèmes ?
.
Anne Teyssèdre,
écologue, chargée de médiation scientifique interdisciplinaire à la SFE2
et à l’Institut de la Transition Environnementale (ITE, Sorbonne Université)
Regard R103, édité par François Massol
—-
Mots-clés : Agriculture, biodiversité, changements globaux, agrosystèmes, écosystèmes, interactions, structure, fonctionnement, impacts, enjeux, biosphère
- Introduction : le paradoxe d’Ouroboros
- Impacts sur la biomasse végétale et la productivité des écosystèmes terrestres
- Capacité d’accueil des habitats, abondance des communautés d’espèces sauvages
- Composition des communautés d’espèces sauvages
- Impact sur les nombres d’espèces locales
- Impact sur la biodiversité mondiale, en nombre d’espèces
- Impacts sur la structure et la complexité des réseaux écologiques
- Impacts sur la stabilité des agrosystèmes
- Impacts sur le fonctionnement des écosystèmes
- Conclusion : quel futur pour Ouroboros ?
- Encart
- Focus n°1 : Quatre grands facteurs d’impact agricole
- Focus n°2 : Impact de l’agriculture sur les proportions d’espèces sauvages et domestiques
- Remerciements
- Bibliographie
- Regards connexes
- Forum de discussion sur ce Regard
—–
Introduction : le paradoxe d’Ouroboros
Dans l’ancienne Egypte, il y a plus de 3500 ans, tombeaux et papyrus étaient souvent ornés d’un serpent qui se mord la queue, formant une boucle circulaire (Fig.1).
Désigné plus tard par les grecs du nom d’Ouroboros –littéralement, ‘qui dévore sa queue’-, cet animal mythique a longtemps symbolisé -ou symbolise toujours- le cycle du temps, l’éternel renouveau, mais aussi la dualité du monde, pour des cultures aussi diverses que les civilisations égyptienne, phénicienne, grecque, nordiques, voire aztèque…

Fig 1 : Représentation d’Ouroboros sur le sarcophage de Toutankhamon, Musée archéologique du Caire.
Source : Djehouty, CC BY-SA 4.0.
Ouroboros symbolise aussi l’idée de paradoxe, ou d’action impossible, parce qu’il se nourrit de lui-même. Et dans la langue française actuelle, l’expression « un serpent qui se mord la queue » désigne un cercle vicieux, « une succession de problèmes dont on ne voit pas la fin ». Ce paradoxe d’Ouroboros semble s’appliquer aujourd’hui aux sociétés humaines confrontées à l’agriculture, tout à la fois nourricière et destructrice.
Depuis ses débuts –sur plusieurs continents– au Néolithique, l’expansion de l’agriculture s’est accompagnée d’innovations techniques qui ont progressivement augmenté les rendements agricoles et permis la croissance de la population humaine mondiale au fil des siècles, semblant repousser indéfiniment les limites de productivité des agrosystèmes et de la biosphère.
Aux trois facteurs de développement de l’agriculture que sont i) son expansion spatiale, ii) les progrès techniques des pratiques agricoles et iii) la sélection-domestication de populations animales et végétales plus productives, s’est ajoutée iv) la transformation progressive puis mondialisation des systèmes agroalimentaires, et donc des chaînes marchandes associées à l’agriculture. Cependant, s’exerçant sur des socio-écosystèmes dynamiques, formés de multiples espèces (dont des humains) en interaction dans leur milieux de vie, ces facteurs de développement et évolution de l’agriculture sont tout autant de pressions –ou facteurs d’impact– sur ces systèmes (voir le focus n°1), qui interagissent dans une dynamique/spirale ‘ouroborienne’.
Où en est aujourd’hui cette dynamique ? Peut-on prendre la mesure des impacts de l’agriculture sur la biodiversité et les sociétés humaines qui en dépendent, à l’échelle mondiale ? Quels enseignements peut-on en tirer pour le futur ?
Dans cet article, nous explorerons les impacts (écologiques) directs de cette dynamique de l’agriculture sur la biodiversité et le fonctionnement des écosystèmes. D’ores et déjà, soulignons que l’on peut schématiquement décrire cette dynamique comme un détournement de la productivité primaire (végétale) des écosystèmes terrestres et une transformation massive des habitats de notre biosphère, au profit -discutable- de quelques espèces…
Biomasse végétale et productivité des écosystèmes terrestres
Pour croître et se reproduire, tout être vivant requiert matière et énergie qu’il puise dans son environnement, c’est-à-dire dans l’écosystème auquel il participe. A l’instar de tous les animaux et champignons, nombre d’espèces se nourrissent de matière vivante (issue de proies, feuilles, …) ou de composés organiques synthétisés par d’autres organismes (ex : le nectar des fleurs, pour les abeilles), qui partagent son habitat. Mais l’activité de ces espèces dites « hétérotrophes » serait impossible sans la présence à la base des réseaux trophiques d’organismes dits « autotrophes » qui, telles les plantes, algues, cyanobactéries (photosynthétiques) et chimiobactéries, sont capables de synthétiser des molécules organiques à partir de composés minéraux et d’énergie, lumineuse ou chimique (cf. fig.2 a et b).
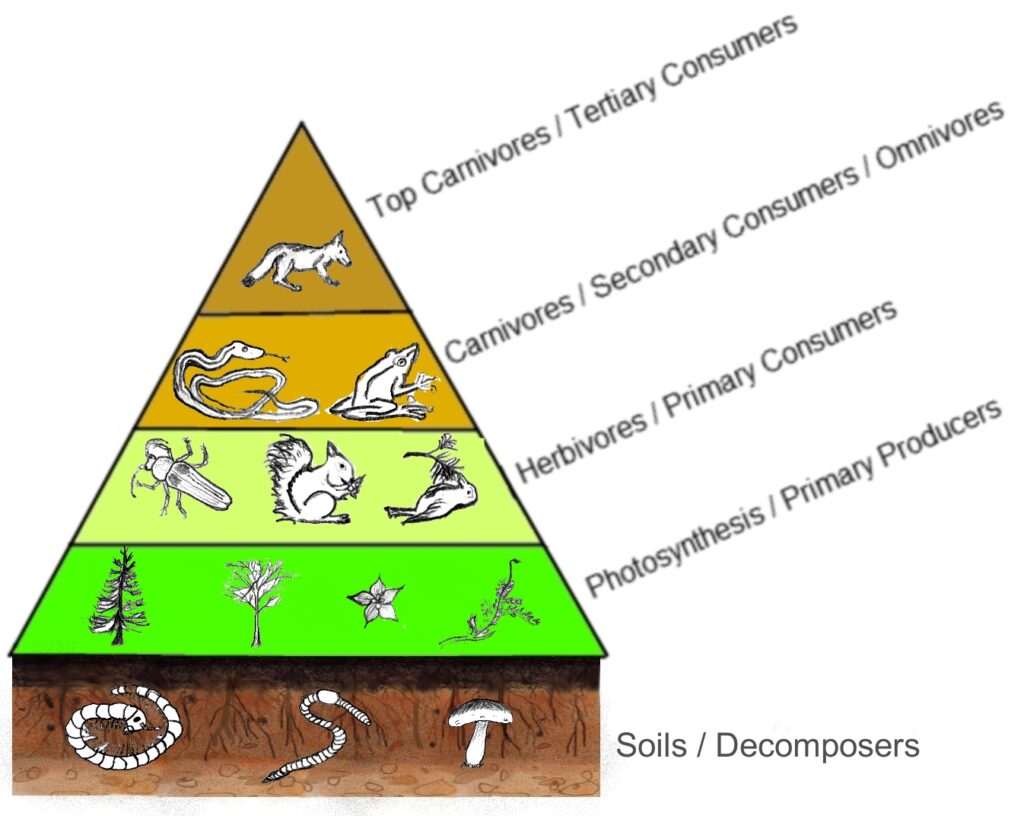
Fig. 2a : Schéma très simplifié d’une pyramide trophique, dans un écosystème terrestre. Les producteurs primaires (organismes autotrophes) sont figurés à la base de la pyramide. Source : Thompsma, CC BY-SA 3.0.
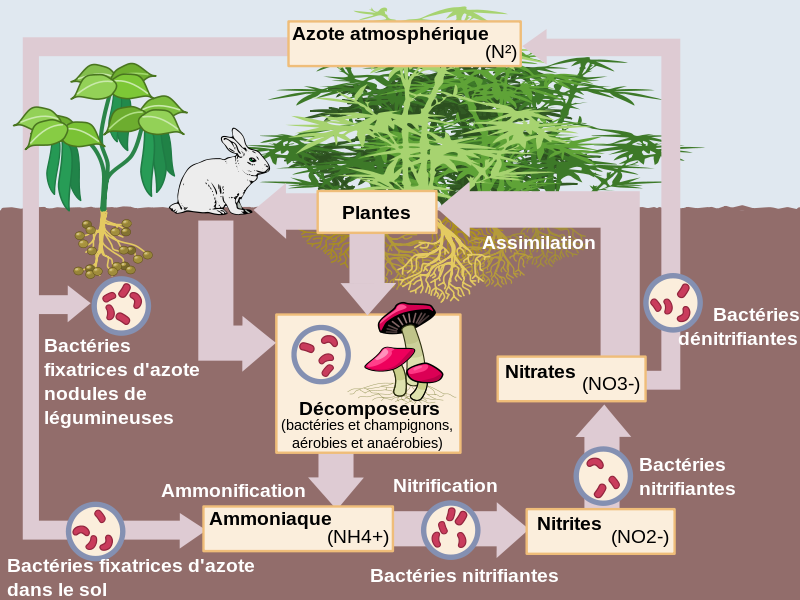
Fig. 2b : Schéma des interactions trophiques à la base du cycle de l’azote (N) dans les strates épigée et hypogée d’un écosystème terrestre. [NB : les animaux prédateurs et recycleurs ne sont pas figurés.] Source : Nojhan, CC BY-SA 3.0.
La production primaire annuelle d’un écosystème est la biomasse des organismes autotrophes – notamment algues et végétaux- produite chaque année par cet écosystème. [Sa productivité quant à elle est égale au taux de production de biomasse, par unité de surface et de temps.] Située à la base des réseaux trophiques, ou ‘chaînes alimentaires’, cette production primaire conditionne la production globale et le fonctionnement des écosystèmes. Pour les écosystèmes terrestres –en opposition aux écosystèmes aquatiques-, il s’agit essentiellement de la production (végétale) des plantes.
Si l’on excepte le cas de la vallée du Nil et de quelques autres régions désertiques de surface restreinte (moins de 1% des terres agricoles, au total), la conversion d’habitats terrestres « naturels » ou « semi-naturels » tels que forêts et marais en pâturages et champs cultivés se solde par une réduction nette tout à la fois de la biomasse et de la production primaire des écosystèmes concernés (voir ci-dessous).
A l’échelle de la Planète, Erb et al. (2017) estiment que les changements d’usage des terres opérés par les humains depuis le Néolithique ont réduit d’environ 450 Gigatonnes de Carbone (Gt C), c’est-à-dire de moitié, la biomasse totale des plantes terrestres. Plus des deux tiers (soit environ 330 Gt C) de cette perte de biomasse peuvent être imputés à l’agriculture, le reste à l’exploitation des forêts et à l’artificialisation des sols.
Quant à la production végétale annuelle des habitats terrestres, elle est d’une part réduite d’environ 10% à l’échelle mondiale (de 65,5 Gt C à 59,2 Gt C, selon Haberl et al. 2007) depuis les débuts de l’agriculture, du fait des changements d’usage des terres, mais aussi très largement détournée vers des réseaux écologiques dominés par notre espèce. Ainsi Haberl et al. (2007) estiment la proportion de la production végétale terrestre accaparée chaque année par les humains via l’agriculture à environ 20%, avec d’amples variations selon les régions (voir la Fig. 3). [De l’ordre de 10% en Asie Centrale et en Australie, cette proportion s’élève selon leurs estimations à près de 60% en Asie du Sud et environ 45% en Europe de l’Est et du Sud-Est.] En se fondant sur leurs données, on peut ainsi estimer à environ 12 Gt C (soit 60 GT x 0.2) la biomasse végétale mondiale annuellement accaparée par l’agriculture, pour la culture de plantes et l’élevage d’animaux domestiques.
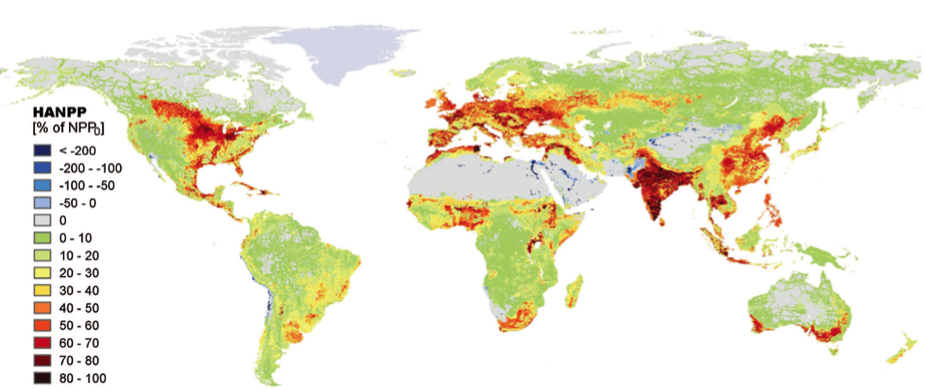
Fig. 3 : Représentation géographique de l’appropriation de la production primaire nette par les humains (HANPP), en tant que pourcentage de la production primaire nette potentielle locale (NPPo). [NB : Les taches bleues correspondent aux régions où la production primaire est accrue par les activités humaines, principalement via l’irrigation.] Source : Haberl et al., PNAS 104(31), 2007, Copyright (2007) National Academy of Sciences.
Capacité d’accueil des habitats, abondance des communautés d’espèces sauvages
La conversion de forêts et autres habitats anciens (dits ‘naturels’ ou ‘semi-naturels’), riches en biodiversité, en écosystèmes agricoles ou ‘agrosystèmes’ moins complexes et peu diversifiés, puis l’appauvrissement écologique de ces agrosystèmes par l’agriculture intensive via la suppression physique des arbres et haies, l’érosion du sol, l‘élimination des plantes messicoles par des herbicides, les traitements insecticides, antibiotiques ou antifongiques, le drainage des eaux de surface, la pollution ou salinisation éventuelle des sols, etc., réduisent considérablement la capacité biotique des habitats agricoles pour les communautés d’espèces sauvages.
Compilant un grand nombre de mesures de densités d’oiseaux selon les types d’habitats, Gaston et al. (2003) ont exploré l’impact de l’agriculture sur l’abondance de l’avifaune terrestre. A l’échelle locale, sachant qu’une forêt tropicale (riche d’environ 2500 oiseaux/km2) héberge environ cinq fois plus d’oiseaux adultes par unité de surface qu’un pré (environ 550 oiseaux/km2, en région tropicale) ou un champ d’agriculture extensive (environ 450 oiseaux/km2), la conversion de forêts tropicales en prés et champs cultivés réduit des 4/5e la capacité de charge locale de ces habitats pour les oiseaux. De la même manière, en région tempérée, la conversion de forêts mixtes ou décidues (peuplées de 800 à 1000 oiseaux par km2) soit en prés (370 oiseaux par km2), soit en champs d’agriculture extensive (300 oiseaux par km2), réduit des deux tiers environ l’abondance de l’avifaune locale.

Fig 4 : Parade nuptiale de perruches à moustaches (Psittacula alxandri fasciata) à Singapour, Malaisie. Les forêts tropicales accueillent environ fois cinq fois plus d’oiseaux par hectare que les champs qui les remplacent.
Cliché Lip Kee Yap, CC BY SA 2.0.
A l’échelle planétaire, connaissant les densités d’oiseaux selon l’habitat et la répartition des terres agricoles dans les différentes régions bioclimatiques, on peut estimer l’impact de l’expansion de l’agriculture et de l’élevage sur l’avifaune mondiale. S’appuyant sur les estimations de surface des grands types de biomes terrestres en 1990 par Klein-Goldjewijk (2001), Gaston et al. (op. cit.) ont ainsi estimé à environ 30 milliards d’oiseaux (adultes), soit entre 20 et 25% des effectifs préagricoles, la réduction de l’avifaune mondiale ‘terrestre’ (par opposition aux oiseaux de mer) due à l’expansion et l’intensification de l’agriculture, du Néolithique à 1990.
Reprenant les estimations de densité d’oiseaux par habitat de Gaston et al., appliquées cette fois aux quatre scénarios de changements d’usage des terres développés à l’horizon 2050 et à l’échelle mondiale par le Millenium Ecosystem Assessment (MEA, 2005), Teyssèdre et Couvet (2007) ont quant à eux estimé et comparé les impacts attendus, selon ces quatre scénarios, sur l’abondance en nombre d’individus et sur le nombre d’espèces (dit richesse spécifique) de l’avifaune mondiale. Ils ont ainsi estimé entre 10 et 25% des effectifs de 1990 la perte de l’avifaune terrestre mondiale liée à l’expansion et l’intensification de l’agriculture attendue entre 1990 et 2050, selon le scénario d’usage des terres envisagé (cf. Fig.5). [Sans surprise, le scénario le plus défavorable pour la biodiversité est celui, dit ‘d’Ordre par la force’ (‘Order from strength’), d’une gestion réactive et régionalisée des écosystèmes, sans anticipation ni collaboration interrégionale.]
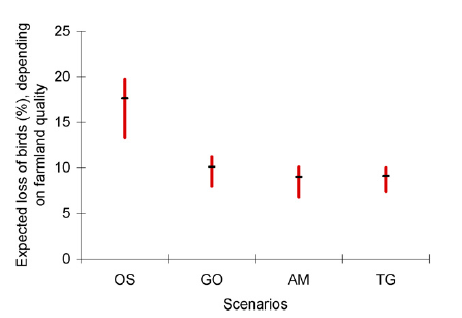
Fig.5 : Estimation de l’impact de l’agriculture sur l’abondance de l’avifaune mondiale (en nombre d’individus) attendu pour la période 1990-2050, selon le scénario socioéconomique (et d’usage des terres) du MEA. Les barres verticales rouges représentent les intervalles de confiance (p>0,95) autour des valeurs calculées pour les quatre scénarios, selon l’usage des terres estimé par le MEA. OS : Order from Strength (scénario réactif et régional) ; GO : Global Orchestration (proactif, coordonné à l’échelle mondiale) ; AM : Adapting Mosaic (proactif, régional) ; TG : Technogarden (réactif, coordonné entre régions).
Source : Teyssèdre et Couvet, 2007.
Cela revient à une réduction de 27 à 45% du nombre d’oiseaux nicheurs depuis les débuts de l’agriculture jusqu’en 2050, selon le scénario de développement et coopération socio-économique internationale envisagé. Une perspective plutôt sombre, si l’on considère que les trajectoires de développement socioéconomique actuelles s’apparentent au scénario le plus défavorable du MEA ! (cf. GIEC 2019.)
Situés vers le sommet des réseaux trophiques ou ‘chaînes alimentaires’, relativement faciles à observer et objets d’étude passionnants pour quantité d’ornithologues amateurs et professionnels, les oiseaux intègrent dans leurs dynamiques démographiques de nombreuses variations de l’environnement. Leurs variations d’abondance dépendent notamment de l’abondance et de la distribution spatio-temporelle de leurs proies, elles-mêmes conditionnées par l’état du couvert végétal, et donc par celui des communautés de microorganismes et invertébrés des sols.
De ce fait, leurs variations d’abondance au fil du temps constituent un bon indicateur de biodiversité terrestre, reconnu sur le plan international par la CBD (Convention pour la Diversité Biologique) depuis 2004 (Couvet et al., 2008, et voir plus loin la Fig. 7). Bien que de façon moins systématique, collaborative et standardisée, les variations d’abondance d’autres groupes d’organismes ont été suivies à l’échelle locale par de nombreux chercheurs, en de nombreux sites géographiques, qui confirment et renforcent les résultats obtenus sur l’avifaune.
A l’instar de tous les écosystèmes, les agrosystèmes sont des systèmes ouverts, en interaction avec leur environnement et donc les paysages alentour. Si les impacts directs de l’agriculture ‘extensive’ sur la biodiversité sont essentiellement locaux, c’est-à-dire principalement restreints aux écosystèmes convertis pour l’agriculture, ceux de l’agriculture intensive dépassent largement les limites des champs cultivés, via la dispersion des polluants (pesticides, herbicides et engrais notamment). Transportés par l’air, les eaux de surface ou les animaux mobiles (insectes, vertébrés…), les composés chimiques appliqués localement atteignent et affectent les écosystèmes adjacents, voire éloignés. Ainsi les pollutions par les engrais et pesticides déversés sur les champs et lessivés lors des pluies, ou gagnant les nappes phréatiques, sont nocives pour les écosystèmes de tout type en aval.
La pollution des littoraux par les engrais azotés utilisés massivement dans certaines régions est bien connue, qui s’exprime par des blooms algaux récurrents (dits ‘marées vertes’), délétères pour la biodiversité, et peut transformer certaines zones humides, estuaires et écosystèmes littoraux en zones « mortes » privées d’espèces aérobies (FA0 2015 ; voir aussi l’excellente BD d’I. Léraud et P. Van Hove « Algues vertes – l’enquête interdite », 2020).

Fig 6 : Marée verte (prolifération d’algues vertes Ulva armoricana) sur une côte bretonne. Cliché Thesupermat, CC BY-SA 2.5.
De nombreuses recherches, incluant des expériences et des suivis de biodiversité sur le terrain, pointent les impacts de l’agriculture intensive, et en particulier des pesticides systémiques -tels que les néonicotinoïdes et le Fipronil- commercialisés depuis les années 1990, sur des organismes et écosystèmes non ciblés (e.g. Ellis 2011 ; van Lexmond et al. 2015 ; Dudley et al., 2017 ; Sanchez-Bayo & Wyckhuys 2019). Selon une étude de Hallman et al. parue en 2017, qui a fait grand bruit dans les médias, la biomasse des insectes volants mesurée dans divers espaces protégés de régions agricoles d’Allemagne a chuté de plus 75% en 27 ans (entre 1989 et 2016), c’est-à-dire d’environ 2.6% par an, probablement du fait de l’intensification de l’agriculture dans ces régions. Les suivis d’insectes dans les prairies et forêts d’Allemagne (entre 2008 et 2017) par Seibold et al. (2019) montrent des tendances comparables, et indiquent que le déclin de l’entomofaune des prairies augmente avec l’emprise de l’agriculture intensive dans les paysages.
A l’échelle mondiale, compilant les données de 166 suivis d’abondance d’insectes sur tous les continents (1676 sites), van Klink et al. (2020) ont quant à eux estimé un déclin moyen de l’abondance des insectes terrestres moins sévère (et contesté par divers auteurs), d’environ 10% en 10 ans (soit -1% par an), largement imputé à l’intensification de l’agriculture.
Composition des communautés d’espèces sauvages
Dans une communauté biotique –d’oiseaux, de poissons, d’insectes ou de plantes– peuplant un même habitat ou site géographique, toutes les espèces n’ont pas les mêmes aptitudes et exigences écologiques, et ne réagissent donc pas de la même manière aux variations spatiales ou temporelles de leur habitat (voir par ex. le Regard R80a). Elles occupent notamment des niches écologiques plus ou moins larges, c’est-à-dire qu’elles sont plus ou moins spécialisées –ou précisément adaptées– aux conditions de vie rencontrées dans leurs habitats.
Equipées pour l’exploitation de certaines ressources, dans des conditions de vie physiques ou/et biologiques assez précises, descriptives de leur(s) habitat(s), les espèces spécialistes sont a priori plus compétitives que les généralistes dans leur(s) habitat(s) de prédilection ; ces dernières en revanche prospèrent dans des habitats variables ou formés d’une mosaïque d’habitats différents, et sont en toute logique plus tolérantes aux changements imprévus de leurs conditions de vie (Hutchinson 1957).
Dès lors, on comprend que la transformation d’habitats pour l’agriculture non seulement réduise généralement l’abondance des communautés biotiques locales (en nombre d’individus), mais aussi affecte leur composition de diverses manières, selon le type de transformation. Schématiquement, la conversion de forêts (ou d’autres écosystèmes anciens) en champs et pâturages d’agriculture extensive remplace les communautés initiales forestières, dominées par des espèces spécialistes des forêts, par des communautés ‘agricoles’ dominées par des espèces spécialistes des prairies et autres milieux ouverts. L’intensification de l’agriculture en revanche, ainsi que la fragmentation d’habitats (semi)naturels pour l’agriculture, défavorise les espèces spécialistes et augmente la proportion de généralistes dans les habitats concernés.
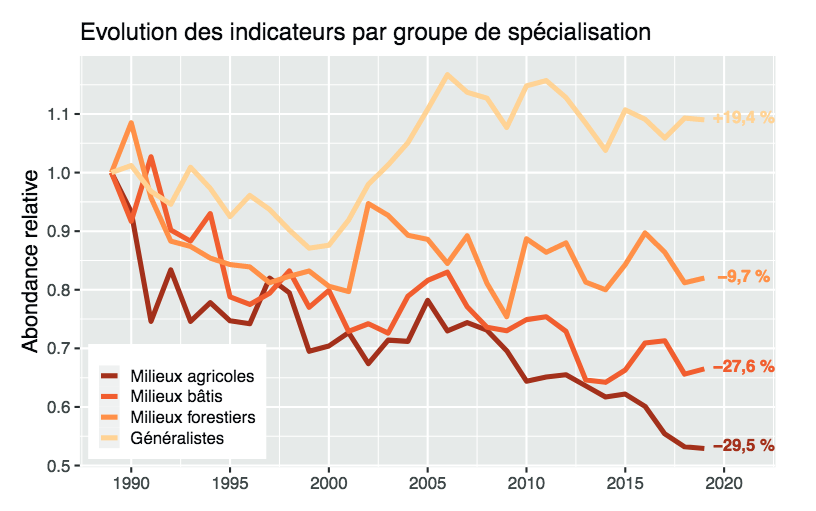
Fig 7 : Suivi de l’Indicateur STOC (Oiseaux communs de France) par habitat, 1989-2019. Source : CRBPO, MNHN, 2020.
Attendus sur le plan théorique, ces différents impacts de la transformation des habitats sur la composition des communautés biotiques locales et régionales sont vérifiés, explorés et modélisés depuis plus de quinze ans. Au milieu des années 2000, une équipe du Muséum National d’Histoire Naturelle a mis au point une méthode permettant d’estimer le degré de spécialisation (à leurs habitats) d’espèces et de communautés biologiques, pour pouvoir suivre et comprendre les variations de leurs ‘indices de spécialisation’ dans le temps et dans l’espace (Julliard et al. 2006). Appliquant cette méthode à l’avifaune, étudiée dans différents types d’habitats, les chercheurs ont montré en 2008 que l’indice de spécialisation des communautés d’oiseaux varie en sens inverse du taux de perturbation ou fragmentation de leurs habitats, notamment agricoles : plus un habitat est perturbé –par la pollution, la fragmentation, le changement du climat…–, plus les espèces qu’il héberge sont généralistes (Devictor et al., 2008a). L’indice de spécialisation des communautés (CSI) apparaît donc un bon indicateur de perturbation, voire de qualité, des habitats.
Que ce soit chez les oiseaux, les insectes ou d’autres taxons, de nombreux suivis de biodiversité soulignent la raréfaction des espèces spécialistes dans les sites étudiés, raréfaction attribuée principalement à l’intensification de l’agriculture, à la pollution et au réchauffement climatique (Clavel et al. 2011, Sanchez-Bayo et Wyckhuys 2019 ; voir aussi Mc Kinney et Lockwood 1999).

Fig 8 : Femelle d’argus strié (Phengaris teleius), ou azurée de la sanguisorbe, déposant ses oeufs sur une fleur de sanguisorbe. L’espèce se raréfie en Europe avec la dégradation de son habitat (prairies humides) et la raréfaction de ses plantes hôtes.
Cliché M. Kutera, CC BY-SA 4.0.
A l’échelle des paysages et des régions, l’expansion d’espèces généralistes -éventuellement originaires d’autres régions du Globe – ou/et commensales des humains, associée au déclin d’espèces spécialistes, se traduit par une ressemblance croissante des communautés écologiques dite ‘homogénéisation fonctionnelle’, manifeste notamment dans les régions d’agriculture intensive (Clavel et al. op. cit., Le Viol et al. 2012, et voir le Regard R16).
Impact sur les nombres d’espèces locales
Si l’on suppose que le nombre d’espèces –ou ‘richesse spécifique’– d’une communauté biotique augmente avec le nombre d’individus toutes espèces confondues (ex : Hubbell, 2001), on peut s’attendre à ce que l’expansion et l’intensification de l’agriculture, en réduisant l’abondance des communautés locales d’espèces sauvages, réduise également leur diversité (locale, dite ‘alpha’) en nombre d’espèces.
Ce raisonnement serait exact si les communautés biotiques étaient neutres, c’est-à-dire formées d’espèces équivalentes sur le plan écologique (Hubbell 2001), ou plus exactement si tous les individus (quelles que soient leur espèce et leur écologie) avaient la même valeur sélective* et répondaient –démographiquement– de la même manière aux changements de leurs conditions de vie. Cependant, comme nous l’avons vu ci-dessus, ce n’est pas le cas. En particulier, l’intensification de l’agriculture pénalise les espèces spécialistes des habitats agricoles et adjacents, mais bénéficie –jusqu’à un certain point– aux espèces généralistes. La modélisation écologique montre que, dans le cas d’une modification progressive des habitats (par pollution, salinisation ou aridification croissantes, par exemple), impliquant une réduction de leur capacité de charge, le nombre d’espèces locales augmente tout d’abord –malgré une diminution du nombre total d’individus– avec le degré de perturbation des habitats, puis diminue au-delà d’un certain seuil (Teyssèdre et Robert 2014, cf Fig. 9a ci-dessous).
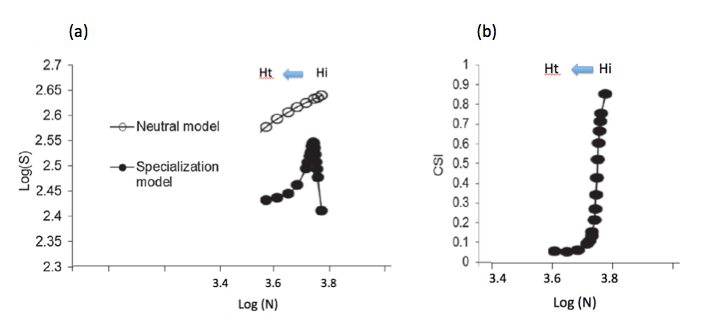
Fig .9 : Simulation de l’impact de la transformation (dégradation) d’un habitat, avec réduction progressive de sa capacité de charge, sur une méta-communauté alimentée par un pool régional de 500 espèces. Hi : habitat initial, Ht : habitat transformé, de moindre capacité de charge pour la communauté considérée (Kt < Ki).
9a : Relation à l’équilibre entre la richesse spécifique (nombre d’espèces S) et l’abondance (nombre d’individus N) de cette communauté selon le modèle utilisé, en coordonnées logarithmiques. Courbe du haut (en blanc) : modèle stochastique neutre : les 500 espèces sont toutes équivalentes sur le plan démographique (i.e., mêmes probabilités de colonisation, reproduction et survie locale par individu). Ce modèle montre une relation linéaire entre les logarithmes des deux variables, équivalente à une relation puissance du type S = c.Nz. Courbe du bas (en noir) : modèle de spécialisation : sur les 500 espèces du pool régional, 250 sont généralistes, 125 sont spécialistes de l’habitat Hi (ex : forêt) et 125 spécialistes d’un autre habitat (ex : prairie). Selon ce modèle, la relation à l’équilibre entre les logarithmes des deux variables S et N prend la forme d’un accent circonflexe, avec un nombre d’espèces maximum pour un degré de perturbation intermédiaire (ce qui correspond aux observations de terrain).
9b : Relation à l’équilibre entre l’indice de spécialisation (CSI) de cette communauté et le logarithme de son abondance (Log N), selon le modèle de spécialisation. L’indice CSI diminue avec la transformation croissante de l’habitat, depuis une communauté abondante (Ni = Nmax) et riche en espèces spécialistes (CSI = 0 .9) dans l’habitat Hi, vers une communauté d’espèces surtout généralistes (CSI < 0.1) qui s’appauvrit progressivement en individus avec la diminution de la capacité de charge de l’habitat. Schéma A. Teyssèdre, adapté de Teyssèdre et Robert, 2014.
Cette courbe en U inversé s’explique simplement si l’on considère que le déclin d’espèces spécialistes, en nombre d’individus, ne signifie par pour autant leur disparition immédiate locale donc la réduction du nombre d’espèces. A l’inverse, la colonisation par de nouvelles espèces généralistes d’un habitat transformé implique tout à la fois une augmentation en nombre d’espèces et d’individus (généralistes). Schématiquement, le nombre total d’espèces locales augmente avec la perturbation des habitats tant que la colonisation par de nouvelles espèces généralistes excède (en nombre d’espèces) la disparition locale d’espèces spécialistes ; puis il diminue lorsque cette dernière excède l’apport d’espèces généralistes (cf. Fig 9a et b). [Le point d’inflexion (maximum local) correspond à l’égalisation des valeurs sélectives moyennes des individus spécialistes et généralistes, dans des habitats modérément perturbés.]
En bref, contrairement à leur indice de spécialisation (CSI) -qui diminue en réponse à la perturbation des habitats, et peut donc être utilisé comme indicateur de stabilité ou de qualité des habitats, voir plus haut-, la richesse spécifique des communautés locales peut varier dans un sens ou dans l’autre selon le degré de perturbation des habitats. Elle ne peut donc constituer un bon indicateur de stabilité ou ‘qualité’ des habitats (notamment agricoles) – sauf à connaître déjà, par d’autres métriques, le degré de perturbation des habitats.
Ce prédicat théorique est confirmé par les suivis d’avifaune (Le Viol et al. 2012, Chiron 2014) et par d’autres suivis de biodiversité, en milieu terrestre ou aquatique. Rassemblant dans une même méta-analyse un grand nombre de suivis de biodiversité menés à l’échelle locale ou régionale depuis plus de 30 ans, Dornelas et al. (2015) ont quant à eux constaté un changement systématique de la composition des communautés au fil du temps et vérifié par ailleurs l’érosion de la biodiversité à l’échelle globale (voir ci-dessous), mais n’ont observé aucune tendance générale à la diminution du nombre d’espèces locales (voir aussi Teyssèdre et Robert 2015).
Impact sur la biodiversité mondiale, en nombre d’espèces
A l’échelle mondiale, l’expansion géographique d’espèces préexistantes –qu’elles soient généralistes ou commensales des humains–, entre régions ou/et continents, ne peut accroître les nombres totaux d’espèces dans les différents groupes systématiques considérés. Seule l’apparition (par spéciation) de nouvelles espèces, adaptées aux nouveaux habitats dits émergents, pourrait augmenter ces nombres. Mais la vitesse actuelle de transformation et fragmentation des habitats et communautés -sous la pression des activités humaines- est telle que seules les espèces et populations les plus tolérantes à ces variations, et principalement les espèces abondantes à fort taux de multiplication (reproduction précoce, fécondité élevée) telles que bactéries, algues, champignons, insectes et plantes annuelles, semblent susceptibles de se diversifier en réponse à ces changements.
Le déclin massif d’espèces spécialistes, peu fécondes ou/et de haut niveau trophique (confrontées à la transformation rapide de leurs conditions de vie), en revanche, devrait se solder par une réduction nette du nombre de ces espèces –et du nombre moyen de niveaux trophiques– à l’échelle mondiale.

Fig. 10 : Siamang (Symphalangus syndactylus) vocalisant en captivité. Comme tous les membres de sa famille (les gibbons, ou hylobatidés), cette espèce inféodée aux forêts tropicales d’Indonésie est menacée d’extinction par la conversion de son habitat forestier en terres agricoles – principalement, pour la culture de palmiers à huile.
Cliché Suneko, CC BY 2.0.
Face aux maigres connaissances sur la diversité mondiale des bactéries, archées, protistes, ‘algues’ et champignons, aucune équipe de chercheurs n’a encore – à ma connaissance– tenté d’estimer l’impact de l’agriculture –ou d’autres activités humaines– sur le nombre total d’espèces dans ces vastes règnes du Vivant.
Le même constat s’applique à la plupart des grands groupes animaux (sous-embranchements et classes), à l’exception de deux groupes plus largement étudiés, les insectes et les vertébrés, et pour ces derniers plus précisément les mammifères et les oiseaux.
Les insectes forment un ensemble très divers et abondant d’espèces (hexapodes) de petite taille, dotées souvent d’une bonne fécondité et de bonnes capacités de dispersion, qui peuplent toutes sortes d’habitats terrestres et d’eau douce. Selon les estimations, ils comptent aujourd’hui entre 5 et 20 millions d’espèces –dont un million sont répertoriées et décrites– pour une biomasse totale d’environ 200 Mt C (Bar-On et al, 2018). Compilant les résultats de 73 suivis d’insectes menés sur l’ensemble des continents depuis plusieurs décennies, Sanchez-Bayo et Wyckhuys (2019) estiment à 40% environ la proportion d’espèces qui pourraient disparaître dans les prochaines décennies à l’échelle mondiale, sous la pression principale des changements d’usage des terres, de l’intensification agricole et du changement climatique, en interaction avec des facteurs biologiques (espèces pathogènes, espèces exotiques envahissantes, …) (cf. Fig 11 A et B). Ainsi, la grande fécondité de la plupart des insectes ne les protège pas contre les pesticides et la transformation massive de leurs habitats.
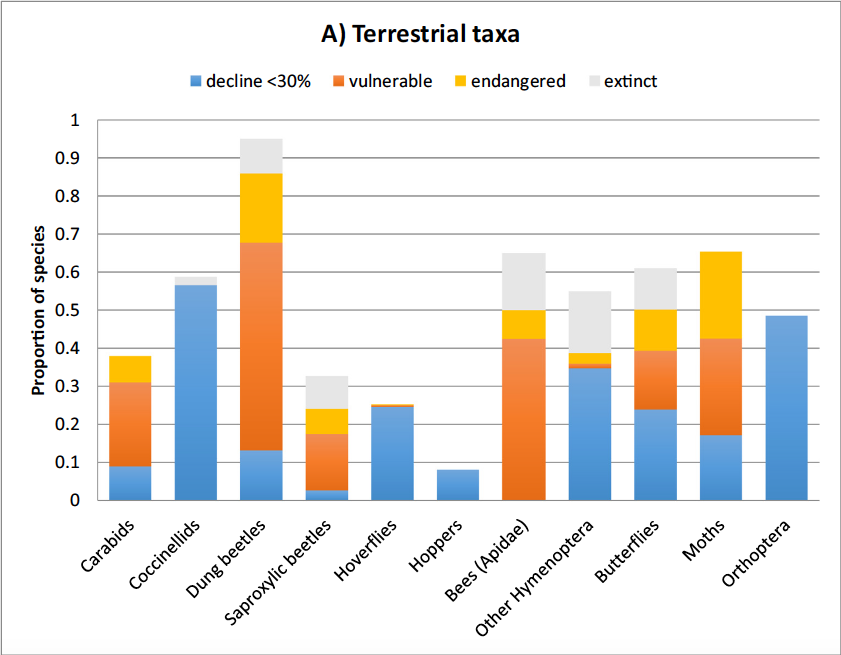
Fig. 11 A et B : Proportions d’espèces d’insectes menacées d’extinction ou localement éteintes en 2018, selon les critères de l’UICN. Espèces vulnérables : déclin compris entre 30 et 50% depuis 1970; en danger : déclin > 50% ; éteintes : non observées depuis plus de 50 ans. A : taxons terrestres.
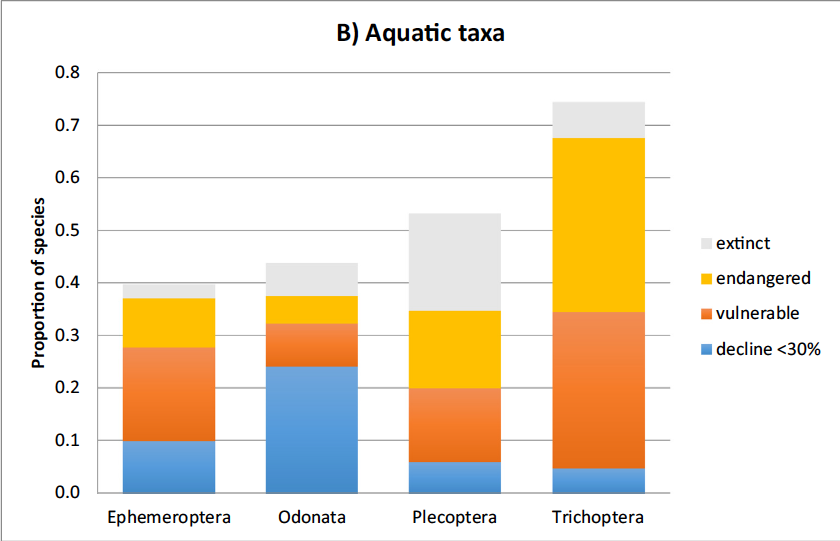
B : taxons aquatiques. Source : Sanchez-Bayo et Wyckhuys, 2019.
Pour les vertébrés : s’appuyant sur les analyses de son Indice Liste Rouge, l’UICN (2020) estime que 26% des espèces de mammifères, 14% des espèces d’oiseaux et 41% des espèces d’amphibiens sont actuellement menacées d’extinction, sous la pression des mêmes facteurs –anthropiques– identifiés ci-dessus pour les insectes. Explorant quant à eux les impacts de l’agriculture sur l’avifaune mondiale dans une approche de modélisation dynamique des communautés (et s’appuyant sur une relation Individus-Espèces déclinée à l’échelle mondiale), Teyssèdre et Couvet (op.cit.) ont estimé entre 30 et 45%, selon le scénario socio-économique envisagé, la réduction du nombre mondial d’espèces d’oiseaux terrestres (c’est-à-dire non marins) liée à l’expansion et l’intensification de l’agriculture, de ses débuts à 2050. Ces estimations confirment la vulnérabilité des vertébrés terrestres face à l’ampleur des changements globaux.
Impacts sur la structure et la complexité des réseaux écologiques
Qu’il soit forêt, savane, étang ou agrosystème (ou encore holobionte, voir par exemple le Regard R85), tout écosystème est formé d’un réseau dynamique d’êtres vivants en interaction entre eux et avec leur milieu physique (ou ‘biotope’), composante non vivante de l’écosystème.
Dans un écosystème peu anthropisé (dit ‘naturel’ ou ‘semi-naturel’), les interactions entre espèces sont habituellement multiples, anciennes et diversifiées : relations trophiques bien sûr, entre prédateurs et proies ou entre espèces-hôtes et parasites (ou parasitoïdes), de la base au sommet des ‘chaînes alimentaires’ ; mais aussi relations de compétition pour les ressources, de facilitation (à l’installation d’autres espèces) ou encore d’entraide réciproque, entre espèces de niveaux trophiques variés (par ex. Couvet et Teyssèdre 2010, ou le Regard R3 et la Fig 12 ci-dessous).
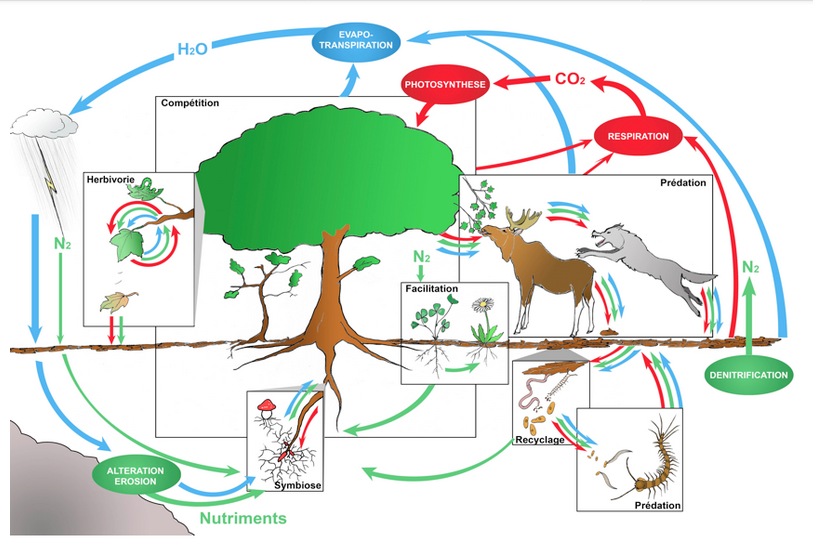
Fig 12 : Schéma des principales interactions entre espèces (rectangles), des flux de matière (flèches colorées) et des grandes fonctions écosystémiques (ovales) dans un écosystème forestier.
Schéma Mouquet et al, Regard n°3, 2010.
Conséquence positive, pour d’autres organismes fréquentant les mêmes habitats, d’activités biologiques effectuées par certaines espèces –parfois dites ‘ingénieures des écosystèmes‘–, les exemples de facilitation (univoque) entre espèces sont multiples : citons l’aération et l’entretien des sols par les lombrics et autres vers de terre -bénéfique pour quantité d’organismes hypogés aérobies, dont les vers de terre ; la purification et oxygénation de l’eau par les plantes lacustres -favorable à de nombreuses espèces de poissons, notamment ; la construction d’abris climatisés en partie souterrains par de nombreuses espèces de fourmis et termites, ou celle de gîtes haut perchés accueillants pour d’autres espèces (éventuellement après le départ des constructeurs) par les oiseaux nicheurs.. L’établissement de barrages sur les rivières par les castors (et par les humains, ingénieurs des écosystèmes par excellence!) est un autre exemple de facilitation, aux conséquences radicales pour la biodiversité locale puisqu’il implique la conversion rapide de cours d’eau en écosystèmes lacustres, colonisés par de multiples espèces.
Parmi les relations de coopération, ou entraide réciproque, citons les associations nutritives entre plantes et bactéries (Rhizobium dans les racines) ou entre plantes et champignons (ex : mycorhizes), les services écologiques échangés entre plantes à fleurs et insectes pollinisateurs (alimentation vs reproduction), entre espèces parasitées et prédateurs de parasites (alimentation ou gîte vs protection), la dispersion de graines par des insectes, oiseaux et mammifères granivores ou frugivores, etc. La répétitivité des interactions contribue au fil du temps à la coadaptation (et la synchronisation) des espèces partageant les mêmes habitats, tandis que leur diversité – au delà des seules interactions trophiques- concourt à la stabilité et à la résilience des réseaux écologiques (Naeem et al. 1995, Hooper et al. 2005, et voir plus bas.)
Etant donné le grand nombre d’espèces composant un écosystème et la diversité de leurs interactions, modéliser un réseau écologique pour en comprendre la dynamique constitue un véritable défi pour les écologues, que certains ont relevé (ex. Kéfi et al. 2016, cf. fig.13, ou Pocock et al. 2020, et voir la section suivante).
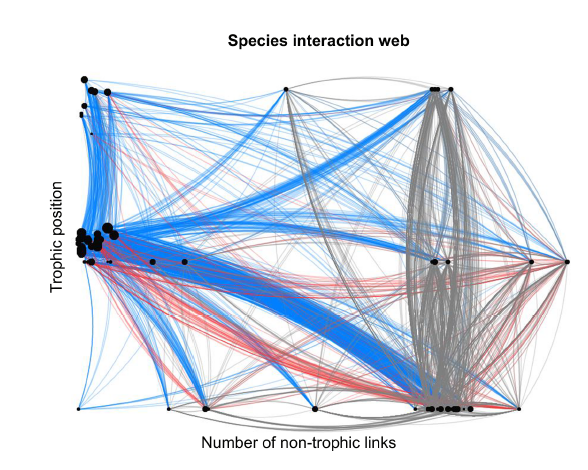
Fig.13 : Représentation du réseau écologique d’interactions entre 106 espèces (figurées par les noeuds du réseau), appartenant à trois niveaux trophiques, composant une communauté marine intertidale au Chili. En bleu : interactions trophiques. En rouge et en gris : interactions non trophiques, respectivement positives et négatives. La diversité des interactions non trophiques augmente la résistance et la résilience du réseau. Source : Kéfi et al., 2016.
.
Dans un agrosystème, la diversité des interactions entre espèces diminue -voire s’effondre- avec l’intensité croissante des traitements agricoles –physiques, chimiques et biologiques– imposés. La simplification des réseaux écologiques culmine dans les vastes monocultures de plantes (blé, colza, maïs, soja…), qui croissent ‘à l’abri’ des plantes messicoles, de la plupart des insectes, oiseaux et autres organismes -grâce notamment aux pesticides– avant d’être fauchées et transformées en ‘produits’ agro-industriels, souvent conservés en chambre froide ou/et sous emballage plastique avant commercialisation. En guise de deuxième niveau trophique, ces produits d’origine végétale sont consommés soit directement par des humains, soit par un petit nombre d’espèces animales ‘domestiques’ telles que porcs et poulets -souvent élevés en grande densité de congénères dans des bâtiments dits agricoles-, soit encore par des machines et moteurs en tant qu’agrocarburants (voir le focus n°2). Le troisième niveau trophique, celui des carnivores, est presque monopolisé par les humains.

Fig. 14 : Monoculture de blé, en Picardie. Dans un champ d’agriculture intensive, périodiquement arrosé de pesticides, la diversité des espèces et de leurs interactions écologiques –donc la complexité des réseaux – sont au plus bas. Cliché A. Teyssèdre.
La diversité des organismes détritivores, coprophages, saprophytes et recycleurs est à son tour réduite et largement délocalisée hors des champs, dans les lisiers des bâtiments d’élevage, les égouts, les stations d’épuration et les plans d’eau ou littoraux en aval.
NB : Notons cependant que la relation entre complexité et stabilité des réseaux écologiques, qui dépend de nombreux facteurs, ne fait pas encore l’objet d’un consensus pour les chercheurs (Landi et al. 2018).
Impacts sur la stabilité des agrosystèmes
Les recherches réalisées dans le domaine depuis plus de 50 ans ont permis de vérifier que, au moins à l’échelle locale, le fonctionnement et la stabilité des écosystèmes terrestres augmentent avec la diversité des plantes qu’ils hébergent (Cardinale et al. 2007, 2011, Gross et al. 2014, Thompson et al. 2018). Leur stabilité augmente en outre avec la diversité des interactions non trophiques entre espèces (Kéfi et al, op.cit.), ainsi qu’avec l’ancienneté des interactions (Aubree et al. 2020).
Ainsi la biodiversité réduite des agrosystèmes diminue leur résistance aux perturbations, notamment aux invasions de parasites tels que virus, bactéries, champignons ou insectes phytophages. Plus précisément, la stabilité accrue des agrosystèmes diversifiés, relativement aux réseaux écologiques très appauvris que sont les monocultures intensives, renvoie à plusieurs composantes de la biodiversité :

Fig. 15 : Attaque d’une monoculture de blé par la « rouille jaune », signalant la prolifération locale du champignon pathogène Puccinia striiformis. (Cliché Brauna55, CC BY-SA 4.0.)
- diversité génétique des espèces cultivées (par ex. Zhu et al. 2000),
- diversité spécifique et fonctionnelle des espèces cultivées (polyculture vs monoculture) et non cultivées (par ex. Cardinale et al. 2007 ; Renard et Tilman 2021),
- abondance des pollinisateurs (ex : Deguines et al., 2014),
- diversité des niveaux trophiques, notamment présence locale d’ennemis naturels (prédateurs, parasitoïdes..) des parasites et autres ‘ravageurs’ des cultures, éventuellement issus d’autres habitats alentour (par ex. Paredes et al. 2019, 2020),
- diversité des interactions non trophiques (dont facilitation, cf. Kéfi et al. 2016),
- ancienneté des interactions (coadaptation, ex. Aubree et al. cit),
- diversité locale par rapport à la diversité régionale, et diversité des cultures à l’échelle nationale (Renard et Tilman 2019),
- diversité des réseaux agriculteurs – variétés cultivées (voir par ex. Labeyrie et al., 2021).
Dans un cercle vicieux, la vulnérabilité des vastes champs de monoculture intensive face aux invasions de pathogènes motive l’utilisation accrue de pesticides par les agriculteurs, qui réduit encore la diversité des espèces et de leurs interactions…
Impacts sur le fonctionnement des écosystèmes
Les impacts que nous venons d’évoquer sur la structure et la dynamique des communautés, les nombres d’espèces et les réseaux écologiques, à différentes échelles, affectent bien sûr considérablement le fonctionnement des écosystèmes et socio-écosystèmes (voir par ex. MEA 2005, Cardinale et al. 2012, Tilman et al. 2014).
Outre la simplification et la fragilisation des réseaux écologiques et écosystèmes locaux, un autre effet -bien évident- de l’agriculture est de les spécialiser dans la production de biomasse exploitable par les humains, au détriment d’autres fonctions. Ainsi la diversité, la complexité et la stabilité des agrosystèmes régressent, voire s’effondrent dans le cas de l’agriculture et de l’élevage intensifs, au profit de leur production massive mais temporaire d’un petit nombre de variétés végétales et d’animaux domestiques.
Parmi les multiples fonctions écosystémiques entravées par l’expansion et l’intensification de l’agriculture, voire localement perdues, citons :
- l’épuration de l’air par les forêts et autres écosystèmes (semi-)naturels terrestres (convertis en champs et pâturages),
- la capture et séquestration du carbone par ces mêmes écosystèmes, et donc la régulation du climat mondial,
- la régulation du climat local par les forêts et zones humides,
- la modération des crues et sécheresses (liée à la raréfaction des zones humides),
- le renouvellement des nappes phréatiques (dans les régions de forte irrigation agricole),
- l’épuration des eaux douces (dans les régions d’agriculture intensive), avec un impact en aval sur l’ensemble du bassin versant (voir la Fig.6),
- l’entretien et la productivité des sols (aujourd’hui réduite par l’érosion, les pollutions, la salinisation, …),
- la pollinisation des plantes sauvages et cultivées par les abeilles et autres insectes ‘pollinisateurs’ en déclin,
- la résistance des communautés sauvages et cultivées aux invasions de parasites et autres pathogènes,
- la capacité d’accueil des écosystèmes pour les espèces sauvages, notamment spécialistes,
- leur capacité d’accueil physique et psychologique pour les animaux domestiques ou d’élevage (confinés en grand nombre dans des bâtiments agricoles),
- leur capacité de recyclage des déchets, alimentaires (dont fèces) et agroindustriels (dont matières plastiques, métaux..),
- leur capacité d’accueil aussi pour les humains (dans les régions d’agriculture intensive).
Sans explorer ici les impacts des progrès techniques, des modèles de production et consommation, des systèmes de taxation/subventions ou du commerce international sur l’évolution des systèmes agroalimentaires, soulignons que les multiples impacts sur le fonctionnement des écosystèmes énoncés ci-dessus affectent non seulement la biodiversité non humaine, mais aussi très largement les populations humaines et leur santé (cf. l’encart ci-dessous).

Fig.16 : Champ de maïs, en France. La culture du maïs requiert une forte irrigation en été (saison de croissance pour les plantes). Dans les régions de faible pluviosité annuelle, elle implique une irrigation artificielle intense, délétère pour les nappes phréatiques. L’inadaptation de cette culture au climat régional s’accroît avec le réchauffement climatique.
Cliché A. Teyssèdre.
Conclusion : quel futur pour Ouroboros ?
L’expansion-intensification de l’agriculture depuis ses débuts a été menée aux dépens de nombreuses composantes de la biodiversité : biomasse végétale mondiale, abondance des communautés animales et végétales sauvages ainsi que microbiennes (non explorées ici, mais voir les Regards R70, R90, R99 et RO20), nombre et diversité des espèces animales et végétales, bien-être animal, complexité des réseaux écologiques, sonnant à leur tour le déclin de nombreuses fonctions de régulation et de soutien des écosystèmes.
Selon le MEA (2005), 60% des ‘services de régulation’ des écosystèmes -bénéfiques tant aux humains qu’à de nombreuses espèces et communautés biotiques- étaient en déclin ou perdus au tournant du millénaire, dont une bonne partie du fait de l’expansion-intensification de l’agriculture. Ces pertes et déséquilibres écologiques se sont aggravés depuis, au détriment notamment de la santé et de l’alimentation d’un nombre croissant d’êtres humains depuis 2010 (FA0 2020, et voir l’encart en fin d’article).
D’autres recherches indiquent que la modification ‘anthropique’ de certaines variables physiques, chimiques et biologiques, telles que les concentrations atmosphériques en gaz à effet de serre ou celle des sols en nitrates, les approche de seuils critiques à l’échelle mondiale ; c’est à dire de seuils au delà desquels le système adaptatif complexe qu’est la biosphère dans son ensemble pourrait basculer vers un autre régime de fonctionnement, très défavorable –entre autres espèces- aux humains (voir par ex. Steffen et al. 2015, et la Fig 17 ci-dessous).
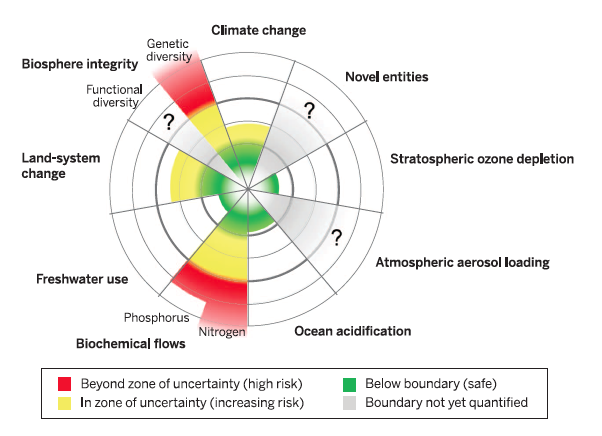
Fig. 17 : Evaluation de neuf variables physiques, chimiques et biologiques ‘de contrôle’ terrestre, déterminant le maintien –ou non- de la Biosphère dans son régime actuel de fonctionnement. La partie centrale (verte) du disque est celle de l’espace opérationnel sûr (safe operating space), pour l’ensemble de ces variables ; la partie intermédiaire (en jaune) est une zone de risque croissant d’effondrement (basculement) des écosystèmes à large échelle spatiale, au delà de valeurs seuils des variables; la partie extérieure (en rouge) est la zone critique de risque élevé de basculement. Source : Steffen et al., Science 347 (2015), CC-BY.
Selon Steffen et al., trois variables, toutes trois liées à l’intensification de l’agriculture, sont aujourd’hui dans une zone critique, à haut risque de basculement du système (cf. Fig. 17) : les flux annuels mondiaux d’azote (N) et de phosphore (P) liés à la production et l’utilisation croissantes d’engrais chimiques, d’une part, la faible diversité génétique des espèces sauvages (peu abondantes) et domestiques (fortement sélectionnées), de l’autre.
Ainsi, il semble bien que la dynamique ‘ouroborienne’ d’expansion-intensification de l’agriculture ait atteint ses limites. Pour résumer, celle-ci peut être décrite comme un détournement croissant de la productivité primaire (végétale) des écosystèmes terrestres -et donc leur transformation massive-, par certaines sociétés humaines, au ‘profit’ de communautés végétales, animales (dont les humains) et microbiennes peu diversifiées, dont la fragilité augmente avec celle des écosystèmes appauvris et pollués qui les hébergent… menaçant ainsi d’effondrement les sociétés qui en dépendent !
Pour subsister, notre vieil Ouroboros doit impérativement revoir son régime et réduire ses appétits. Face aux multiples impacts de cette dynamique agricole, nos sociétés doivent remettre en question les systèmes agricoles dominants et élaborer des politiques et pratiques alternatives, durables, susceptibles de les sortir de cette boucle destructrice pour les écosystèmes et la biodiversité (par ex. Pautasso et al. 2013, Sirami et al. 2019, voir aussi les Regards R68, R79, RO6 et autres Regards et débats sur l’agriculture). Politiques agricoles nouvelles qui, pour être approuvées et mises en œuvre de façon cohérente, doivent s’inscrire dans un changement général de conception, objectifs et organisation des sociétés au sein des socio-écosystèmes, valorisant la diversité écologique, la sobriété et l’équité environnementale plutôt que la production et la consommation iintensives de ‘ressources’.
Encart : Intensification agricole et effondrement de socio-écosystèmes
Pour illustrer la diversité et l’ampleur des impacts de l’intensification de l’agriculture sur les sociétés, nous évoquerons ici ceux de la culture de palmiers à huile en Colombie. La perte de biodiversité végétale, animale et fongique liée à la conversion de vastes fragments de forêt tropicale en plantations de palmiers à huile, depuis les années 2000, s’est doublée d’un appauvrissement du sol (vite lessivé suite aux brûlis et travaux agricoles), puis d’une pollution du sol par lessivage du mercure, et s’est accompagnée du remplacement de la faune mammalienne originale par un petit nombre d’espèces domestiques ou commensales de l’homme tels que porcs, chiens et souris domestiques. Cette faible biodiversité a favorisé le développement des populations de triatomes (Rhodnius prolixus), des punaises inféodées aux palmiers mais hématophages à l’âge adulte et se nourrissant notamment du sang des humains, entre autres mammifères. Or ces punaises dites ‘réduves’ sont vectrices du trypanosome (Trypanosoma cruzi), un protiste agent de la maladie de Chagas – ou trypanosomiase- chez l’Homme (cf. Fig.18). Face au petit nombre de mammifères ‘culs de sac’ susceptibles de diluer la concentration des parasites dans les espèces vectrices (cf. Regard R18), et face à la grande proximité écologique des humains et de leurs animaux domestiques potentiellement infestés, la maladie de Chagas progresse rapidement depuis quelques années dans la région. Sachant que cette maladie est potentiellement mortelle, la prolifération de punaises vectrices de trypanosomiase cause d’énormes problèmes de santé publique dans les régions concernées (Erazo et al. 2019, Patry et al. 2013).
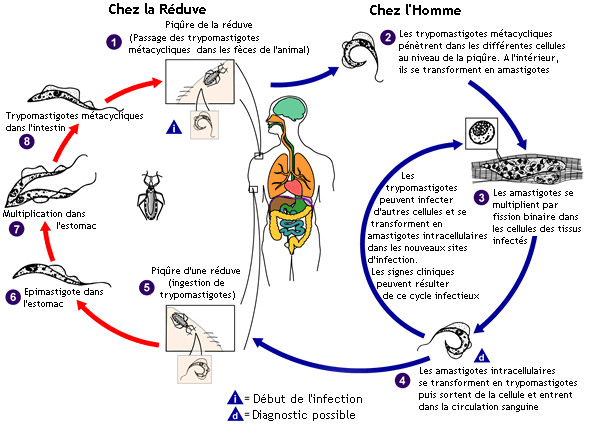
Fig.18 : Cycle de vie du tripanosome (protiste Trypanosoma cruzi), entre son hôte insecte triatome dit ‘réduve’ (Rhodnius prolixus ) et un hôte mammalien, ici un humain. Source : Wikicommons.
Focus n°1 : Quatre grands facteurs d’impact agricole
Depuis les débuts de l’agriculture (apparue indépendamment dans différentes régions du globe) au Néolithique, environ la moitié des habitats terrestres non désertiques ont été convertis en terres agricoles, dont les trois quarts en pâturages pour l’élevage d’animaux domestiques, et le quart restant -les terres les plus fertiles- en champs cultivés (Ellis 2011, Ellis et al. 2020).
1/ et 2/ Dans un premier temps et pendant plusieurs millénaires, l’expansion de l’agriculture sur l’ensemble des continents a eu deux grands types d’impacts sur la biodiversité : i) impacts écologiques et biogéographiques, sur les communautés écologiques concernées, de la conversion de forêts et autres écosystèmes anciens, dits ‘naturels’, en écosystèmes agricoles dominés par les humains (dits agroécosystèmes ou agrosystèmes). Notons que ces impacts comprennent ceux indirects des changements climatiques liés à la conversion de régions forestières en régions agricoles; ii) impacts génétiques et démographiques (démogénétiques), sur les espèces concernées, de la domestication, c’est-à-dire de la sélection dite artificielle, par les éleveurs et agriculteurs, de populations animales et végétales en vue de leur exploitation.
Si elle a ralenti puis cessé en Europe de l’Ouest et dans d’autres régions tempérées depuis un siècle, l’expansion spatiale de l’agriculture n’est pas terminée, loin de là. Elle a pris le relais dans d’autres régions. Tirée par l’augmentation de la demande mondiale en produits agricoles -destinés à de multiples usages, dont l’alimentation du bétail et la production d’agrocarburants- et par la piètre régulation des échanges commerciaux internationaux, mais aussi par la dégradation progressive de sols -par érosion, pollution, salinisation, aridification, … -, la conversion de forêts et autres habitats (semi)naturels pour l’agriculture sévit largement depuis plusieurs décennies en région tropicale – au rythme actuel d’environ 5,5 millions d’hectares par an (Keenan et al. 2015).

Focus 1, Fig.1 : Déforestation en Amazonie, Brésil, 2016. Source : F. Werneck, Acscom/Ibama, CC BY 2.0.
.
3/ Avec la ‘révolution verte’, dans les années 1950, sont apparus d’autres fortes pressions sur la biodiversité (et le climat), liées à l’intensification de l’agriculture. Il s’agit essentiellement de :
. l’utilisation croissante d’engrais synthétiques, pesticides et autres intrants chimiques industriels,
. la réduction du nombre de variétés cultivées, par parcelle (monoculture) et par région (uniformisation des cultures) (voir par ex. Jarvis et al. 2008).
. la mécanisation-standardisation des techniques et la sophistication des machines agricoles,
. l’accroissement de la taille des parcelles cultivées (accessibles aux machines agricoles), avec suppression des haies et bosquets, et plus généralement le remodelage du paysage pour faciliter le passage des engins (et leur utilisation), ce qui a notamment des effets néfastes sur la dynamique hydrique,
. l’utilisation croissante de systèmes d’irrigation et de drainage des eaux sur de grandes surfaces cultivées,
. toutes autres techniques impliquant le remplacement de réseaux et ‘infrastructures’ écologiques locaux (et de main d’œuvre) par des intrants industriels.
Au total, la mise en œuvre de ces techniques s’est traduite par une augmentation –temporaire- des rendements agricoles… au prix d’impacts majeurs sur les paysages, le fonctionnement des écosystèmes et les populations humaines (dont une forte réduction du nombre d’agriculteurs, dans les pays industrialisés) (e.g. MEA 2005).
Cette intensification de l’agriculture au sens strict s’est accompagnée d’une intensification de l’élevage, s’appuyant notamment sur l’alimentation hors pré des animaux, à base de maïs, soja et farines importés. Ce mode d’élevage intensif implique non seulement d’amples changements d’usage de sols distants, pour la culture des plantes importées, mais aussi une dégradation importante des conditions de vie des animaux domestiques, élevés en grand nombre sur de petites surfaces.

Focus 1, fig.2 : Bâtiment d’élevage intensif de poulets, en Floride. Cliché Lana Rana, UDSA (domaine public).
En outre, de nouvelles techniques d’amélioration (sic) des plantes cultivées et animaux d’élevage, telle que la transgénèse, ont été développées au service de cette intensification agricole, avec des impacts –controversés- non seulement sur les populations génétiquement manipulées et cultivées mais aussi sur d’autres populations, espèces et communautés écologiques peuplant les agrosystèmes et habitats voisins (cf. Graef et al. 2012, Kranthi & Stone 2020) [1].
[1] : Sur ce sujet, il faut rappeler ce papier de D. Quist et I.H Chapela (2001) : Transgenic DNA introgressed into traditional maize landraces in Oaxaca, Mexico (Nature 414, 541-543), qui a eu des conséquences terribles pour ses auteurs, du fait de la pression des lobbys semenciers sur le board de Nature et sur le CA de l’université qui employait Chapela (Note de l’Éditeur).
4/ Avec l’évolution et la mondialisation des systèmes de production, commerce et consommation dominants dans les pays riches, les impacts de l’agriculture ont changé de dimension. Alors qu’elle était initialement destinée à l’alimentation locale et régionale, la production agricole est aujourd’hui très largement dédiée à l’exportation (FAO 2020, Kinnunen et al. 2020), avec une pression croissante de consommation des pays développés et émergents en direction d’écosystèmes distants, souvent situés en région tropicale – dans des pays souvent pauvres en devises mais riches en biodiversité (Cahen-Fourot 2020).
Selon Kinnunen et al. (2020), l’agriculture locale de céréales et fourrage ne pourrait aujourd’hui à elle seule satisfaire qu’environ 30% de la demande mondiale. Cet accroissement et cette délocalisation de la demande en produits agricoles non seulement contribuent à l’expansion et intensification actuelle de l’agriculture dans les pays tropicaux, mais va de pair avec l’évolution, mondialisation et standardisation -au delà de l’agriculture- des systèmes agroalimentaires, et donc des chaînes marchandes associées à l’agriculture, qui constituent un quatrième grand facteur d’impact.
Cela regroupe les impacts sur la biosphère de la chaîne marchande liée à la production et la transformation, au stockage et au transport, à la distribution et au recyclage, non seulement des produits agricoles plus ou moins transformés mis sur le marché, mais aussi des matériels et produits entrant dans cette chaîne marchande, qu’ils soient chimiques (engrais, pesticides, antibiotiques, hydrocarbures ‘fossiles’, agrocarburants, …), ‘physiques’ (ex : emballages en plastique) ou mécaniques (ex : machines agricoles, camions..).

Focus 1, fig.3 : Intérieur d’un hypermarché ASDA, à Keighley (U.K., août 2009). Cliché M. Taylor, CC BY-SA 3.0.
Ces quatre grands facteurs d’impacts liés à l’expansion et l’intensification de l’agriculture que sont les changements d’usage des terres, l’intensification des pratiques agricoles, la sélection et manipulation génétique de populations domestiquées, et le développement-standardisation des systèmes agroalimentaires (et donc des chaînes marchandes associées à l’agriculture) combinent bien sûr leurs effets directs et indirects sur la biodiversité et les socio-écosystèmes, dans une spirale ou dynamique ‘ouroborienne’ (voir le texte principal). La part de l’agriculture dans les émissions mondiales de gaz à effet de serre (GES) d’origine ‘anthropique’ affectant la biodiversité, par exemple, ne renvoie pas seulement aux changements d’usage des terres pour l’agriculture (environ 7 Gt eq. CO2/an, cf. GIEC 2019), mais aussi aux émissions de GES supplémentaires liées à la production, au transport, à l’utilisation et au recyclage des produits agricoles et nombreux ‘intrants’ chimiques, physiques et mécaniques de l’agriculture évoqués ci-dessus… dont l’évaluation n’est pas simple !
________________________________________________________________________________________
Focus n°2 : Impact de l’agriculture sur les proportions d’espèces sauvages et domestiques
Schématiquement, l’expansion et surtout l’intensification de l’agriculture peuvent être vues comme une réorientation des réseaux écologiques vers la production, en grandes quantités, de quelques espèces végétales et animales cultivées ou domestiques destinées principalement à l’alimentation humaine. L’un des effets de l’agriculture est alors de réduire la part des espèces sauvages dans la biodiversité, en biomasse.
Difficiles à chiffrer sur de longues périodes et l’ensemble des continents, les estimations d’impact de l’agriculture sur les biomasses mondiales animales et végétales sont très contrastées, selon le groupe systématique considéré.
Pour les végétaux : Erb et al. (2017) évaluent à 10 Gt C, soit 2% environ de la biomasse mondiale actuelle des plantes terrestres (estimée à 450 Gt C), celle des céréales et autres plantes cultivées ; ils estiment par ailleurs à environ 900 Gt C la biomasse végétale terrestre préagricole. En d’autres termes, sous l’impact des activités humaines –de l’agriculture principalement (pour les 2/3), mais aussi de la sylviculture et de l’artificialisation des sols–, la biomasse mondiale des plantes terrestres a diminué de moitié environ depuis le Néolithique, pour faire place à une petite fraction (2% aujourd’hui) de plantes cultivées.

Focus 2, fig.1 : Champ de blé. La biomasse des plantes cultivées n’est qu’une fraction minime (2%) de celle des végétaux terrestres, à l’échelle mondiale. Cliché A. Teyssèdre.
Pour les mammifères et oiseaux terrestres, dont les biomasses sont très inférieures à celles des végétaux, le tableau est différent. Globalement, à l’échelle mondiale, le détournement des réseaux écologiques vers la production d’une minorité d’espèces animales et végétales ‘domestiques’, destinées à l’alimentation et d’autres usages humains, a tout à la fois : i) réduit l’abondance et la biomasse des espèces sauvages (voir plus haut), principalement par ‘conversion’, fragmentation et transformation/pollution de leurs habitats ; ii) augmenté –à partir de zéro– la biomasse des mammifères et oiseaux domestiques, par sélection artificielle et élevage d’espèces ‘agricoles’ dans des écosystèmes modifiés ; iii) augmenté la biomasse totale des mammifères et des oiseaux, aux dépens d’autres groupes d’organismes hétérotrophes tels qu’insectes, batraciens, annélides et champignons.
Ainsi, on peut estimer que la perte –en nombre d’individus– de 30 % des oiseaux terrestres (par opposition aux oiseaux de mer), liée à l’expansion et l’intensification de l’agriculture depuis ses débuts (Gaston 2003, Teyssèdre et Couvet 2007), a réduit d’environ 20% la biomasse totale des oiseaux sauvages, estimée aujourd’hui à deux millions de tonnes de Carbone (Mt C). Pendant la même période, mais surtout depuis l’invention de l’élevage intensif aux USA (dans les années 1930) et sa diffusion en Europe et ailleurs après la deuxième guerre mondiale, la biomasse des poulets et autres oiseaux de « basse-cour » a augmenté pour atteindre aujourd’hui 5 Mt C, soit près de 3 fois celle des oiseaux sauvages (Bar-On et al 2018).
Pour les mammifères, les dynamiques sont encore plus contrastées – même si les différentes estimations ne se recoupent pas exactement. Limitant la période étudiée au seul 20e siècle, V. Smil (2011) estime que la biomasse des mammifères sauvages a été divisée par deux entre 1900 et 2000, chutant de 10 à 5 Mt C, dont 3 Mt C pour les mammifères terrestres (davantage concernés par l’agriculture). Pendant ce temps, la biomasse des grands mammifères domestiques et celle des humains ont toutes deux triplé, pour atteindre respectivement 100 Mt C et 50 Mt C en 2000 (Smil 2011, Bar-On et al. 2018). Au total, la biomasse mondiale des mammifères terrestres a presque triplé au cours du 20e siècle. Elle croît encore aujourd’hui, au détriment notamment des mammifères sauvages et au « bénéfice » discutable (voir ci-dessous) des humains et animaux domestiques, qui en 2018 constituaient ensemble 98% de la biomasse des mammifères terrestres (et 96% de la biomasse mammalienne mondiale, cf. Bar-On et al. 2018).
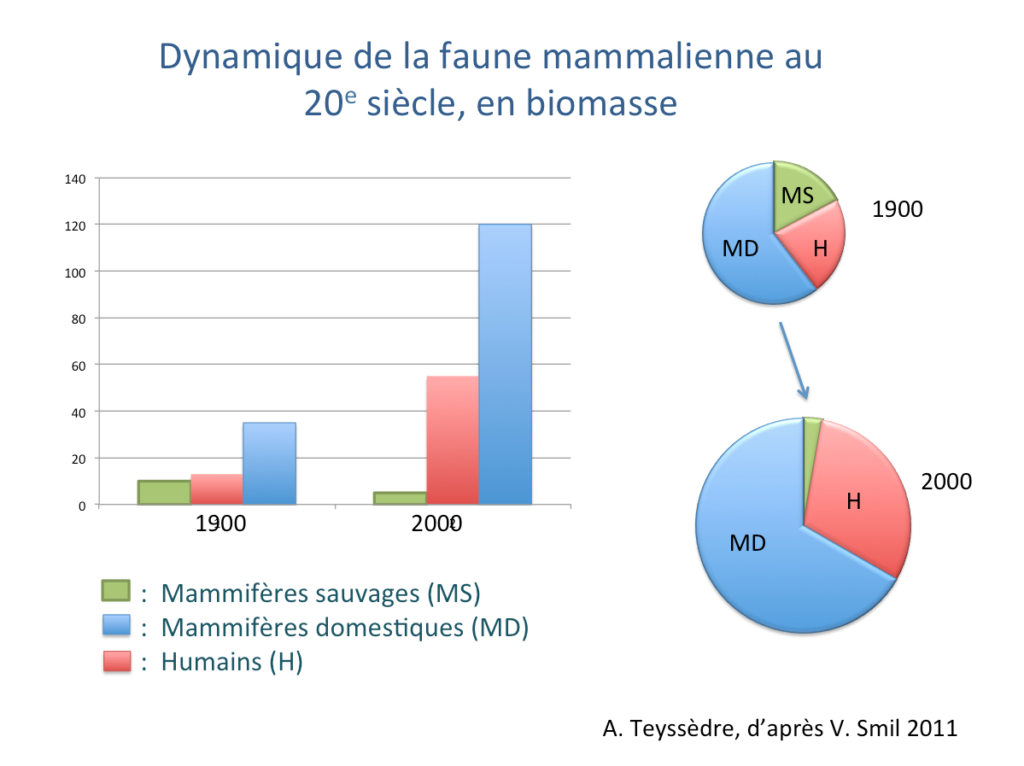
Focus 2, FIg.2 : Evolution de la faune mammalienne au 20e siècle, en biomasse. Schéma A. Teyssèdre, d’après V. Smil 2011.
L’agriculture a donc deux effets opposés sur la dynamique des mammifères et oiseaux, à l’échelle mondiale : elle accroît leur biomasse totale tout en réduisant leur diversité en nombre d’espèces (et de gènes). Quant à l’abondance des populations et communautés, en nombre d’individus, elle décroît en moyenne pour les espèces sauvages (voire plus haut) mais augmente pour les espèces domestiques, aux communautés agricoles monospécifiques.
Soulignons ici que le « bénéfice » de la croissance en biomasse des mammifères et oiseaux domestiques, relativement aux espèces sauvages, est purement numérique. Il concerne des ensembles d’êtres vivants, et peut s’appliquer à la productivité des écosystèmes, mais ne concerne en rien les animaux individuels et leur bien-être. Bien au contraire ! Les pratiques actuelles d’élevage intensif qui ont permis ces augmentations de biomasse ont considérablement dégradé les conditions de vie des poulets, veaux, porcs et autres animaux domestiques, confinés dans des bâtiments dits ‘agricoles’ du jour de leur naissance à celui de leur abattage (cf. https://www.ciwf.fr/ressources/).
Remerciements
Je remercie Sébastien Barot pour ses commentaires sur une première version de cet article, rédigée en janvier 2020 au sein d’un groupe de travail du COS de la Fondation pour la Recherche sur la Biodiversité (FRB) dédié à la transition agroalimentaire. Un grand merci aussi à François Massol pour ses judicieuses remarques et suggestions éditoriales !
Une version légèrement différente de ce Regard, éditée Laurence Desprès et Jacques Joyard, sera mise en ligne cet été dans la section ‘Vivant’ de l’Encyclopédie de l’Environnement. Je remercie ici Laurence et Jacques pour leurs avis et conseils sur ce Regard.
Bibliographie
Aubree F., P. David et al., 2020. How community adaptation affects biodiversity-ecosystem functioning relationships. Ecology Letters 23(8): 1263-1275.
Bar-On Y.M., R. Phillips & R. Milo, 2018. The biomass distribution on Earth. P.N.A.S. 115: 6506-6511.
Cahen-Fourot L., 2020. Contemporary capitalisms and their social relation to the environment. Ecol. Economics 172, 106634.
Cardinale B.J. et al., 2007. Impacts of plant biodiversity on biomass production increase through time because of species complementarity. P.N.A.S. 183: 18123-28.
Cardinale B.J. et al., 2012. Biodiversity loss and its impact on humanity. Nature 486, 59-67.
Clavel J., R. Julliard & V. Devictor, 2011. Worldwide decline of specialist species: toward a global functional homogenization? Front. Ecol. Environ. 9(4): 222–228, doi:10.1890/080216
Couvet D. et al., 2008. Enhancing citizen contributions to biodiversity science and public policy. Interdisciplinary Science Reviews 33 (1) 95-103. http://dx.doi.org/10.1179/030801808X260031.
Couvet D. et A. Teyssèdre, 2010. Ecologie et biodiversité, des populations aux socioécosystèmes. Belin, Paris, 340 pp.
Devictor V. et al., 2008. Functional biotic homogenisation of bird communities in disturbed landscapes. Global Ecol. Biogeogr. 17, 252–261.
Deguines N., Jono C. et al., 2014. Large-scale trade-off between agricultural intensification and pollination services. Frontiers in Ecology and the Environment, 12, 212-217.
Dornelas M. et al., 2014. Assemblage time series reveal biodiversity change but notsystematic loss. Science 344:296–299.
Ellis E.C., 2011. Anthropogenic transformation of the terrestrial biosphere. Phil. Trans. R. Soc. A 369, 1010–1035. doi:10.1098/rsta.2010.0331
Ellis E. C., A.H.W. Beusen & Klein Goldewijk, 2020. Anthropogenic Biomes: 10,000 BCE to 2015 CE. Land 9, 129, 1-19. doi:10.3390/land9050129.
Erazo D., Gottdenker N. L et al., 2019. Generalist host species drive Trypanosoma cruzi vector infection in oil palm plantations in the Orinoco region, Colombia. Parasites & Vectors, 12, 274.
Erb K-H et al., 2017. Unexpectedly large impact of forest management and grazing on global vegetation biomass. Nature 553:73–76.
FAO, 2015. World fertilizer trends and outlooks to 2018. Rome: Food and Agriculture Organization of the United Nations.
(FA0, 2016. www.fao.org/climate-change )
FAO, 2018. Globally Important Agricultural Heritage Systems (GIAHS). Combining agricultural biodiversity, resilient ecosystems, traditional farming practices and cultural identity. Rome: Food and Agriculture Organization of the United Nations. http://www.fao.org/documents/card/en/c/I9187EN
FAO, 2020. The state of food security and nutrition in the world. Rome : Food and Agriculture Organization of the United Nations.
Filippi-Codaccioni, O. et al. 2009. Effects of organic and soil conservation management on specialist bird species. – Agric. Ecosyst. Environ. 129 : 140–143.
Gaston K.J., Tim M. Blackburn and Kees Klein Goldewijk, 2003. Habitat conversion and global avian biodiversity loss. Proc. R. Soc. Lond. B 270, 1293–1300. DOI 10.1098/rspb.2002.2303
GIEC, 2019. Climate and land use changes Report.
Gonzalez A., R.M. Germain et al., 2020. Scaling-up biodiversity-ecosystem functioning research. Ecology Letters 23: 757–776.
Graef F. et al., 2012. A framework for a european network for a systematic environmental impact assessment of genetically modified organisms. BioRisk 7 : 73-97.
Hallman C.A., M. Sorg et al., 2017. More than 75 percent decline over 27 years in total flying insect biomass in protected areas. Plos one 12, e0185809, oct.2017.
Haberl H., K.H. Erb et al., 2007. Quantifying and mapping the human appropriation of net primary production in earth’s terrestrial ecosystems. PNAS 104(31) : 12942–12947.
Hooper D.U., F.S. Chapin III et al., 2005. Effects of biodiversity in ecosystem functioning: a consensus of current knowledge. Ecological Monographs 75(1) : 3–35.
Hubbell S.P., 2001. The Unified Theory of Biodiversity and Biogeography. Princeton Univ. Press.
Jarvis D. I., Brown A. H et al., 2008. A global perspective of the richness and evenness of traditional crop-variety diversity maintained by farming communities. Proceedings of the National Academy of Sciences, 105, 5326-5331.
Julliard R. et al., 2006. Spatial segregation of specialists and generalists in bird communities. Ecology Letters, 9, 1237–1244.
Keenan, R. J., G. A. Reams et al., 2015. Dynamics of Global Forest Area: Results from the FAO Global Forest Resources Assessment 2015. Forest Ecology and Management 352: 9–20.
Kéfi S., V. Miele et al., 2016. How structured is the entangled bank ? The surprinsingly simple organization of multiplex ecological networks leads to increased persistence and resilience. Plos Biology, 3 août 2016. (DOI:10.1371/journal.pbio.1002527)
Kinnunen P. et al., 2020. Local food crop production can fulfil demand for less than one-third of the population. Nature Food 1, 229–237. https://www.nature.com/articles/s43016-020-0060-7
Klein Goldewijk, K. 2001 Estimating global land use change over the past 300 years: the HYDE database. Global Biogeochem. Cycles 15, 417–433.
Kranthi K.R. & G.D. Stone, 2020. Long-term impacts of Bt cotton in India. Nature Plants 6, 188-196.
Labeyrie V., Antona M. et al., 2021. Networking agrobiodiversity management to foster biodiversity-based agriculture. A review. Agronomy for Sustainable Development, 41, 4.
Landi P., H.O. Minoarivelo et al., 2018. Complexity and stability of ecological networks: a review of the theory. Population Ecology 60: 319–345.
Le Viol, I. et al. 2012. More and more generalists: two decades of changes in the European avifauna. – Biol. Lett. 8 : 780–782.
Mc Kinney M.L. & Lockwood, 1999. Biotic homogenization: a few winners replacing many losers in the next mass extinction. T.R.E.E. 14 : 450-453.
Millennium Ecosystem Assessment (MEA), 2005. Ecosystems and Human Well-being: Synthesis, Island Press, Washington DC.
Naeem S, 2002. Ecosystem consequences of biodiversity loss the evolution of a paradigm. Ecology, 83(6) : 1537–1552.
Naeem S et al., 1995. Biodiversity and ecosystem functioning: empirical evidence from experimental microcosms. Endeavour 19:58–63.
(Naeem, S., and S. Li. 1997. Biodiversity enhances ecosystem reliability. Nature 390: 507–509.)
Paredes D., D.S. Karp et al., 2019. Natural habitat increases natural pest control in olive groves: economic implications. Journal of Pest Science, https://doi.org/10.1007/s10340-019-01104-w
Paredes D., J.A. Rosenheim et al., 2020. Landscape simplification increases vineyard pest outbreaks and insecticide use. Ecology Letters, doi: 10.1111/ele.13622
Patry C., Davidson R., Lucotte, M. & A. Béliveau, 2013. Impact of forested fallows on fertility and mercury content in soils of the Tapajós River region, Brazilian Amazon. Science of the Total Environment, 458-460, 228-237.
Pautasso M., Aistara G. et al., 2013. Seed exchange networks for agrobiodiversity conservation. A review. Agron. Sustain. Dev. (2013) 33:151–175.
Pocock M.J.O., D.M. Evans & J. Memmot, 2012. The Robustness and Restoration of a Network of Ecological Networks. Science 335 : 973-976.
Quist D. and I.H. Chapela, 2001. Transgenic DNA introgressed into traditional maize landraces in Oaxaca, Mexico. Nature 414, 541-543.
Renard D. and D. Tilman, 2019. National food production stabilized by crop diversity. Nature 571, 257-260.
Sánchez-Bayo F. & Wyckhuys K.A.G., 2019. Worldwide decline of the entomofauna: A review of its drivers. Biol. Cons. 232: 8–27.
Seibold et al., 2019. Arthropod decline in grasslands and forests is associated with landscape-level drivers. Nature 574: 671-674.
Sirami C., Gross N et al., 2019. Increasing crop heterogeneity enhances multitrophic diversity across agricultural regions. P.NA.S. 116: 16442-16447.
Smil V., 2011. Harvesting the Biosphere : the Human Impact. Pop. Dev. Rev. 37(4) : 613-636.
Steffen W., K. Richardson et al. 2015. Planetary boundaries : Guiding human development on a changing planet. Science 347 (6223) : 736-748.
Teyssèdre A. et D. Couvet, 2007. Expected impact of agriculture expansion on the world avifauna. C. R. Acad. Sci. Biologies 330 : 247-254.
Teyssèdre A. et A. Robert, 2014. Contrasted effects of habitat reduction, conversion and alteration on neutral and non neutral biological communities. Oikos 123: 857–865.
Teyssèdre A. et A. Robert, 2015. Biodiversity trends are as bad as expected. Biodiversity and Conservation 24 (3): 705-706. DOI 10.1007/s10531-014-0839-7
Tilman D., F. Isbell, J. M. Cowles, 2014. Biodiversity and ecosystem functioning. Annu. Rev. Ecol. Evol. Syst. 45 : 471–493.
van Klink et al., 2020. Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science 368 : 417–420.Hooper D.U. et al., 2005. Effects of biodiversity on ecosystem functioning: A consensus of current knowledge. Ecol. Monogr. Ecological Soc. Am. 75, 3–35.
UICN, 2020. Liste mondiale des espèces menacées : https://www.iucnredlist.org/
Zhu Y. et al., 2000. Genetic diversity and desease control in rice. Nature 406, 718-722.
Regards connexes :
Barbault R. et A. Teyssèdre, 2013 : Les humains face aux limites de la biosphère. Regards et débats sur la biodiversité, SFE, Regard R51, 23 novembre 2013.
Teyssèdre A., 2017 : Le modèle IPAT et la transition écologique. Regards et débats sur la biodiversité, SFE, Regard R71, 15 avril 2017.
Teyssèdre A., 2018 : Réponses des espèces et communautés écologiques aux changements globaux. Regards et débats sur la biodiversité, SFE2, Regard R80, juin 2018.
Regards sur l’agriculture : https://www.sfecologie.org/tag/agriculture
Sur les sols : https://sfecologie.org/tag/sols/
Sur les habitats : https://sfecologie.org/tag/habitats/
Sur le fonctionnement des écosystèmes : https://www.sfecologie.org/tag/fonctionnement/
Sur la relation Homme-Nature : https://www.sfecologie.org/tag/relation-homme-nature/
Sur les facteurs d’impact (sur la biodiversité) : https://www.sfecologie.org/tag/facteurs-dimpact/
Sur les changements globaux : https://www.sfecologie.org/tag/changements-globaux/
Sur les enjeux (des changements globaux) : https://www.sfecologie.org/tag/enjeux/
Sur gestion et gouvernance : https://sfecologie.org/tag/gestion-et-gouvernance/
—–
Edition : François Massol, mise en ligne: A. Teyssèdre.
Regard publié dans une version légèrement différente par l’Encyclopédie de l’Environnement ; article en ligne à cette adresse web : https://www.encyclopedie-environnement.org/vivant/impacts-agriculture-biodiversite-fonctionnement-ecosystemes/
——-


Un constat implacable, une vision globale des problèmes liés à l’expansion de l’agriculture, savamment argumentée par de nombreux exemples parmi les travaux les plus récents dans le domaine. Edifiant! On espère que ce regard va être porté à la connaissance de notre tout nouveau ministre, applaudi par la FNSEA et les fédérations de chasse…
Merci infiniment pour ce riche article aussi bien dans la structure et le contenu que dans les références citées !
Depuis le Cameroun !
Merci pour vos commentaires élogieux, jean-François et Pascal !
Pour la question des politiques agricoles à venir: il est vrai que la stratégie de modernisation et technicité accrue de l’agriculture en France (i.e. agriculture de précision ‘télémonitorée’, télésurveillance par drones, etc..), pour une agriculture plus compétitive et rentable, paraît peu propice à la modération des impacts sur la biodiversité, et sur les populations humaines!
[+ Même constat pour le projet d’étendre l’agriculture intensive aux terres en jachère, pour augmenter la production agricole (dans une approche réductrice, monofactorielle).]
Un changement de stratégie dans les mois et années qui viennent paraît nécessaire, mais encore faut-il le demander et le soutenir..
Merci Anne. Excellent « Regard » sur lequel je me permettrai de faire un commentaire.
Le gros pavé de Graeber et Wengrow, « The Dawn of everything », a pour thème l´origine de l´inégalité dans les sociétés, avec en toile de fonds cette idée que c´est l´agriculture qui a généré l´émergence d´une classe dirigeante et de tous ses abus. C´est touffu et long, mais cette visite de tous les types de sociétés depuis le néolithique qu’ils proposent est fascinante et montre que l´inégalité n´est pas constante dans l´histoire de l´humanité, ni obligatoire.
Excellent regard Anne ! Nous avons besoin de ce genre de synthèse pour passer des messages et imaginer collectivement des trajectoires agricoles durables, moins impactantes pour la biodiversité.
Merci, Hélène et Patrick!