Predation des milieux Portuaires – PredaPor
Robin Gauff
Email: Robin.gauff@sb-roscoff.fr
(Version PDF)
Résumé
Les écosystèmes du monde entier sont régulés par trois grands types de mécanismes : bottom-up, top-down et side-in. La régulation bottom-up est la régulation par la base de la chaine alimentaire ou du réseau trophique par la disponibilité en ressource alimentaire. La régulation top-down s’axe sur la prédation et ses effets sur les populations proies. L’effet régulateur des perturbations venant de l’extérieur ou « du côté » de l’écosystème est appelé side-in. De nombreuses études scientifiques se sont données pour but d’élucider l’impact de chacune de ces régulations sur la plupart des écosystèmes, mais leur influence respective sur les écosystèmes urbanisés ou portuaires est moins connue. Alors que des projets de la Station Biologique de Roscoff (CNRS/Sorbonne Université) et la Station Océanologique d’Endoume (Aix-Marseille Université) visent à comprendre les influences bottom-up et side-in, le projet PredaPor, soutenu par la bourse de terrain de la Société Française d’Ecologie et Evolution propose une expérience de terrain simple avec le potentiel de comprendre la régulation top-down.
Le projet se base sur une expérience avec des appâts déployés a différents endroits des ports de Marseille et de Brest. Ces appâts sont comptés à des intervalles réguliers pendant 24h pour suivre leur disparition au cours du temps. Une diminution rapide du nombre d’appâts indique une prédation forte. En parallèle des caméras surveillent les appâts afin de pouvoir identifier les poissons prédateurs.
Cette expérience simple a pu montrer une forte variabilité spatiale de l’intensité de prédation dans les deux ports. Contrairement aux attentes, la prédation n’était pas plus élevée à l’entrée du port ou beaucoup de poissons venant de l’extérieur pourraient circuler, mais plutôt au fond où au milieu du port. Cela indique que, potentiellement, l’abondance de nourriture présente dans les ports attire certains poissons, qui pourraient même être résidents du port. Les caméras montrent que des Sars et des Dorades pourraient contribuer à cette prédation.
L’intensité de cette prédation a pu être corrélée avec des résultats d’une autre expérience se focalisant sur des juvéniles de espèces présents dans le port. Cela montre que la prédation et la régulation top-down ont potentiellement un rôle très important sur la biodiversité portuaire.
Justification
L’urbanisation est un des majeurs enjeux écologiques du 21ème siècle. En artificialisant les habitats, les constructions humaines modifient le fonctionnement des écosystèmes, l’abondance et le succès des espèces locales et introduites ainsi que le comportement des espèces présentes (Glasby et al., 2007; Bleu, 2008; Piola & Johnston, 2008; Bohn et al., 2012; Evans et al., 2015; Megina et al., 2016; Kenworthy et al., 2018). Pendant longtemps l’écologie urbaine s’est uniquement concentrée sur les habitats urbains terrestres. Néanmoins, les thématiques de l’urbanisation marine reçoivent une attention croissante. En Europe, 50% de la côte est modifié par des structures artificielles et le nombre de ports de plaisance, véritables hotspots de l’urbanisation est monté de 180 en 2008 à 473 en 2015 en France (Fed. Fr. Ports de Plaisance ; Obs. Ports de Plaisance). Cela démontre l’importance d’étudier le fonctionnement et la diversité de ces nouveaux habitats. En tant de hotspot de l’urbanisation côtière, les ports de plaisance et les marinas accumulent des enjeux environnementaux, de gestion et des enjeux liés aux cadres de règlementation nationale (DC Statégie pour le Milieu Marin, DC Eau, D Habitat Faune Flore).
Les écosystèmes de la planète entière sont contrôlés par trois grands mécanismes de régulation, bottom-up, top-down et side-in (Hairston et al., 1960; White, 1978; Hunter & Price, 1992). Bottom-up est la régulation par la base de la chaine alimentaire ou du réseau trophique en régulant le niveau trophique N+1 par la disponibilité en ressource en N (White, 1978; Hunter & Price, 1992). La régulation top-down s’axe sur la prédation et ses effets sur les populations au niveau N-1 (Hairston et al., 1960; Hunter & Price, 1992). L’effet régulateur des perturbations venant de l’extérieur ou « du côté » de l’écosystème est appelé side-in (Hairston et al., 1960). De nombreuses études scientifiques se sont données pour but d’élucider l’impact de chacune de ces régulations sur la plupart des écosystèmes, mais leur influence respective sur les écosystèmes urbanisés ou portuaires est moins connue (Smale & Wernberg, 2012; Megina et al., 2016; Oricchio et al., 2016; Rodemann JR & Brandl SJ, 2017). Une des principales faiblesses des recherches menées est la différence des méthodes utilisées et l’utilisation de différents sites de recherche pour chaque mécanisme de régulation. Il est important d’intensifier les recherches sur ces mécanismes de régulation en milieu portuaire et de conduire ces recherches sur les mêmes sites afin de pouvoir distinguer les éléments de ces mécanismes.
Le projet PredaPor, soutenu par la Société Française d’Ecologie et Evolution avec une brousse de terrain s’intègre dans une démarche holistique qui vise à comprendre en détail deux sites portuaires dans l’ensemble de leurs mécanismes de régulations. Une collaboration entre la Station Biologique de Roscoff (Sorbonne Université) et la Station Marine d’Endoume (Aix Marseille Université) existe et vise à étudier les régulations bottom-up en s’intéressant au phytoplancton (PhytoPort ; direction : N. Simon & D. Davoult, avec ma participation) et les régulations side-in par les perturbations anthropiques (projet de thèse PorDiFo, Robin Gauff sous la direction de Dominique Davoult et Christophe Lejeusne). Si les projets PhytoPort et PorDiFo doivent permettre de comprendre les impacts des régulations bottom-up et side-in sur la structuration de la communauté à petite échelle spatiale (< 50 m), l’étude de l’influence de la régulation top-down (PredaPor) apporte une compréhension complémentaire.
Le but de PredaPor était d’élaborer une mission de terrain sur deux ports utilisés pour les autres études afin de quantifier le risque de prédation à différentes stations de ceux-ci. Une expérience de nourrissage, inspirée d’un protocole largement utilisé en milieu naturel et urbanisé a été utilisée afin de quantifier ce risque. On envisageait à des variations du risque de prédation, donc de la régulation top-down sur cette petite échelle avec des gradients d’intensité de prédation, pouvant influencer la composition des communautés locales et influençant la survie de recrues de deux espèces clefs de la communauté.
Méthodes
Site d’étude
Le projet se concentre sur le niveau de prédation présent sur deux façades maritimes, l’Atlantique et la Méditerranée. Dans les deux cas, des ports avec un contexte d’urbanisation marine prononcée et situé à proximité immédiate de ports de commerce ou militaires ont été sélectionnés. Sur la façade atlantique, le Port du Château de Brest est un excellent candidat avec des travaux déjà effectués sur les communautés présentes (Kenworthy et al., 2018). En Méditerranée le Vieux Port de Marseille propose des conditions similaires à celles du Port du Château à Brest. Le principe d’échantillonnage est d’intégrer la variation locale à petite échelle avec des stations à l’entrée, au milieu jusqu’au fond du port. Les mesures sont faites à proximité immédiate des pontons flottants. A Marseille, uniquement le ponton au fond et à l’entrée ont pu être utilisés dû à la présence d’une régate pendant l’échantillonnage. Les expériences ont été menées en une semaine mi-juin à Marseille et en juillet sur trois semaines à Brest.
Mesure du risque
La mesure de la pression de prédation a été réalisée en se concentrant sur l’activité des prédateurs en utilisant une expérience de nourrissage (Fig. 1). Le protocole se base sur une expérience proposée par Duffy et al. (2015), qui consiste à placer des piquets appâtés sur un transect. Des morceaux ronds (11 mm) de calmar sont disposés sur 25 piquets en fibre de verre (densité plus élevée que l’eau, non corrosif) de 1m de longueur et disposés à une distance d’1 m l’un de l’autre sur un transect de 25 m. Leur consommation est suivie au cours du temps. Un plongeur compte le nombre d’appâts restants à 1h, 3h, 6h, 25h après le déploiement de l’expérience. Cette procédure permet d’élaborer des analyses de survie classiques donnant des indices sur l’activité des prédateurs présents (Pyke & Thompson, 1986; Rich et al., 2010; Gauff et al., 2018). Cette expérience a été imaginé en configuration flottante, mais la praticité et la discrétion conféré par la suspension des transects sous le ponton a été préférée (Fig. 1).
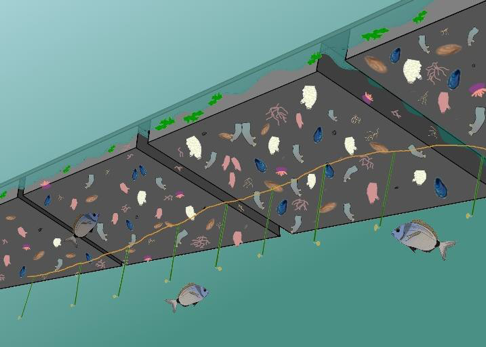
Fig. 1 : Représentation de l’expérimentation PredaPor. Un bout avec les appâts, suspendu sous les pontons flottants.
Afin d’identifier les prédateurs consommant les appâts, 24 observatoires stationnaires ont été déployés à côté des expériences de nourrissage (Duffy et al., 2015; Rodemann JR & Brandl SJ, 2017; Gauff et al., 2018). Les caméras GoPro ont été dirigées de manière à observer plusieurs bâtons appâtés jusqu’à épuisement de batterie (Fig. 2). Des timelapse avec un espace photo de 0,5 secondes permettent de capturer les poissons tout en conservant une autonomie maximale. Un total de 60h de surveillance des appâts a pu ainsi être analysé.

Fig. 2 : Vue d’un observatoire stationnaire sur l’expérience de nourrissage à Marseille. Un Sar commun attaque.
Exploration statistique
Les données acquises à travers l’expérience de prédation ont être étudiées par le biais d’une analyse de survie. Des courbes Kaplan-Meier distinguant les intensités d’activité de prédation pour chaque site et ponton ont été élaborées et une comparaison multiple Log-Rank pour tester les différences statistiquement significatives pour les zones d’études a été faite (Pyke & Thompson, 1986; Rich et al., 2010).
Résultats et discussion
Les courbes Kaplan-Meier comparant Brest et Marseille (Fig. 3a) ainsi que les comparaisons des pontons à Brest (Fig. 3b) et Marseille (Fig. 3c) montrent des différences de la survie des appâts déployés. En premier temps il est possible d’observer une différence très significative entre les sites de Brest et Marseille (p=2e-16, Fig. 3a). La variabilité intra port est également démontré à Brest, ou les pontons du fond et intermédiaire sont significativement différents (p=0.0069, Fig. 3b), et à Marseille ou le ponton le plus au fond a une prédation nettement plus élevée que le ponton à l’entrée (p=2e-16, Fig. 3c).
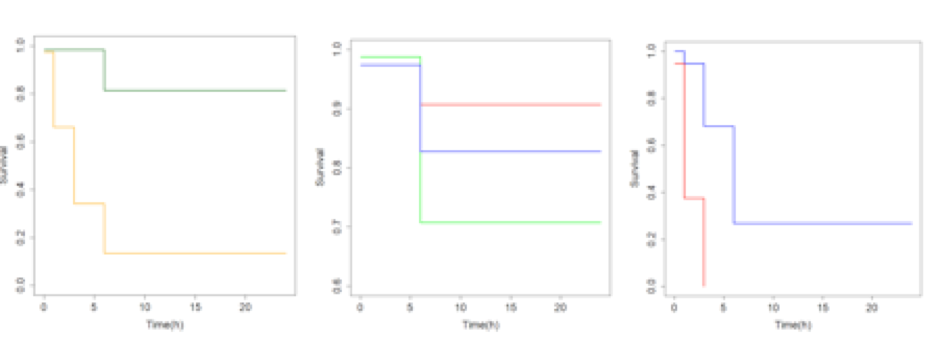
Fig. 3 : Courbes Kaplan-Meier comparant la disparition au cours du temps des appâts. Une disparition rapide indique une forte prédation. a) Courbes des ports en totalité (Brest, vert. Marseille, jaune). b) Courbes entre les pontons de Brest (Ponton Fond, rouge. Ponton intermédiaire, vert. Ponton entrée, bleu). c) Courbes des pontons de Marseille (Ponton fond, rouge. Ponton entrée, bleu)
L’identification des consommateurs n’a pas permis d’observer suffisamment d’événements de prédation pour être exploité. Les six événements de prédation observé ont été exercé par quatre Sars communs, Diplodus sargus (Linnaeus, 1758) à Marseille et deux Dorades grises, Spondyliosoma cantharus (Linnaeus, 1758) à Brest.
L’expérience a permis de démontrer une variabilité à très petite échèle de l’intensité de prédation dans les deux ports. Contrairement aux attentes, la prédation n’était pas plus élevée
à l’entrée du port ou beaucoup de poissons venant de l’extérieur pourraient circuler, mais plutôt au fond où au milieu du port. Cela indique que, potentiellement, quelque chose présent dans les ports attire certains poissons, qui pourraient même être résidents du port. Il est intéressant à observer que l’intensité de prédation dans les ports de Brest et de Marseille est nettement moins élevée qu’attendu. Une consommation de 50% a pu être observé après 1h sur un des pontons à Marseille, et n’a jamais été atteint, même après 24h à Brest. Ce temps d’expérimentation très rallongé a résulté dans des changements majeurs du plan d’échantillonnage.
L’expérience PredaPor indique une piste intéressante pour des futures recherches visant à déterminer l’effet de la régulation top-down à très petite échèle. La combinaison des résultats avec les projets Phytoport et PorDiFo permet une approche holistique pour comprendre chaque mode de régulation des communautés locales. Additionnellement une autre expérience visant à comprendre l’influence de la prédation sur la survie de jeunes recrues de deux espèces clefs du port de Brest a été conduite sur la même période. Le couplage de PredaPor avec cette expérience a montré que la survie de juvéniles d’ascidies (cages d’exclusions de prédateurs) est corrélée avec l’intensité de prédation mesuré par PredaPor. Cela montre que la régulation top-down a probablement un rôle important dans les communautés portuaires.
Références
Acero, a., & Betancur, R. 2016. Siluriformes: Ariidae. living Mar. Resour. East. Cent. Atl. Vol.3 Bony fishes part 1 (Elopiformes to Scorpaeniformes) 3, 1742–1750.
Bleu, P. 2008. Résistance écologique au changement global dans les écosystèmes marins , littoraux et urbains de Méditerranée Contexte scientifique et question générale.
Boaden, A. E., & Kingsford, M. J. 2015. Predators drive community structure in coral reef fish assemblages. Ecosphere 6, 1–33 https://doi.org/10.1890/ES14-00292.1.
Bohn, K., Macleod, A., & Maggs, C. A. 2012. Changing coasts : Marine Aliens and Artificial Structures., 189–234.
Duffy, J. E., Ziegler, S. L., Campbell, J. E., Bippus, P. M., & Lefcheck, J. S. 2015. Squidpops: A Simple Tool to Crowdsource a Global Map of Marine Predation Intensity. PLoS One 10, e0142994 https://doi.org/10.1371/journal.pone.0142994.
Estes, J. A., Peterson, C. H., & Steneck, R. 2010. Some Effects of Apex Predators in Higher– Latitude Coastal Oceans.Pages 37–53 in Throphic Cascades: Predators, Prey, And the Changing Dynamica of Nature.
Evans, K. L., Botanic, R., Melbourne, G., & Sciences, P. 2015. Expanding fundamental ecological knowledge by studying urban ecosystems. https://doi.org/10.1111/1365-2435.12488.
Gauff, R. P. M. 2018. Caractérisation Environnementale des Récifs Rocheux Et Lagons de l’Arboretum Raponda Walker. Libreville.
Gauff, R. P. M., Bejarano, S., Madduppa, H. H., Subhan, B., Dugény, E. M. A., Perdana, Y. A., & Ferse, S. C. A. 2018. Influence of predation risk on the sheltering behaviour of the coral- dwelling damselfish, Pomacentrus moluccensis. Environ. Biol. Fishes 101, 639–651 https://doi.org/10.1007/s10641-018-0725-3.
Glasby, T. M., Connell, S. D., Holloway, M. G., & Hewitt, C. L. 2007. Nonindigenous biota on arti W cial structures : could habitat creation facilitate biological invasions ? , 887–895 https://doi.org/10.1007/s00227-006-0552-5.
Hairston, N. G., Smith, F. E., & Slobodkin, L. B. 1960. Community Structure, Population Control, and Competition. Am. Nat. 94, 421–425 https://doi.org/10.2307/2458808.
Hunter, M. D., & Price, P. W. 1992. Playing Chutes and Ladders: Heterogeneity and the Relative Roles of Bottom-Up and Top-Down Forces in Natural Communities. Ecology 73,724–732 https://doi.org/10.2307/1940152.
Kenworthy, J. M., Rolland, G., Samadi, S., & Lejeusne, C. 2018. Local variation within marinas: Effects of pollutants and implications for invasive species. Mar. Pollut. Bull. 133, 96–106 https://doi.org/10.1016/j.marpolbul.2018.05.001.
Lima, S. L., & Dill, L. M. 1990. Behavioral decisions made under the risk of predation: a review and prospectus. Can. J. Zool. 68, 619–640 https://doi.org/10.1139/z90-092.
Lind, J., & Cresswell, W. 2005. Determining the fitness consequences of antipredation behavior. Behav. Ecol. 16, 945–956 https://doi.org/10.1093/beheco/ari075.
Megina, C., González-Duarte, M. M., & López-González, P. J. 2016. Benthic assemblages, biodiversity and invasiveness in marinas and commercial harbours: an investigation using a bioindicator group. Biofouling 32 https://doi.org/10.1080/08927014.2016.1151500.
Oricchio, F. T., Pastro, G., Vieira, E. A., Flores, A. A. V, Gibran, F. Z., & Dias, G. M. 2016. Distinct community dynamics at two artificial habitats in a recreational marina. Mar. Environ. Res. 122, 85–92 https://doi.org/10.1016/j.marenvres.2016.09.010.
Piola, R. F., & Johnston, E. L. 2008. Pollution reduces native diversity and increases invader dominance in marine hard-substrate communities. , 329–342 https://doi.org/10.1111/j.1472-4642.2007.00430.x.
Pyke, D. A., & Thompson, J. N. 1986. Statistical Analysis of Survival and Removal Rate Experiments. Ecology 67, 240–245 https://doi.org/10.2307/1938523.
Rich, J. T., Neely, J. G., Paniello, R. C., Voelker, C. C., Nussenbaum, B., & Wang, E. W. 2010. A Practival Guide to Understand Kaplan-Meier Curves. Otolaryngol Head Neck Surg. 143, 331–336 https://doi.org/10.1016/j.otohns.2010.05.007.A.
Ritchie, E. G., & Johnson, C. N. 2009. Predator interactions , mesopredator release and biodiversity conservation. Ecol. Lett. 12, 982–998 https://doi.org/10.1111/j.1461-0248.2009.01347.x.
Rodemann JR, & Brandl SJ. 2017. Consumption pressure in coastal marine environments decreases with latitude and in artificial vs. natural habitats. Mar. Ecol. Prog. Ser. 574, 167–179 https://doi.org/10.3354/meps12170.
Smale, D. A., & Wernberg, T. 2012. Short-term in situ warming influences early developpment of sessile assemblages. Mar. Ecol. Prog. Ser. 453, 129–136 https://doi.org/10.3354/meps09680.
Steele, J. H. 1985. A comparison of terrestrial and marine ecological systems. Nature 313, 355–358 https://doi.org/10.1038/313355a0.
White, T. C. R. 1978. The importance of a relative shortage of food in animal ecology. Oecologia 33, 71–86 https://doi.org/10.1007/BF00376997.

Commentaires récents