Utilisation de signaux acoustiques hétérospécifiques pour estimer la qualité de l’habitat à fine échelle : expérience sur le choix d’habitat de reproduction chez le gobe-mouche à collier (Ficedula albicollis)
Jennifer Morinay
Laboratoire de Biométrie et Biologie Evolutive (LBBE)
Université Lyon 1 – CNRS UMR 5558
43, boulevard du 11 novembre 1918 – Bâtiment Gregor Mendel
F – 69622 Villeurbanne Cedex
FRANCE
Email: jennifer.morinay@univ-lyon1.fr
(Version PDF)
Résumé
Ne vous est-il jamais arrivé, avant de prendre une décision importante, de regarder ce que les autres ont décidé avant vous, et si cela leur a été bénéfique ? En observant les conséquences des décisions des individus alentours, on récolte ce que l’on appelle de l’information « sociale ». Ce comportement est présent chez de nombreuses espèces, et ce pour divers types de décisions (choix de site d’alimentation ou de reproduction, choix de partenaire, etc.).
Mon projet de recherche vise à comprendre l’importance de ce glanage d’informations sociales chez les oiseaux pour une prise de décision à fort enjeux pour la survie individuelle et celle de la progéniture : le choix d’habitat de reproduction. Je m’attache notamment à comprendre quelles informations sociales exactes sont utilisées par les gobe-mouches à collier, une espèce aviaire modèle. Les gobe-mouches à collier observent leurs congénères mais aussi les mésanges charbonnières, et glanent ainsi des informations sur leur présence, leur investissement dans la reproduction ou leur succès reproducteur. Ils utilisent ensuite ces informations pour prendre la décision de s’installer dans cet habitat ou dans un autre.
L’objectif du projet plus particulier pour lequel j’ai obtenu le soutien de la SFE vise à tester si, outre la présence, l’investissement, ou le succès des compétiteurs, les gobe-mouches n’utiliseraient pas une autre source d’information, facilement accessible, pour discriminer un habitat favorable : les caractéristiques de chants des mésanges charbonnières, traits sexuels secondaires indicateur de la qualité des mésanges. L’hypothèse sous-jacente est qu’une mésange « de bonne qualité », devrait s’être installée dans un habitat de bonne qualité ou bien être capable d’extraire efficacement la ressource de l’habitat.
Pour répondre à cette question, nous avons mis en place au printemps 2017 un protocole expérimental de repasse acoustique de chants de mésanges mimant des mésanges de qualité différentes, et nous avons observé l’installation des gobe-mouches à proximité. Nous avons également diffusé des chants de pinson des arbres, comme espèce contrôle.
A l’échelle de la saison, il n’y a pas eu de préférence nette d’installation à proximité de l’un ou l’autre des traitements. Cependant, les gobe-mouches précoces (date de ponte tôt) se sont installés préférentiellement à proximité des zones avec une repasse de mésange « de moins bonne qualité apparente ». Ces mêmes gobe-mouches ont également pondu plus vite après leur début d’installation que les autres gobe-mouches. De plus, la dynamique d’installation a été fortement influencée par les variations de températures, et le début de printemps a été globalement très rigoureux en termes de température. De plus amples analyses sur l’effet de caractéristiques individuelles telles que l’âge ou l’agressivité des individus installés par exemple sont prévues pour la suite de ce projet.
Justification
La qualité de l’habitat de reproduction influence fortement le succès reproducteur chez de nombreuses espèces. La sélection naturelle doit donc favoriser des stratégies permettant aux individus d’optimiser leurs prises de décisions pour le choix de l’habitat de reproduction. Les individus peuvent notamment utiliser différentes sources d’informations disponibles dans l’environnement, qui reflètent la qualité des différents sites de reproduction, leur permettant de choisir entre sites de façon optimale (ref 1,2). La qualité intrinsèque des individus peut représenter une information témoignant de la qualité de l’habitat occupé. Les individus peuvent être en bonne condition car vivants dans un habitat riche, ou bien les individus de « bonne qualité », via leur plus forte compétitivité, peuvent avoir accès à de meilleurs habitats. Des pressions de sélection devraient donc favoriser des stratégies limitant les interactions avec les compétiteurs, mais qui permettraient à l’individu collectant l’information d’estimer soit la qualité des individus informatifs soit leur valeur sélective dans l’habitat. Les signaux acoustiques par exemple sont facilement accessibles, et constituent donc des informations peu couteuses à récolter. Ils représentent de façon fiable la qualité de l’individu produisant le signal du fait de fortes pressions de sélection sexuelle. Il existe plusieurs études portant sur l’attraction conspécifique due à de la repasse (ref 3). Les exemples à l’échelle hétérospécifique sont plus rares. Certains parasites de ponte par exemple se basent sur des traits sélectionnés sexuellement pour estimer la qualité des parents adoptifs (ref 4).
L’objectif de ce projet était de tester expérimentalement si les gobe-mouches à collier (Ficedula albicollis, Fig. 1) utilisent l’information de qualité individuelle contenue dans les chants des mésanges charbonnières (Parus major), pour choisir leur habitat de reproduction. Les gobe-mouches à collier partagent en partie leur niche écologique avec les mésanges charbonnières. Des études empiriques et expérimentales ont mis en évidence que les gobe-mouches à collier et les gobe-mouches noirs, une espèce proche, utilisent de l’information sociale à la fois conspécifique et hétérospécifique (présence et performances reproductives) de façon complexe pour ajuster leurs décisions de choix d’habitat de reproduction, et ce, à différentes échelles spatiales (à l’échelle du site local, ou de la forêt) (ref 5–7). On peut donc s’attendre à ce que les gobe-mouches se basent également sur d’autres indices de la qualité des mésanges ou de leur habitat, indices qui seraient moins couteux à récolter, comme des traits phénotypiques (par exemple la taille), ou des traits sexuels secondaires (par exemple la coloration ou les caractéristiques de chants). Les traits sexuels secondaires acoustiques tels que la taille de répertoire de chants, ou la longueur de strophes sont liés à la qualité des mésanges charbonnières (leur succès reproducteur au cours de la vie ou leur dominance, et donc par extension leur capacité à s’installer dans de bons habitats) (ref 8,9). Ce projet visait à expérimentalement tester si les gobe-mouches utilisent les signaux acoustiques des mésanges pour leur choix d’habitat de reproduction à petite échelle. Nous avons tout d’abord testé s’il y avait attraction hétérospécifique du simple fait de diffusion de chants de mésanges au moment de la prospection et l’installation des gobe-mouches, et nous avons également testé si les gobe-mouches discriminaient des chants de mésanges à partir des caractéristiques de taille de répertoire et longueur de strophes, en s’installant préférentiellement à proximité de mésanges charbonnières qui seraient de meilleure qualité.
Méthodes
Espèce et site d’étude
Le projet a été conduit dans une population naturelle de gobe-mouches à collier sur l’île de Gotland (mer Baltique, Suède). Le site d’étude comprend une large population d’étude (500 à 700 couples reproducteurs chaque année), fragmentée en plusieurs zones forestières, et qui a été intensément suivie depuis le début des années 80 (Fig. 2).
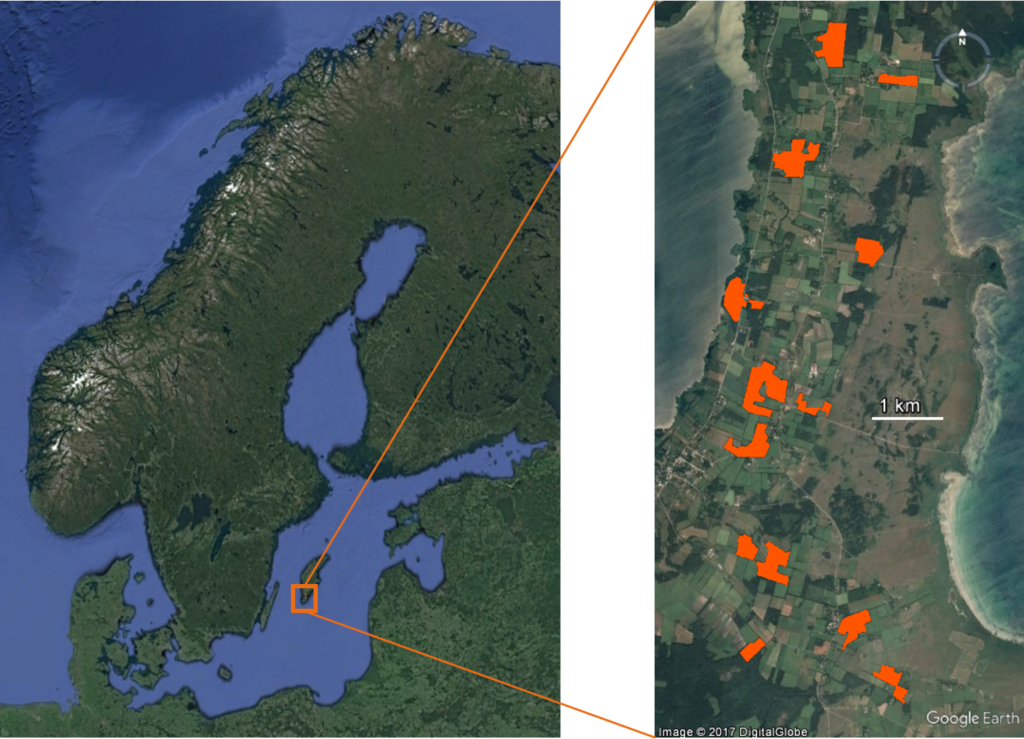
Fig 2. Zone d’étude sur l’île de Gotland (Suède, à gauche). Les bois expérimentaux (à droite), de tailles variées, sont représentés en orange.
Protocole expérimental
Pendant la période d’installation des gobe-mouches (du 25 avril au 20 mai environ), nous avons diffusé dans de petites zones expérimentales (i) soit des chants de mésange charbonnière présentant les caractéristiques d’une mésange de bonne qualité (grand répertoire, et strophes longues ; « mésange compétitive »), (ii) soit des chants de mésange charbonnière présentant les caractéristiques d’une mésange de moins bonne qualité (petit répertoire et strophes courtes ; « mésange non compétitive »), (iii) soit comme contrôle des chants de pinson des arbres Fringilla coelebs, espèce avec laquelle les gobe-mouches ne partagent pas leur niche écologique mais qui ne leur est pas étrangère pour autant.
Chaque zone expérimentale comportait 5 nichoirs vides, répartis dans un cercle de 60 mètres de diamètre environ. A proximité du nichoir central, nous avons placé le haut-parleur de la zone à environ 2 mètres de hauteur. Les chants étaient diffusés à un amplitude de 85-90dB (A), de l’aube au coucher du soleil, à raison de 10 minutes de chants toutes les 30 minutes jusque 3 heures après l’aube, et 10 minutes de chants toutes les heures le reste de la journée, comme suggéré dans une étude précédente (Fig. 3). Nous avions au total 58 zones expérimentales, réparties dans 13 forêts, et séparées d’au moins 100m de zone forestière chacune. Pour éviter la pseudo-réplication, nous avons utilisé 4 pistes audio différentes pour chaque traitement, et seulement les chants d’un même individu dans chaque piste (en cas de reconnaissance individuelle). Les nichoirs des zones expérimentales étaient visités tous les jours afin de détecter tout nouveau signe d’installation de gobe-mouches (présence de brindilles en cercle au fond du nichoir).

Fig 3. Structure des trois types de repasses: (a) organisation des périodes de diffusion au cours de la journée, toute les 30 minutes de l’aube à trois heures plus tard, puis toutes les heures jusqu’au crépuscule, (b) structure d’une repasse de mésange (charbonnière) compétitive, (c) structure d’une repasse de mésange non compétitive ou d’un pinson des arbres. Les lettres (A,B,C, etc.) distinguent différents types de strophes ou de phrases. Les durées de chant et de pause sont indiquées sous les sections représentatives (m pour minutes et s pour secondes).
Analyses statistiques
Nous avons analysé la probabilité d’installation dans chaque nichoir avec un modèle de Cox en contrôlant pour le traitement diffusé (chants d’une mésange compétitive, chants d’une mésange non compétitive, chants de pinson des arbres) et la forêt en effet aléatoire (frailty). Nous avons analysé la date d’installation, la date de ponte du premier œuf, et l’écart entre ces deux dates, en fonction du traitement acoustique de la zone où ils se sont installés. Nous avons utilisé pour se faire des modèles linéaires mixtes. Nous avons ajouté la température minimale au jour de choix en effet fixe, ainsi que l’identifiant de la forêt, de la zone expérimentale, et de la piste audio diffusée en facteurs aléatoires. Les analyses ont été conduites avec le logiciel R, et les package survival (ref 10) et lme4 (ref 11).
Résultats et discussion
Au total, 103 couples de gobe-mouches se sont installés dans nos nichoirs expérimentaux, dont 87 qui ont pondu avec succès. La proportion de nichoirs occupés par des gobe-mouches ne différaient pas significativement selon les traitements et était de 35.6% pour le traitement mésange compétitive, 28.4% pour le traitement mésange non compétitive, et 42.1% pour le traitement contrôle (χ2(2)= 2.00, p-value = 0.37). Ces résultats ont été confirmés par le modèle de cox, en contrôlant pour le bois d’origine (LR test, Wald test et Score test = 1.0 (ddl=2), p-values > 0.6). Les gobe-mouches ne se sont donc globalement pas installé préférentiellement à proximité d’un type de repasse, même s’il semble y avoir une tendance pour une plus faible installation près de mésanges non compétitives.

Fig 4. Histogramme des températures minimales journalières et dynamique d’installation selon les trois traitements expérimentaux. Le jour 1 correspond au 4 mai 2017.
Les dynamiques d’installation des gobe-mouches ont été affectées par la température minimale (Fig. 4). La date de ponte et le délai entre le début de l’installation et la ponte étaient négativement affecté par la température minimale (avec un effet quadratique positif pour la date de ponte): plus il fait froid, plus la phénologie est décalée dans le temps. De même, les gobe-mouches s’étant installés à proximité du traitement de mésange non compétitive ont pondu plus tôt, et ont eu un délai entre l’installation et la ponte plus court que les gobe-mouches installés dans les autres zones. S’il n’y a pas de préférence globale pour un type de traitement (à l’échelle de la saison), il semble qu’il y ait tout de même eu une préférence à l’installation, le traitement « mésange non compétitive » ayant été privilégiés par les individus les plus précoces. Ceci pourrait s’expliquer par le fait qu’en début de saison (d’avril à début mai), les températures étaient très basses : en conditions climatiques difficiles, les individus privilégieraient de s’installer à proximité de mésange (comme indicatrice d’une bonne qualité d’habitat), mais peu compétitive afin de pouvoir endurer la compétition en cas de faible quantité de ressources (ref 12). Cette hypothèse serait cohérente avec le fait que lorsque les températures ont remonté, le traitement « mésange compétitive » semble avoir été privilégié pendant quelques jours. Ces hypothèses ne sont malheureusement pas vérifiables avec les données disponibles.
Une fois les données individuelles disponibles, nous pourrons tester l’effet de l’âge des mâles et des femelles, ainsi que de leur agressivité sur le choix d’installation dans un type de traitement de repasse. En effet, nous pouvons nous attendre à ce que les jeunes individus, i.e. inexpérimentés, évitent la trop forte compétition avec les mésanges, alors que les individus plus âgés, plus compétitifs, pourraient prendre le risque d’endurer cette compétition pour un habitat sensément de bonne qualité. Enfin, nous pouvons nous attendre à ce que seuls les individus ou couples les plus agressifs prendraient le risque de s’installer dans le traitement de mésange compétitive.
Références
1. Danchin, E., Giraldeau, L.-A., Valone, T. J. & Wagner, R. H. Public information: from nosy neighbors to cultural evolution. Science. 305, 487–491 (2004).
2. Dall, S. R. X., Giraldeau, L.-A., Olsson, O., McNamara, J. M. & Stephens, D. W. Information and its use by animals in evolutionary ecology. Trends Ecol. Evol. 20, 187–193 (2005).
3. Hahn, B. A. & Silverman, E. D. Social cues facilitate habitat selection: American redstarts establish breeding territories in response to song. Biol. Lett. 2, 337–340 (2006).
4. Parejo, D. & Avilés, J. M. Do avian brood parasites eavesdrop on heterospecific sexual signals revealing host quality? A review of the evidence. Anim. Cogn. 10, 81–88 (2007).
5. Doligez, B., Pärt, T., Danchin, E., Clobert, J. & Gustafsson, L. Availability and use of public information and conspecific density for settlement decisions in the collared flycatcher. J. Anim. Ecol. 41, 75–87 (2004).
6. Jaakkonen, T., Kari, A. & Forsman, J. T. Flycatchers copy conspecifics in nest-site selection but neither personal experience nor frequency of tutors have an effect. PLoS One 8, e60395 (2013).
7. Seppänen, J.-T. & Forsman, J. T. Interspecific social learning: novel preference can be acquired from a competing species. Curr. Biol. 17, 1248–1252 (2007).
8. McGregor, P. K., Krebs, J. R. & Perrins, C. Song repertoires and lifetime reproductive success in the great tit (Parus major). Am. Nat. 118, 149–159 (1981).
9. Lambrechts, M. & Dhondt, A. a. Male quality, reproduction, and survival in the great tit (Parus major). Behav. Ecol. Sociobiol. 19, 57–63 (1986).
10. Therneau, T. M. Survival analysis. R package version 2.41-2.
11. Bates, D. et al. Linear Mixed-Effects Models using ‘Eigen’ and S4. R package version 1.1-12.
12. Mönkkönen, M. & Forsman, J. T. Heterospecific attraction among forest birds: a review. Ornithol. Sci. 1, 41–51 (2002).



Commentaires récents