Etude des relations entre facteurs paysagers, risque de prédation et densité de populations de Souris sylvestre (Peromyscus maniculatus) et de Campagnols à dos roux de Gapper (Myodes gapperi) en milieu insulaire
Tristan Juette
Département des Sciences Biologiques
Université du Québec À Montréal (UQÀM),
Montréal, Québec, Canada
tristanjuette (at) hotmail.com
Résumé
Les milieux insulaires, généralement moins complexes que les milieux continentaux, offrent un cadre idéal pour la compréhension des relations entre différents niveaux d’organisation écologique. Ils permettent d’étudier différents processus écologiques et évolutifs au sein de paysages naturellement fragmentés. Pour ces raisons, ils ont d’ailleurs fait l’objet d’une attention croissante de la part des scientifiques dans la seconde moitié du XXème siècle. Dans le cadre de cette étude nous nous sommes intéressés aux relations entre facteurs paysagers, communauté de prédateurs terrestres et communauté de proies terrestres au sein d’un réseau insulaire. Nous avons mesuré la diversité ainsi que la densité d’espèces prédatrices et la densité de micromammifères terrestres. Cette étude avait quatre objectifs : étudier la relation entre le type de paysage (continent ou île) et la surface des îles avec (i) les caractéristiques de la communauté de prédateurs terrestres et (ii) avec la densité des populations composant la communauté de micromammifères. Nous avons ensuite étudié (iii) les relations entre le risque de prédation et les densités de proies sur les différents sites et enfin (iv) les relations de compétions interspécifiques au sein de la communauté de micromammifères. Pour répondre à ces objectifs nous avons mené une campagne d’échantillonnage sur 5 sites continentaux et 12 sites insulaires situés sur la rivière Winnipeg dans la province de l’Ontario au Canada. Il en ressort que la communauté de micromammifères est, au sein de notre aire d’étude, composée majoritairement de deux espèces : la Souris sylvestre (Peromyscus maniculatus) et le Campagnol à dos roux de Gapper (Myodes gapperi). La communauté de prédateurs terrestres est quant à elle représentée par cinq espèces. Nous avons mis en évidence que les facteurs paysagers et plus spécifiquement la surface des îles tend à influencer la densité des populations de Campagnols à dos roux mais pas celle des populations de Souris sylvestre ni la densité de prédateurs. Egalement, la relation entre les densités des deux populations de Campagnols et de Souris est significativement négative. Cette relation étant probablement la résultante de l’exclusion compétitive entre les deux espèces ou d’un choix différentiel d’habitat. Enfin, la densité de Souris est significativement et positivement corrélée à l’activité des prédateurs, proxy du risque de prédation, démontrant l’existence probable d’un contrôle ascendant (bottom-up) des populations de Souris sur la communauté de prédateurs. Cette étude a ainsi permis de mettre en évidence l’existence de liens entre différents niveaux écologiques : paysage, communautés, populations et ce de manière empirique et sur une aire d’étude naturelle.
Justification
A partir des années 1960, de nombreuses études se sont intéressées au domaine de la biogéographie insulaire, c’est à dire à l’étude de la distribution et des dynamiques des espèces au sein des milieux insulaires (Whittaker & Fernández-Palacios 2007). Les travaux de MacArthur et Wilson (1964, 1967) sont particulièrement notables puisqu’ils ont permis de poser les bases de la biogéographie insulaire grâce à l’élaboration d’une théorie mathématisée, basée sur des données empiriques et résistant en grande partie à l’épreuve de la réfutabilité. Selon cette théorie, le nombre d’espèces trouvé sur une île est directement dépendant de deux principaux processus opposés : le taux d’immigration et le taux d’extinction, eux-mêmes influencés respectivement par l’isolement et la surface des îles. Les milieux insulaires ont alors intéressé de nombreux scientifiques car offrant un cadre utile pour répondre à plusieurs questions posées en écologie puisqu’étant clos et généralement moins complexes que les milieux continentaux ou océaniques. Plusieurs autres théories ont alors émergé, et notamment « le syndrome insulaire » (Adler & Levins 1994) ainsi que « la règle insulaire » (Lomolino 2005). Ces théories soulignent les effets des paysages fragmentés (naturellement dans le cas des îles) sur la démographie des populations ainsi que sur le phénotype des individus. Par exemple, elles mettent en évidence des phénomènes de gigantisme subit par les espèces de petite taille et à l’inverse de nanisme subit par les espèces de grande taille sur les îles. Elles ont également permis de faire le lien entre l’isolement et la surface des îles avec les dynamiques des populations. Ainsi plus une île est isolée (du continent et des autres îles) et plus les populations présentes devraient être denses et stables dans le temps. Les facteurs mécanistiques évoqués pour expliquer les différences populationnelles entre les îles de différentes surfaces sont de trois types : le taux de prédation, la compétition (inter- et intraspécifique) et la diversité d’habitat (Diamond 1975 ; Lomolino 1984 ; Triantis et al. 2003). Ces facteurs diffèreraient entre îles et continent ainsi qu’entre îles de différentes surfaces et auraient alors des conséquences sur les populations. Cependant, très peu d’études empiriques ont directement démontré le lien entre ces facteurs et la dynamique des populations insulaires, notamment en ce qui concerne le taux de prédation et la compétition.
Cette étude comporte quatre objectifs : premièrement, étudier le lien entre la densité des populations de micromammifères terrestres : la Souris sylvestre (Peromyscus maniculatus) et le Campagnol à dos roux de Gapper (Myodes gapperi) et les facteurs paysagers : île vs. continent et surface d’île. Ensuite mettre en relation la pression de prédation sur ces micromammifères selon les mêmes facteurs paysagers. Troisièmement, étudier si la pression de prédation a un effet sur les populations de proies. Enfin, étudier l’effet de la compétition interspécifique sur les densités de micromammifères.
Méthodes
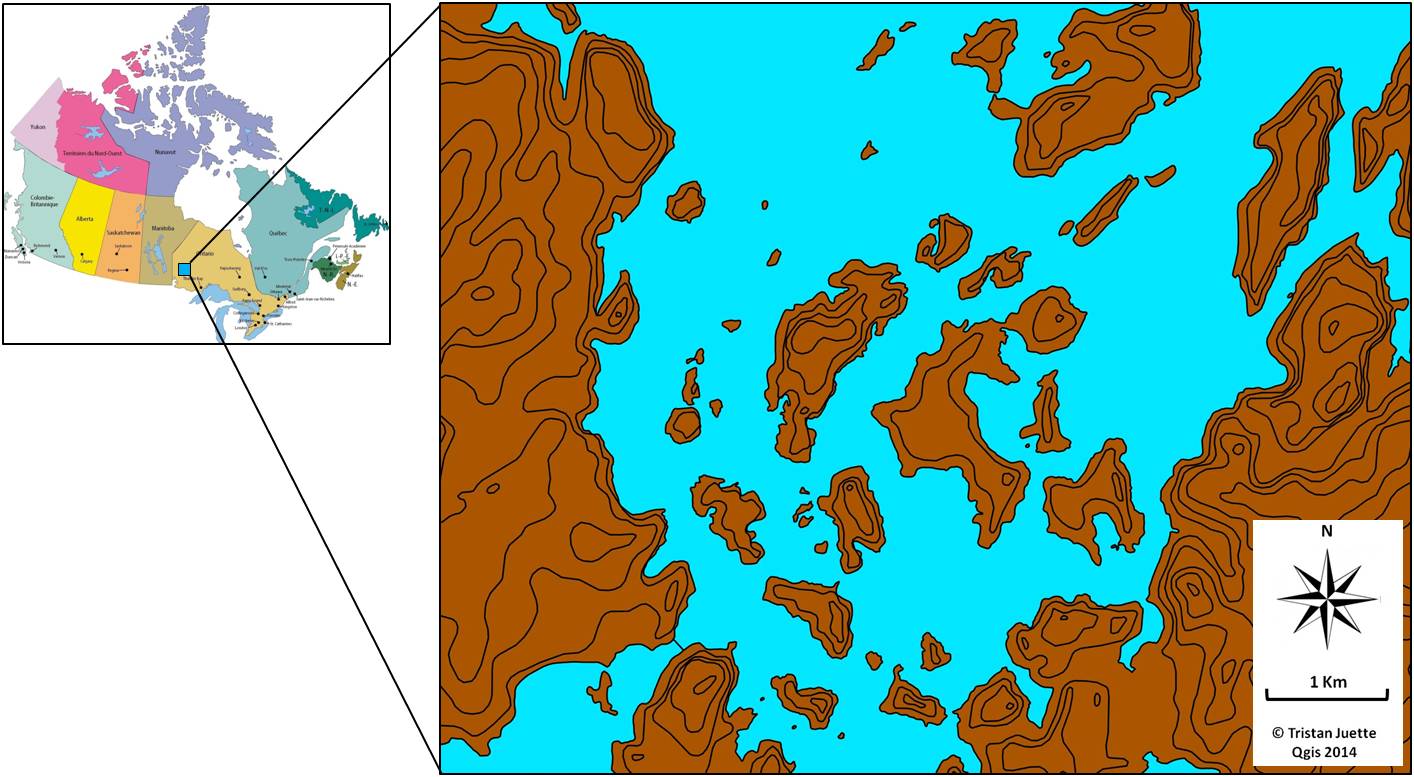
Figure 1. Carte du site d’étude. En haut à gauche : carte du Canada et localisation du site d’étude, Minaki, Nord-Ouest Ontario. Droite : carte détaillée du site d’échantillonnage.
Aire et modèles d’étude. Le site d’étude est situé dans le Nord-Ouest de l’Ontario, au Canada (N 49°58’51.3″ ; W 94°40’18.0″), dans un bassin versant de la rivière Winnipeg (Fig. 1). Au total 17 sites ont été échantillonnés : 5 sites continentaux et 12 sites insulaires répartis sur 10 îles ayant une surface variant entre 6,5 ha et 316,4 ha. L’isolement des îles varie également mais n’a pas été pris en compte dans le cadre de cette étude. La campagne d’échantillonnage a été faite durant l’été 2015 (juillet et août). Concernant les espèces de micromammifères terrestres, deux espèces ont été ciblées : la Souris sylvestre (Peromyscus maniculatus, Wagner 1845) et le Campagnol à dos roux de Gapper (Myodes gapperi, Vigors 1830), occupant des niches très similaires (Galindo & Krebs 1985). La Souris sylvestre est une espèce largement répartie à travers l’Amérique du Nord (Wilson & Reeder 2005) et occupant de nombreux habitats (King 1968). Cette espèce est nocturne, vit principalement au sol (Baker 1983) et est active toute l’année. La répartition du Campagnol à dos roux s’étend du nord du Mexique jusqu’au Canada (Wilson & Reeder 2005). C’est une espèce active pendant la nuit et le jour et toute l’année. Au sein de notre aire d’étude, les Souris sylvestre et Campagnols à dos roux représentent la majeure partie des micromammifères (94,5 %).
Méthode d’échantillonnage & métriques mesurées. La densité des micromammifères a été échantillonnée par capture grâce à une grille de pièges (longworth et BioEcoSS Tube Trap) disposés à 10 mètres d’intervalle, pour un total de 60 pièges par site (soit une surface de 200 m²/site). Chaque site a été échantillonné pendant 3 nuits minimum. Les individus capturés ont été marqués pour pouvoir mesurer le taux de capture par site. Sur 3 ans, 1089 micromammifères ont été capturés, dont 608 Campagnols et 386 Souris.
Afin de mesurer la pression de prédation, des caméras trappes (Dark Ops, Browning®) ont été disposées sur 8 sites insulaires et 4 sites continentaux. Cette méthode à été testée par plusieurs études et permet d’obtenir un échantillonnage représentatif (Silveira et al. 2003 ; Tobler et al. 2008). Les caméras ont été disposées en duo, aux quatre coins d’un carré d’une surface d’environ 300 m² et comprenant un autre duo de caméra en son centre (soit 10 caméras par site). Ces caméras nous ont permis de prendre des photos automatiquement de jour comme de nuit (avec lumière infrarouge). Afin de maximiser la probabilité de détecter les prédateurs présents, des appâts de moyenne portée ont été disposés. Cette grille d’échantillonnage a été laissée au minimum 6 nuits sur chaque site.
Cinq espèces, potentiellement prédatrices des micromammifères terrestres, ont été relevées (Fig. 2) : la Martre d’Amérique (Martes americana), le Pékan (Martes pennanti), le Raton-laveur commun (Procyon lotor), le Loup de l’Est (Canis lycaon) et l’Ours noir (Ursus americanus). Les photos prises ont ensuite permis de construire 3 métriques : le nombre d’espèce total, un indice de diversité (D-simpson, Simpson 1949) et enfin un indice d’activité des prédateurs. Enfin la surface des îles a été déterminée grâce à l’utilisation d’un logiciel de système d’information géographique (SIG) : Q-GIS (Quantum GIS Development team 2014).

Figure 2. Photos de quatre espèces prédatrices présentent sur l’aire d’étude : a) Martre d’Amérique (Martes americana), b) Raton-laveur commun (Procyon lotor), c) Loup de l’Est (Canis lycaon) et d) l’Ours noir (Ursus americanus).
Analyses des données. Toutes les analyses statistiques ont été traitées via la construction de modèles linéaires généralisés (GLM) sous le logiciel R (Core Team 2012). En plus de la variable indépendante d’intérêt, plusieurs variables ont été ajoutées aux modèles afin de contrôler la date d’échantillonnage (jour julien) et la localisation spatiale (longitude et latitude). Pour chaque variable dépendante plusieurs modèles ont donc été construits puis le meilleur, avec le plus petit AIC, a été sélectionné (package AICcmodavg, Mazerolle 2016).
Résultats et discussion
Effet des facteurs paysagers sur la densité de population de micromammifère terrestre. Le type de paysage, continent ou île, n’a pas d’effet sur les densités de populations de Souris sylvestre, de Campagnols à dos roux au sein de notre aire d’étude (respectivement : P = 0.877 et P = 0.168). Cependant, il a un effet sur la densité globale de micromammifères (P < 0.05) : elle est significativement plus élevée sur les îles que sur le continent. Ce résultat va dans le sens de nombreuses études précédentes qui montrent également que la densité est généralement plus élevée sur les îles que sur les continents, du fait d’un taux de dispersion réduit causé par la barrière paysagère les entourant (MacArthur et al. 1972).
La surface des îles n’a pas d’effet sur la densité de Souris (P = 0.944). Cependant, on trouve une tendance non significative entre la densité des populations de Campagnols et la surface des îles (r² = 0.27 ; P = 0.066) : plus la surface est réduite, plus cette densité tend à être forte (Fig. 3) et nous obtenons la même tendance pour la densité globale portant sur l’ensemble des micromammifères (r² = 0.32 ; P = 0.067 ; Fig. 3). Ces tendances vont également dans le sens de la plupart des études en milieu insulaire : plus la surface diminue et plus la densité est élevée (Simberloff 1976 ; Ricklefs & Lovette 1999).
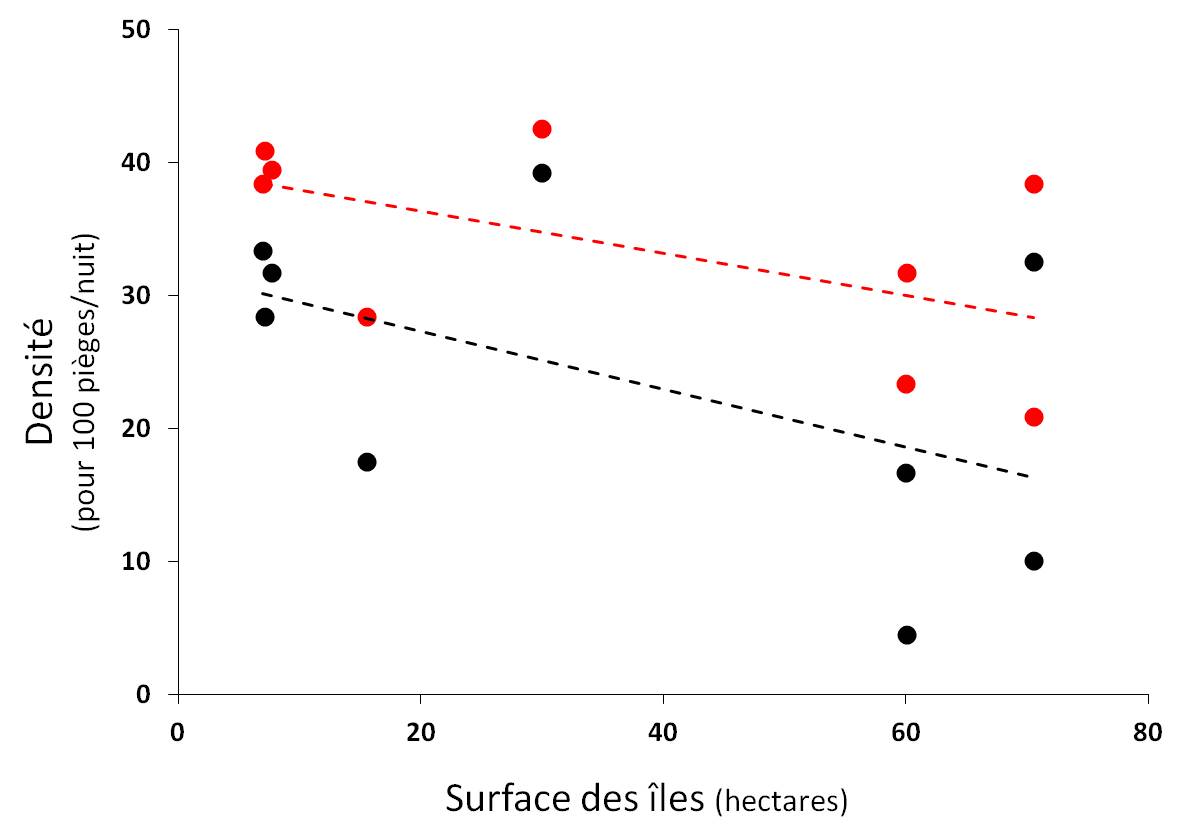
Figure 3. Relations (tendance non significative) entre la surface des îles et la densité globale des espèces de micromammifères (en rouge, r² = 0.32 ; P = 0.067) ainsi qu’avec la densité de Campagnols à dos roux de Gapper (en noir, r² = 0.27 ; P = 0.066)
Effet des facteurs paysagers sur le risque de prédation. Le type de paysage n’influence aucune des trois métriques construites à partir de l’échantillonnage des espèces prédatrices de micromammifères, à savoir le nombre d’espèce, l’indice de Simpson et l’indice d’activité des prédateurs (respectivement P = 0.229 ; P = 0.707 ; P = 0.653). La surface des îles ne semble pas non plus affecter ces trois indices (respectivement P = 0.201 ; P = 0.460 ; P = 0.939). Ces résultats semblent ne pas aller dans le sens des résultats classiquement trouvés dans la littérature et évoqués ci-dessus (Simberloff 1976 ; Ricklefs & Lovette 1999).
Lien entre risque de prédation et densité de micromammifères. Aucun des trois indices de risque de prédation, le nombre d’espèce, l’indice de Simpson et l’indice d’activité n’a de lien significatif avec la densité de Campagnols (respectivement P = 0.855 ; P = 0.980 ; P = 0.515), ni avec la densité globale de micromammifères (respectivement P = 0.465 ; P = 0.735 ; P = 0.420). Cependant la densité de Souris est significativement et positivement corrélée avec l’indice d’activité des prédateurs (r² = 0.57 ; P < 0.05). Ce résultat indique que sur les sites où la densité de Souris sylvestre est forte, le taux d’activité des prédateurs est également élevé (Fig. 4). Le nombre d’espèces prédatrices et l’indice de Simpson ne sont quant à eux pas corrélés avec la densité de Souris (respectivement P = 0.151 ; P = 0.515).
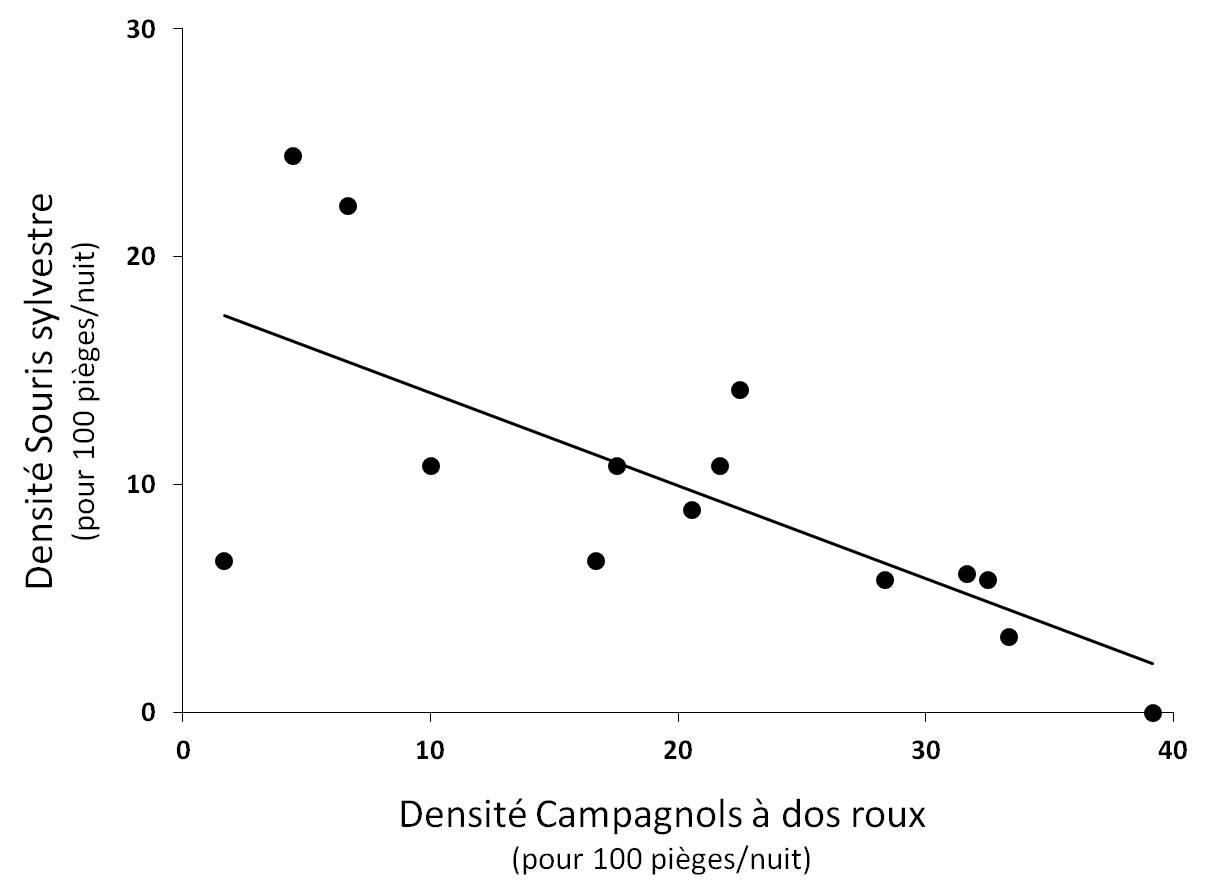
Figure 5. Relation significative entre la densité de Souris sylvestre et la densité de Campagnols à dos roux de Gapper (r² = 0.50 ; P < 0.001).
Compétition interspécifique. La communauté de micromammifères est principalement composée de Souris sylvestre et de Campagnols à dos roux au sein de notre aire d’étude, il ne sera donc question ici que des densités de populations de ces deux espèces. Il ressort de l’analyse statistique que les densités de Souris et de Campagnols sont significativement et négativement corrélées (r² = 0.50 ; P < 0.001 ; Fig. 5). Cela suggère que la compétition interspécifique structure spatialement la densité des populations de Souris et de Campagnols au sein de ce paysage insulaire.
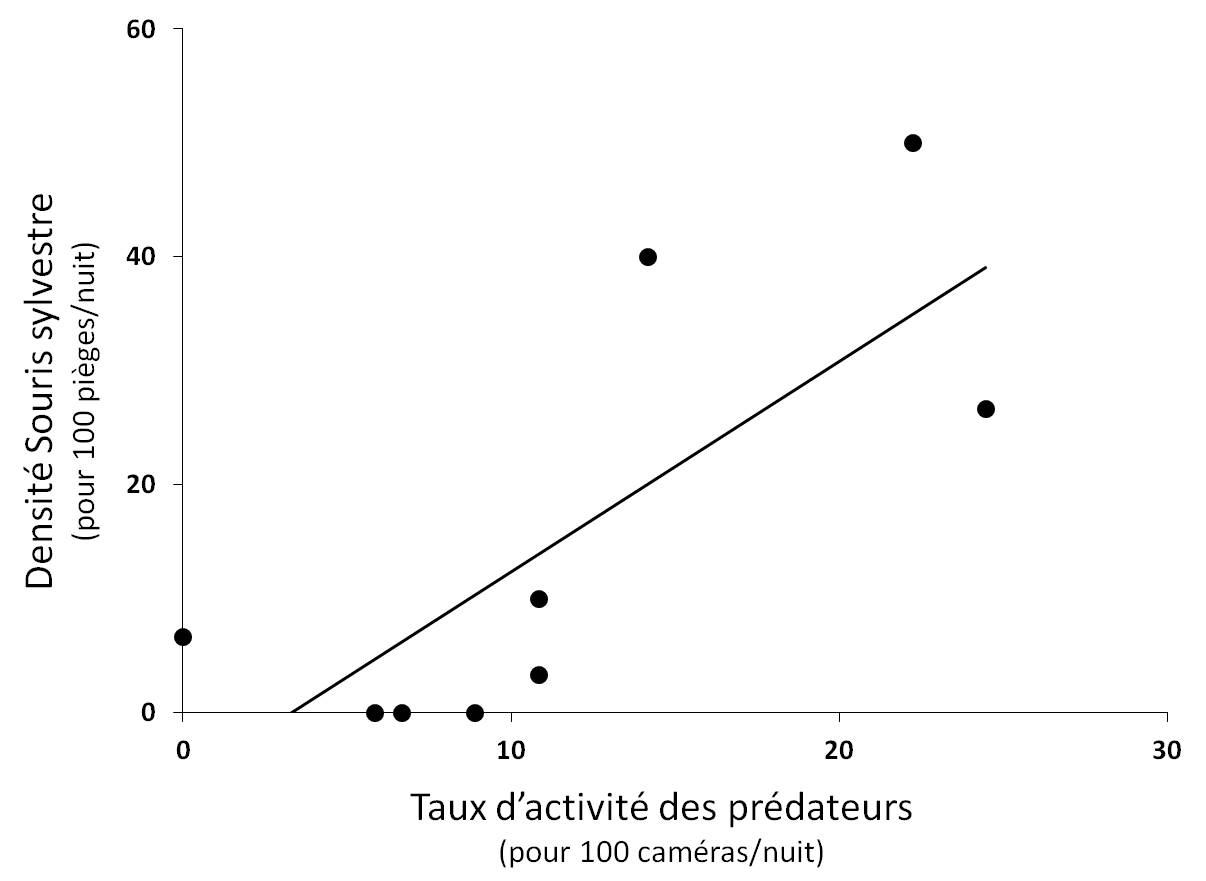
Figure 4. Relation significative entre la densité de Souris sylvestre et le taux d’activité des prédateurs (r² = 0.57 ; P < 0.05).
Discussion & Conclusion. Cette étude met en évidence l’existence de relations entre plusieurs niveaux d’organisation en biogéographie insulaire : paysage, communauté et populations (Fig. 6).
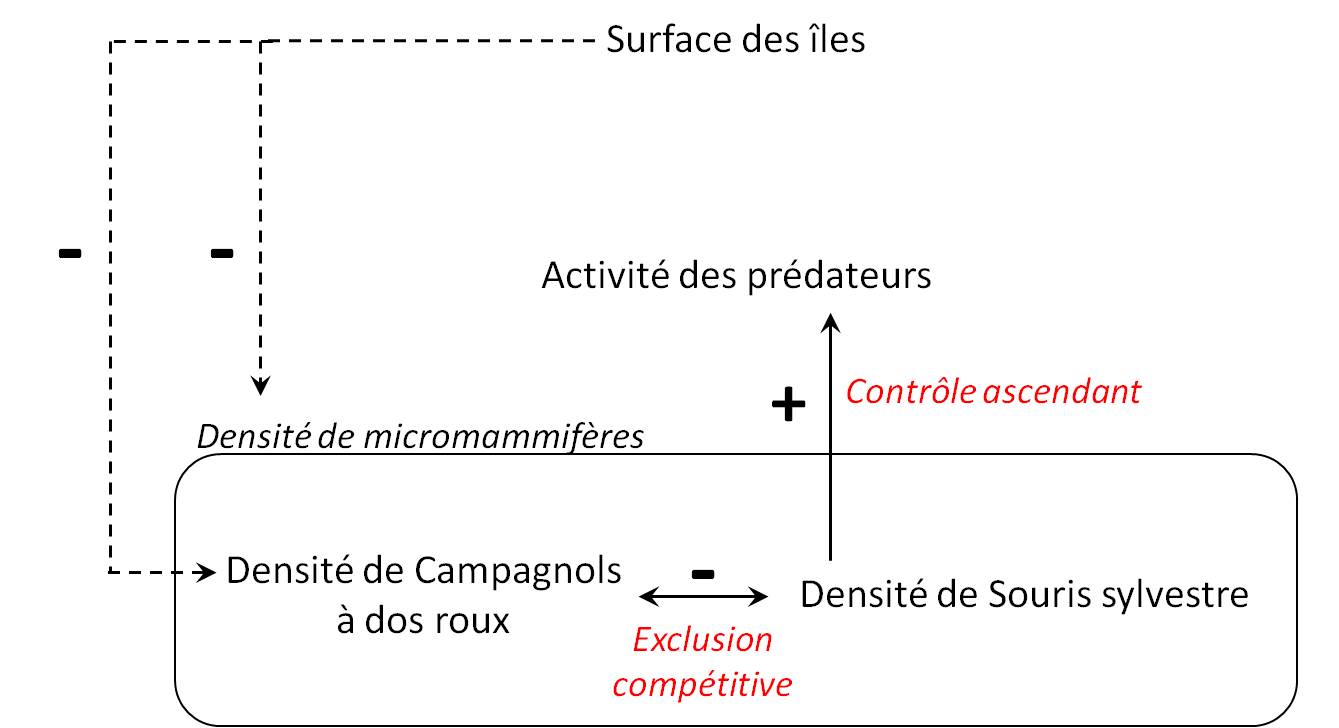
Figure 6. Schéma récapitulatif des principales relations mise en évidence dans le cadre de cette étude. Le sens des flèches symbolise l’action d’un premier compartiment (point de départ) sur un second compartiment (point d’arrivée). Les flèches pleines représentent les relations significatives et les flèches en pointillés représentent les tendances non-significatives. Enfin les signes « + » et « – » symbolisent le sens de la relation.
Ainsi, nous avons mis en évidence que la surface des îles tendait à influencer la densité de micromammifères et plus particulièrement les densités des populations de Campagnols à dos roux de Gapper. Ces derniers ont, de plus, une densité négativement corrélée à celle des Souris sylvestre : plus la densité de Campagnols est élevée, plus celle des Souris est faible et inversement. La compétition trophique entre ces deux espèces mènerait donc possiblement à une exclusion compétitive au sein du paysage insulaire (Diamond 1975). Une autre hypothèse serait que cette relation négative pourrait être dû au facteur habitat : les Souris et les Campagnols « choisiraient » différents types d’habitats et se répartiraient donc différemment sur les sites. Enfin la densité de souris est directement liée au taux d’activité des prédateurs : lorsque la densité des populations de Souris augmente, l’activité des prédateurs augmente également. Le taux d’activité des prédateurs peut être interprété comme un proxy du risque de prédation subit par les micromammifères et ce patron pourrait indiquer un effet ascendant (bottom-um) des populations de Souris vers leurs prédateurs et non l’inverse (Frederiksen et al. 2006). Ainsi la répartition spatiale des densités au sein de la métapopulation de Souris sylvestre permettrait d’expliquer la répartition spatiale de la pression de prédation au sein de notre site d’étude.
Afin de compléter cette étude, plusieurs pistes sont envisagées : tout d’abord afin d’augmenter le nombre de sites, une nouvelle campagne de terrain sera effectuée durant l’été 2016. De plus, plusieurs facteurs à différents niveaux peuvent être ajoutés tels que l’isolement des îles, les types d’habitats, l’incorporation des données de prédateurs aériens, les traits phénotypiques des individus au sein des populations de micromammifères.
Remerciements
Je tiens particulièrement à remercier les personnes ayant aidés à la récolte des données : Jean-Patrick Bourbonnière, Suzie Dubuc et Dawson Ogilvie ainsi que Caroline Hall, Joël Jameson et Denis Réale. Je remercie également la Société Française d’Ecologie qui a permis l’achat d’une partie des caméras trappes grâce l’allocation de la bourse de campagne de terrain SFE 2015.
Bibliographie
– Baker R. H., 1983. Michigan Mammals. Wayne State Univerisity Press.
– Diamond J. M., 1975. The island dilemma: lessons of modern biogeographic studies for the design of nature reserves. Biological Conservation 7: 129-146.
– Frederiksen M., Edwards M., Richardson A. J., Halliday N. C. & Wanless S., 2006. From plankton to top predators: bottom-up control of a marine food web across four trophic levels. Journal of Animal Ecology 75: 1259-1268.
– Galindo C. & Krebs C. J., 1984. Habitat use and abundance of deer mice: interactions with meadow voles and red-backed voles. Canadian Journal of Zoology 63: 1870-1879.
– King J. A., 1968. Biology of Peromyscus (Rodentia) (1st ed). The American Society of Mammalogists.
– Lomolino M. V., 1984. Mammalian island biogeography: effects of area, isolation and vagility. Oecologia 61: 376-382.
– Lomolino M. V., 2005. Body size evolution in insular vertebrates: generality of the island rule. Journal of Biogeography 32: 1683-1699.
– MacArthur R. H. & Wilson E. O., 1963. An equilibrium theory of insular zoogeography. Evolution 17: 373-387.
– MacArthur R. H. & Wilson E. O., 1967. The theory of Island Biography. Princeton University Press.
– MacArthur R. H., Diamond J. M. & Karr J. R., 1972. Density Compensation in Island Faunas. Ecology 53: 330-342.
– Mazerolle M. J., 2016. AICcmodavg: Model selection and multimodel inference based on (Q)AIC(c). R package version 2.0-4. http://CRAN.R-project.org/package=AICcmodavg
– Quantum GIS Development Team, 2014. Quantum GIS Geographic Information System. Open Source Geospatial Foundation Project. http://qgis.osgeo.org
– R Core Team, 2012. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.R-project.org/
– Ricklefs R. E. & Lovette I. J., 1999. The roles of island area per se and habitat diversity in the species-area relationships of four Lesser Antillean faunal groups. Ecology 68: 1142-1160.
– Silveira L., Jácomo A. T. A. & Diniz-Filhlo J. A. F., 2003. Camera trap, line transect and track surveys: a comparative evaluation. Biological Conservation 114: 351-355.
– Simberloff D., 1976. Experimental Zoogeography of Islands: Effects of Island Size. Ecology 57: 629-648.
– Simpson E. H., 1949. Measurement of diversity. Nature 163: 688.
– Tobler M. W., Carrillo-Percastegui S. E., Leite Pitman R., Mares R. & Powell G., 2008. An evaluation of camera traps for inventoring large- and medium-sized terrestrial rainforest mammals. Animal Conservation 11: 169-178.
– Triantis K. A., Mylonas M., Lika K. & Vardinoyannis K., 2003. A model for the species-area-habitat relationship. Journal of Biogeography 30: 19-27.
– Whittaker R. J. & Fernández-Palacios J. M., 2007. Island biogeography: ecology, evolution and conservation. Oxford University Press.
– Wilson D. E. & Reeder D. M., 2005. Mammal Species of the World (3rd ed). Johns Hopkins Press.


Commentaires récents